Книга: Удивительный мир органической химии
2.1. В глубь углеродного атома
| <<< Назад Глава 2 Углеродный атом — он самый главный |
Вперед >>> 2.2. «Жилище» для электронов — орбиталь |
2.1. В глубь углеродного атома
Атом углерода, как мы уже знаем, — основа всех органических соединений. Он является особым, уникальным элементом в природе.
Как устроен этот атом, какими свойствами он обладает?
Чтобы ответить на этот вопрос, давайте еще раз вспомним о строении атома — этой наименьшей частице химического элемента.
Атом, являясь носителем свойств элемента, как известно, состоит из положительно заряженного ядра, в котором сосредоточена почти вся масса атома, и отрицательно заряженных частиц — электронов, окружающих ядро. В состав ядра входят положительно заряженные частицы — протоны и нейтральные частицы — нейтроны. Суммарное число этих частиц равно массовому числу атома (ядра). Поэтому, хотя ядро очень мало (одна стотысячная диаметра атома), оно ответственно за всю «тяжесть» атома. Электронов в атоме столько, сколько протонов в ядре. Поэтому атом — нейтральная частица.
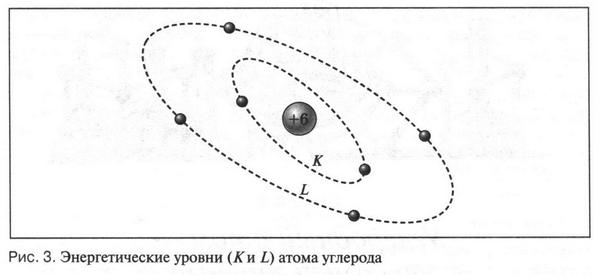
Теперь рассмотрим атом углерода. Заряд его ядра равен +6. Это означает, что у атома углерода должно быть 6 электронов, которые располагаются на двух электронных оболочках (слоях). На ближней к ядру оболочке (К-оболочка) находятся два электрона, а на наружной оболочке (L-оболочка) — четыре (рис. 3). Два электрона на K-оболочке не принимают участия в химических реакциях, так как прочно связаны со «своим» ядром. Электроны, которые расположены на L-оболочке, очень активны и от них зависит химическое поведение атома углерода. Но таких «активных» электронов у атома углерода всего четыре, т. е. его наружная электронная оболочка заполнена лишь наполовину (по сравнению с внешними электронными оболочками инертных газов). В этом и состоит одна из особенностей атома углерода. Может ли этот атом образовать устойчивую электронную оболочку из восьми (или двух) электронов? Казалось бы, все очень просто: он должен отдать или принять четыре электрона. Однако это сделать очень непросто.
Допустим, что атом углерода отдал один электрон. В этом случае шесть положительных зарядов ядра начнут преобладать над оставшимися пятью электронами (ведь атом должен оставаться электронейтральным!). Отдать второй электрон еще труднее. Говорить же об отрыве большого числа электронов от ядра вообще не приходится. Слишком сильным будет притяжение оставшихся электронов к ядру. А могут ли электроны, наоборот, присоединяться к ядру? Нет, не могут. Дело в том, что чем больше электронов будет находиться на внешней оболочке, тем большим будет избыточный отрицательный заряд. А поскольку одноименные заряды отталкиваются, то присоединение новых электронов (до полного октета, т. е. восьми) будет все больше и больше затруднено. Вот почему атом углерода только в исключительных случаях образует ионы.
Электроны разных оболочек различаются энергиями. Поэтому электронные оболочки называют еще энергетическими уровнями. Их обозначают или большими латинскими буквами (К, L, М, N и т. д.), или арабскими цифрами (1, 2, 3, 4 и т. д.). Чем дальше от ядра находятся энергетические уровни, тем большей энергией обладают их электроны. При этом энергия электронов одного и того же энергетического уровня примерно одинакова. Почему примерно, а не одинакова? Потому что электроны одного энергетического уровня образуют еще и энергетические подуровни. На одном подуровне размещены электроны с одинаковой энергией, а на разных — с несколько отличающейся. Сколько же подуровней содержится на каждом уровне? Это легко запомнить: число подуровней равно номеру энергетического уровня. Например, первый энергетический уровень содержит один подуровень, второй — два, третий — три и т. д. Поскольку речь идет об атоме углерода, то его первый энергетический уровень приравнивается к одному подуровню, а второй состоит из двух подуровней. Это можно изобразить в виде такой схемы:

Разные энергетические уровни условно обозначают разными по величине квадратами (меньше энергии — меньше квадрат, больше энергии — больше квадрат). Внутри квадратов в виде черточек расположены подуровни, которые обозначены латинскими буквами — s, р. Черточки расположены одна выше другой. Чем выше черточка, тем большей энергией обладают электроны, «населяющие» данный подуровень.
Нам остается выяснить, какие электроны и сколько их размещается на энергетических подуровнях атома углерода. Но вначале поговорим о самой загадочной частице — электроне.
| <<< Назад Глава 2 Углеродный атом — он самый главный |
Вперед >>> 2.2. «Жилище» для электронов — орбиталь |
- Покорение Европы
- Фолатный путь восстановления одноуглеродных групп
- 3. Время имеет значение
- Количественные оценки экзарации
- Миф № 8 Датировки древних костей – «все эти миллионы лет» – получены сомнительными методами («с потолка»), с помощью ряд...
- 16. Великие доисторические дебри
- 14. История, хранящаяся в ДНК
- Трансляция
- Вода, спринцовка жизни
- 1.2.6. Гравитация, инерция и приливные силы
- § 72 Как создать движущееся изображение
- 5.2. Абиотические факторы среды
