Книга: Вопрос жизни [Энергия, эволюция и происхождение сложности]
Глава 7 Сила и слава
| <<< Назад Часть IV Предсказания |
Вперед >>> Эпилог Из глубины |
Разделы на этой странице:
Глава 7
Сила и слава
Христос Пантократор, Спас Вседержитель. Быть может, даже за рамками православной иконографии не найдется более серьезного вызова для художника, чем изобразить Христа в “двух лицах” – и Бога, и человека, сурового, но справедливого судию. Книга в его левой руке – это, по всей видимости, Евангелие от Иоанна: “Я свет миру; кто последует за Мною, тот не будет ходить во тьме, но будет иметь свет жизни”. Учитывая серьезность этого заявления и ответственность, которую оно влечет, неудивительно, что Вседержитель так строг. Художник решил, что отразить в человеческом лице присутствие божественного духа недостаточно: лик Христа должен быть выложен мозаикой под куполом красивейшего собора, высоко над алтарем. Сколь же огромным было мастерство художника, верно передавшего перспективу, игру света и тени на лице, сложившего из кусочков камня осмысленную картину, в которой каждый фрагмент мозаики абсолютно необходим. Некоторые изображения Создателя нас совершенно не впечатляют, порой даже смешат, но в своих лучших воплощениях – например в соборе Чефалу на Сицилии – даже тот, чья вера слаба, узнает руку Господа в бессмертном памятнике гению неизвестного мастера[92].
Нет, я не собирался уходить от основной темы. Просто меня поражает, насколько мозаики привлекательны для ума, и – вот совпадение! – то, насколько важное место идея мозаики занимает в биологии. Может ли существовать подсознательная связь между модульным строением белков и клеток и нашим эстетическим чувством? Наши глаза состоят из миллионов фоторецепторных клеток – палочек и колбочек. Каждый рецептор включается или выключается под действием луча света, и вместе они составляют картину. В мозге эта картина воссоздается в виде нейронной мозаики, передающей все свойства исходной картины: яркость, цвет, контраст, границы, движение. Мозаики волнуют нас отчасти потому, что они дробят реальность так же, как это делает мозг. Клетки могут осуществлять это за счет того, что они – модульные единицы, каждая на своем месте в мозаике, живые фрагменты с собственной задачей. А 40 млрд кусочков составляют удивительную трехмерную мозаику: человека.
Мозаики распространены и на более глубоком уровне: биохимии. Митохондрии (огромные дыхательные комплексы, которые переносят электроны от пищи на кислород, одновременно перекачивая протоны через митохондриальную мембрану) – это также мозаики, сложенные из многочисленных субъединиц. Самый крупный – комплекс I – образован 45 белками, и каждый белок составлен из сотен аминокислотных остатков, соединенных в длинную цепь. Эти комплексы нередко группируются в более крупные ансамбли, “суперкомплексы”, которые формируют своего рода конвейер, переносящий электроны к кислороду. Тысячи суперкомплексов, каждый – неповторимая мозаика, украшают величественный собор – митохондрию. Качество таких мозаик жизненно важно. При виде комичного Вседержителя можно и не засмеяться, а вот малейшая ошибка в расположении кусочков, составляющих дыхательные белки, может обернуться для клетки катастрофой библейского масштаба. Если хотя бы одна аминокислота – единственный камешек во всей мозаике – окажется не на месте, последствия могут быть ужасными: может возникнуть митохондриальное заболевание, которое влечет за собой фатальную дегенерацию мышц и мозга и раннюю смерть. Степень тяжести последствий и возможный возраст проявления таких генетических изменений непредсказуемы. Это зависит лишь от того, какой фрагмент подвергается воздействию и как часто. Однако все они отражают важность митохондрий для нашего существования.
Итак, митохондрии – это мозаики, а их качество – вопрос жизни и смерти. Но это не все! Подобно Вседержителю, дыхательные белки имеют двойственную природу: митохондриальную и ядерную (рис. 31). Большая доля белков во внутренней мембране митохондрии (показаны более темным цветом) кодируется собственными генами митохондрий. Остальные белки (они окрашены светлее) закодированы в ядерных генах. В начале 70-х годов стало ясно, что митохондриальный геном слишком мал для того, чтобы закодировать большую часть митохондриальных белков. Поэтому давняя идея, будто митохондрии и поныне остаются независимыми от клеток-хозяев, не имеет никакого смысла. Их способность делиться, когда им заблагорассудится, эта мнимая их автономность, вызывающая суеверный трепет, – мираж. Работа митохондрий точно зависит от двух геномов. Митохондрии могут функционировать и расти лишь в том случае, если они снабжены полным набором белков и митохондриального, и ядерного происхождения.

Рис. 31. “Мозаичная” дыхательная цепь.
Изображены белковые структуры комплекса I (у левого края), комплекса III (слева), комплекса IV (справа) и АТФ-синтазы (у правого края). Все они встроены во внутреннюю митохондриальную мембрану. Более темные субъединицы, которые почти полностью погружены в мембрану, кодируются митохондриальными генами. Светлые субъединицы, расположенные главным образом на периферии мембраны или вне ее, кодируются ядерными генами. Митохондриальный и ядерный геномы эволюционировали в различных направлениях: митохондриальные гены передавались “бесполым” путем от матери к дочери, а ядерные гены в каждом поколении рекомбинировали при половом процессе. К тому же митохондриальные гены (у животных) накапливают мутации в 50 раз быстрее, чем ядерные. Несмотря на эту тенденцию к расхождению, естественный отбор в целом способен элиминировать дисфункциональные экземпляры, миллиарды лет обеспечивая прекрасную работу митохондрий.
Я хочу, чтобы вы по-настоящему прониклись тем, насколько все это странно. Клеточное дыхание, без которого мы умрем в считанные минуты, осуществляют мозаичные дыхательные цепи из белков, которые кодируются двумя разными геномами. Чтобы достичь кислорода, электроны должны пройти по дыхательной цепи, перескакивая от одного окислительно-восстановительного центра к другому. Как правило, окислительно-восстановительные центры, приняв электрон, сразу же отдают его: электрон прыгает по ним, будто с кочки на кочку на болоте (гл. 2). Окислительно-восстановительные центры спрятаны глубоко внутри дыхательных белков, их точное расположение определяется нуклеотидными последовательностями ядерных и митохондриальных генов. Как уже было сказано, электроны перемещаются путем квантового туннелирования. Они возникают и исчезают в каждом окислительно-восстановительном центре с вероятностью, которая зависит от нескольких факторов: от силы притяжения кислорода (точнее, от восстановительного потенциала следующего по ходу окислительно-восстановительного центра), от расстояния между соседними центрами и от того, занят ли электроном следующий центр. Точное расстояние между окислительно-восстановительными центрами очень-очень важно. Квантовое туннелирование происходит лишь на очень коротких дистанциях – менее 14 ? (напоминаю, ангстрем – это мера длины, примерно равная диаметру атома). Если расстояние между окислительно-восстановительными центрами окажется несколько большим (с тем же успехом оно может быть и бесконечно большим), результат один: вероятность скачка электрона с одного на другой будет стремиться к нулю. В пределах допустимых значений скорость перемещения электрона будет зависеть от дистанции между центрами. А она зависит от того, как между собой взаимодействуют два генома.
При увеличении дистанции между центрами на 1 ? скорость переноса электрона падает примерно в 10 раз. Повторю: скорость переноса электрона снижается в 10 раз с каждым дополнительным ангстремом между окислительно-восстановительными центрами! Это примерно те масштабы, на каких осуществляются электростатические взаимодействия между соседними атомами – например “водородные связи” между отрицательно и положительно заряженными аминокислотами в белках. Если из-за мутации произойдет замена какой-нибудь аминокислоты в белке, водородные связи могут разрушиться или же возникнуть в другом месте. Целые сети водородных связей могут немного сместиться – в том числе те, которые обеспечивают правильное положение окислительно-восстановительных центров. Смещение может составить около ангстрема. Последствия таких сдвигов могут сильно повлиять на квантовое туннелирование: один ангстрем может либо на порядок замедлить перенос электрона, либо ускорить его во столько же раз. Это одна из причин, почему митохондриальные мутации могут быть фатальными.
Опасное положение усугубляется еще и тем, что митохондриальные и ядерные геномы со временем все больше расходятся. Из предыдущей главы мы знаем, что возникновение полового размножения и двух полов могло быть связано с приобретением митохондрий. Половое размножение нужно, чтобы поддерживать в рабочем состоянии отдельные гены в составе больших геномов, тогда как два пола помогают сохранять качество митохондрий. Непредвиденным последствием явилось то, что эволюция этих двух геномов пошла совершенно разными путями. Ядерные гены рекомбинируют в каждом поколении при половом процессе, а митохондриальные гены передаются от матери к дочери через яйцеклетку, рекомбинируя очень редко (если такое вообще бывает). Хуже того: митохондриальные гены эволюционируют в 10–50 раз быстрее ядерных (если сравнивать скорость изменения последовательностей по мере смены поколений) – по крайней мере, у животных. Значит, белки, кодируемые митохондриальными генами, изменяются быстрее и в другом направлении, нежели белки ядерного происхождения. При этом они должны сохранять способность взаимодействовать друг с другом с точностью до ангстрема, чтобы транспорт электронов по цепи был эффективным. Трудно представить более абсурдный способ организации процесса, ключевого для жизни всех существ – дыхания!
Данный пример как нельзя лучше демонстрирует недальновидность эволюции. Это безрассудное решение скорее всего было неизбежным. Вспомните, с чего все начиналось: бактерия, живущая внутри другой бактерии. Без эндосимбиоза, как мы выяснили, сложная жизнь невозможна, потому что только самовоспроизводящиеся клетки способны утрачивать лишние гены, оставляя лишь нужные для локального контроля дыхания. Звучит достаточно убедительно, однако потерю генов ограничивает только естественный отбор – а отбор действует и на клетку-хозяина, и на митохондрии. Что приводит к утрате генов? Отчасти это связано со скоростью репликации: бактерии с самыми маленькими геномами осуществляют репликацию быстрее всех, благодаря чему со временем начинают преобладать. Однако скорость репликации не может объяснить перемещение генов в ядро – лишь утрату генов митохондрией. Мы выяснили, почему митохондриальные гены перешли в ядро: некоторые митохондрии погибали, извергая свою ДНК в клетку-хозяина, а затем эта ДНК проникала в ядро. Этому было сложно помешать. Некоторые из фрагментов ДНК, обосновавшихся в ядре, приобрели сигнальную последовательность, адресный код, который направляет белки обратно в митохондрии.
Может показаться, что такое должно происходить очень редко, однако известно почти 1,5 тыс. белков, адресующихся в митохондрии. По всей видимости, это не так уж трудно обеспечить. Некоторое время копии одного и того же гена должны были присутствовать одновременно в ядре и в выживших митохондриях. В итоге одна из двух копий утрачивалась. За исключением 13 белок-кодирующих генов, оставшихся в митохондриальном геноме (< 1 % исходного генома), всегда сохранялась ядерная копия, а митохондриальная терялась. Не слишком похоже на случайность. Почему же ядерная копия была предпочтительнее? На то есть множество веских причин, но теоретические изыскания пока ничего не подтверждают точно. Одна из причин – увеличение приспособленности самцов. Поскольку митохондрии передаются по женской линии, невозможно отобрать варианты митохондриальных генов, которые повышали бы мужскую приспособленность. Митохондриальные гены, которые случайно оказались полезны для самцов, никогда не передаются следующему поколению. Перемещение таких митохондриальных генов в ядро, откуда они могут передаваться потомкам обоих полов, могло обеспечить повышение приспособленности самцов наравне с самками. К тому же ядерные гены рекомбинируют при половом процессе в каждом поколении – благодаря этому приспособленность может повышаться. Важно и то, что митохондриальные гены физически занимают пространство, в котором лучше разместить машинерию для дыхания или других важных процессов. Наконец, при дыхании образуются активные свободные радикалы, способные вызвать мутации в близлежащей митохондриальной ДНК (позднее мы вернемся к вопросу влияния свободных радикалов на физиологию клетки). Как видите, есть множество причин переместить гены из митохондрий в ядро. Удивительно, что вообще хоть какие-нибудь гены остались митохондриальными.
Почему так случилось? Сила, которая удерживает гены в митохондриях (гл. 5), – это необходимость локальной регуляции процессов дыхания. Вспомните: электрический потенциал на тонкой внутренней митохондриальной мембране равен 150–200 милливольтам и порождает напряженность электрического поля в 30 миллионов вольт на метр – как у удара молнии. Гены нужны, чтобы контролировать этот колоссальный потенциал в соответствии с изменениями потока электронов, доступности кислорода, количества АДФ и АТФ, числом дыхательных белков и т. д. Если ген, необходимый для контроля дыхания, переместится в ядро, а его белковый продукт не успеет вовремя добраться до митохондрии, чтобы предотвратить катастрофу, на этом “эксперимент природы” закончится. Животные (и растения), не переместившие этот ген в ядро, выживут. Те, которые переместили ген, который перемещать не следовало, – умрут, унеся в могилу неправильно расположенные гены.
Отбор слеп и безжалостен. Гены постоянно переносятся из митохондрий в ядро. Если новое расположение генов окажется удачным, гены останутся на новом месте. Если же нет, то, скорее всего, придется расстаться с жизнью. В итоге почти все митохондриальные гены были либо утрачены, либо переместились в ядро, а в митохондриях осталась лишь горстка наиболее важных генов. Слепой отбор – вот благодаря чему были построены наши мозаичные дыхательные цепи. И это действительно работает. Сомневаюсь, что инженер спроектировал бы все так, но, боюсь, это единственный вариант устройства сложной клетки, который мог получиться в результате естественного отбора, учитывая необходимость эндосимбиоза прокариот. Это нелепое решение было неизбежным. В этой главе мы рассмотрим последствия мозаичности митохондрий: насколько сильно эта необходимость сказалась на свойствах сложных клеток? Я докажу, что отбором на двойственность митохондрий могут объясняться самые загадочные общие признаки эукариот. Этот отбор повлиял на наше здоровье, приспособленность, плодовитость, продолжительность жизни и на историю нашего вида.
О происхождении видов
Как и на что действует естественный отбор? (То, что он вообще действует, мы знаем точно.) Анализ последовательностей множества генов служит неопровержимым доказательством того, что долгое время шел отбор на коадаптацию митохондриальных и ядерных генов: изменения генов этих двух групп связаны. Мы можем сравнить скорость изменений митохондриальных и ядерных генов, скажем, на промежутке в несколько миллионов лет, который отделяет шимпанзе от общего предка людей или горилл. Мы сразу увидим, что гены, непосредственно взаимодействующие друг с другом (например кодирующие белки дыхательной цепи), изменяются примерно с равной скоростью, а остальные ядерные гены изменяются (то есть эволюционируют), как правило, значительно медленнее. Понятно, что изменение митохондриального гена, как правило, приводит к компенсирующему изменению во взаимодействующем с ним ядерном гене, и наоборот. Итак, налицо некая форма отбора. Вопрос в том, какие процессы участвуют в достижении коадаптации.
Ответ кроется в биофизике самой дыхательной цепи. Представим, что произойдет, если ядерные и митохондриальные геномы не будут соответствовать друг другу. Электроны поступают в дыхательную цепь, но плохо коадаптированные геномы кодируют плохо подогнанные друг к другу белки. Некоторые электростатические взаимодействия между аминокислотами (водородные связи) разрушаются, и в результате один или два окислительно-восстановительных центра могут оказаться друг от друга дальше на ангстрем, чем в норме. В итоге скорость потока электронов по дыхательной цепи к кислороду падает, они начинают скапливаться на нескольких первых окислительно-восстановительных центрах, поскольку двигаться дальше нельзя: все следующие окислительно-восстановительные центры уже заняты. Дыхательная цепь оказывается перевосстановленной. В сущности, это означает, что ее окислительно-восстановительные центры переполняются электронами (рис. 32). Первые окислительно-восстановительные центры представляют собой железосерные кластеры. Ион железа в них переходит из окисленной формы Fe3+ в восстановленную Fe2+, которая может непосредственно реагировать с кислородом с образованием отрицательно заряженного супероксидного анион-радикала O2•–. Точка в записи его формулы обозначает неспаренный электрон – отличительный признак свободного радикала. Ведет он себя в клетке не менее разрушительно, чем лис в курятнике.

Рис. 32. Роль митохондрий в механизме клеточной смерти.
На схеме А изображен нормальный транспорт электронов по дыхательной цепи к кислороду (волнистая стрелка), при котором энергия потока электронов перекачивает протоны через мембрану, а за счет потока протонов через АТФ-синтазу (справа) синтезируется АТФ. Светло-серый цвет, которым изображены три дыхательных комплекса в мембране, указывает на то, что эти комплексы не перевосстановлены, так как электроны быстро передаются на кислород и не накапливаются. На схеме Б показаны эффекты замедления транспорта электронов из-за несовместимости митохондриального и ядерного геномов. Замедление потока электронов ведет к снижению потребления кислорода, ограничению транспорта протонов, падению мембранного потенциала (поскольку число перекачиваемых протонов уменьшается) и прекращению синтеза АТФ. Темный цвет дыхательных комплексов символизирует накопление электронов в дыхательной цепи. Перевосстановленность комплекса I повышает его реакционную способность: он начинает реагировать с кислородом с образованием свободных радикалов, например супероксидного анион-радикала (O2•-). Если ситуацию, представленную на схеме В, не исправить в течение нескольких минут, свободные радикалы начнут реагировать с мембранными липидами, в том числе кардиолипином, и это приведет к высвобождению цитохрома c (небольшой молекулы, которая на схемах А и Б непрочно связана с мембраной, а на схеме В от нее открепляется). Потеря цитохрома c полностью останавливает транспорт электронов на кислород, что еще в большей степени перевосстанавливает дыхательные комплексы (показано черным цветом), усиливает выработку свободных радикалов, приводит к исчезновению протонного градиента и прекращению синтеза АТФ. Вместе эти факторы запускают сигнальный каскад, приводящий к апоптозу.
Существует множество механизмов, которые эффективно предотвращают накопление супероксидных радикалов. Из задействованных в этом ферментов особенно важна супероксиддисмутаза. Количество таких ферментов в клетке должно быть очень точно сбалансировано. Если их будет слишком много, это может подавлять жизненно важные локальные сигналы, служащие подобием пожарной сигнализации. Свободные радикалы – нечто вроде дыма: если устранить дым, это не потушит пожар и не решит проблему. В этом случае проблема заключается в плохой согласованности работы двух геномов. Поток электронов в цепи прерывается, что приводит к образованию супероксидных радикалов – “пожарного извещателя”[93]. При достижении некоторой пороговой концентрации свободные радикалы начинают окислять близлежащие мембранные липиды. Особую роль играет окисление кардиолипина, приводящее к высвобождению цитохрома c – белка дыхательной цепи, который в норме непрочно связан с кардиолипином. Это совершенно останавливает поток электронов: чтобы добраться до кислорода, им нужно сначала перескочить на цитохром c. Если убрать цитохром c, электроны не смогут добраться до конца дыхательной цепи. А поскольку без потока электронов не может быть транспорта протонов, вскоре наступает коллапс мембранного потенциала. Итак, при рассогласовании ядерного и митохондриального геномов мы наблюдаем три процесса. Во-первых, происходит замедление потока электронов и, как следствие, падает скорость синтеза АТФ. Во-вторых, перевосстановленные железосерные кластеры реагируют с кислородом, что приводит к выбросу свободных радикалов и высвобождению цитохрома c за счет открепления его от мембраны. И, в-третьих, если нет ничего, что может предотвратить эти изменения, то исчезает мембранный потенциал (рис. 32).
Выше я описал комплекс необычных процессов, открытых в середине 90-х годов. Тогда они привели ученых в глубокое недоумение. Совокупность этих процессов представляет собой сигнал, запускающий процесс программируемой клеточной смерти (апоптоза). Апоптоз – не беспорядочный распад клетки, а тщательно спланированное самоубийство, танец смерти, балет “Умирающий лебедь” на внутриклеточном уровне. Когда клетка вступает в апоптоз, внутри нее высвобождается целая армия белковых палачей – каспаз, ферментов, которые разносят на куски ее ДНК, РНК и белки. Фрагменты клеточного содержимого упаковываются в маленькие мембранные пузырьки – блебы, которые пожираются окружающими клетками. За пару часов клетка исчезает без следа, как иногда случалось с людьми в Советском Союзе.
В многоклеточных организмах апоптоз играет очень важную роль. Он необходим в эмбриональном развитии для придания тканям необходимой формы, а также для уничтожения поврежденных клеток. Но то, что центральную роль в этом процессе играют митохондрии (а именно – один из белков дыхательной цепи – цитохром c), оказалось неожиданностью. Как так вышло, что потеря цитохрома c стала служить сигналом, запускающим клеточную смерть? С момента открытия этого механизма загадок стало только больше. Оказалось, один и тот же набор признаков (падение уровня АТФ, накопление свободных радикалов, высвобождение цитохрома c и исчезновение мембранного потенциала) служит сигналом для апоптоза у всех эукариот, даже у таких дальних родственников, как растения и дрожжи. Этого не ожидал никто. Но тем не менее возникновение апоптоза – неизбежное следствие естественного отбора, который действует на два генома. А это уже закономерное свойство, универсальное для сложной жизни.
Вернемся к электронам, которые движутся по нарушенной дыхательной цепи. Если работа митохондриальных и ядерных генов плохо согласована, это приведет к апоптозу. Вот великолепный пример того, как процесс естественного отбора, однажды начавшись, не может остановиться: тенденция, однажды поддержанная отбором, в конечном счете превращается в изощренный генетический механизм, в основе которого, однако, сохраняется его источник. Большой, сложной клетке в любом случае необходимы для жизни два генома. Работа геномов должна быть согласована, иначе невозможны дыхательные процессы. В случае несогласованной работы геномов клетка вступает в апоптоз и погибает. В настоящее время апоптоз можно рассматривать как форму естественного отбора против клеток, у которых рассогласованы геномы митохондрий и ядра. Ведь, как говорил генетик Феодосий Добржанский, ничто в биологии не имеет смысла, кроме как в свете эволюции.
Так появился механизм, уничтожающий клетки с рассогласованными геномами. Выживают клетки, геномы которых работают слаженно. В ходе эволюции это привело к тому, что мы наблюдаем сейчас: к коадаптации митохондриальных и ядерных геномов, когда изменения в одном геноме компенсируются изменениями в другом. Как я упоминал, наличие двух полов увеличивает разнообразие женских гамет: большинство яйцеклеткок содержит клональные популяции митохондрий разного происхождения. Некоторые из этих митохондрий в присутствии генома оплодотворенной яйцеклетки будут работать лучше, другие – хуже. Те, что будут работать плохо, запустят апоптоз и погибнут вместе с клеткой. Хорошо функционирующие митохондрии, напротив, выживут.
У многоклеточных организмов выживание во многом определяется развитием. Оплодотворенная яйцеклетка (зигота) в ходе многих клеточных делений превращается в новую особь. Этот процесс требует очень точного контроля. Если в результате апоптоза какие-нибудь клетки непредвиденно гибнут, это может нарушить всю программу развития и привести к выкидышу, к остановке эмбрионального развития. Это не обязательно плохо. С точки зрения естественного отбора, лучше прервать развитие на ранней стадии и не тратить ресурсы, чем позволить плохо приспособленному организму развиться до конца. Ведь в последнем случае ядерные и митохондриальные гены будут плохо совместимы друг с другом, что может вызывать митохондриальные заболевания, нарушения жизнедеятельности и раннюю смерть. С другой стороны, раннее прекращение развития в том случае, если у эмбриона обнаруживаются рассогласования в работе митохондриального и ядерного геномов, закономерно приводит к снижению рождаемости. Если преобладающая часть эмбрионов оказывается не способна развиться до взрослого состояния, это может привести к бесплодию. На одной чаше весов оказывается приспособленность потомства, на второй – плодовитость. Эти затраты и прибыли определяют ход естественного отбора. Ясно, что нужен точный механизм, определяющий, какие рассогласования геномов должны запускать апоптоз, а с какими вполне можно жить.
Действительно ли это реализуется в природе? Да – известно несколько случаев. Впрочем, это может оказаться лишь вершиной айсберга. Пожалуй, самый показательный пример обнаружил Рон Бертон. Он дольше десяти лет исследовал митохондриально-ядерные несовместимости у морских веслоногих рачков Tigriopus californicus. Это животные длиной 1–2 мм, обитающие почти во всех влажных местах, в частности, на литорали острова Санта-Крус у побережья Калифорнии. Бертон скрещивал рачков из двух популяций, которые несколько тысячелетий были репродуктивно изолированы друг от друга, хотя их разделяет лишь несколько километров. Бертон и его коллеги отметили случаи так называемого гибридного разрушения, которое проявляется при скрещивании особей из разных популяций. Это очень любопытное явление. Гибриды первого поколения, то есть результат первого скрещивания между двумя популяциями, вполне жизнеспособны. Но если взять полученных гибридных самок и попытаться скрестить их с самцами исходной отцовской популяции, их потомки окажутся сильно ослаблены, в “плачевном” состоянии, по выражению Бертона. У потомков этого скрещивания наблюдался целый спектр изменений, и их средняя приспособленность была значительно ниже. Уровень синтеза АТФ у них сократился примерно на 40 %, и это привело к снижению выживаемости, плодовитости и сроков развития (в данном случае речь идет о сроках метаморфоза, которые зависят от размеров тела, а те, в свою очередь, от скорости роста).
Эта проблема объясняется несовместимостью митохондриальных и ядерных генов, что можно подтвердить, взяв полученных в эксперименте ослабленных самцов и скрестив их с самками из исходной материнской популяции. Потомки такого скрещивания обретают нормальную приспособленность. Но если поставить обратный эксперимент – скрестить ослабленных самок с самцами из исходной отцовской популяции, – потомство так и останется ослабленным, точнее, окажется еще слабее. Результаты этих экспериментов довольно легко понять. Митохондрии всегда наследуются от матери, и для их нормального функционирования необходимо, чтобы гены в ядре также были похожи на материнские. При скрещивании с самцами из генетически удаленной популяции материнские митохондрии начинают работать с ядерными генами, которые плохо с ними сочетаются. У гибридов первого поколения эта проблема не стоит столь остро, поскольку 50 % генов их ядра унаследованы от матери и нормально функционируют с материнскими митохондриями. У потомков от скрещивания гибридов первого поколения с самцами из исходной отцовской популяции, таким образом, 75 % ядерных генов оказывается несовместимыми с генами митохондрий, что проявляется в сильном снижении приспособленности. Скрещивание ослабленных самцов с самками из исходной материнской популяции дает потомков, у которых 62,5 % ядерных генов происходит из материнской популяции и совместимо с митохондриальными. Приспособленность потомков, таким образом, восстанавливается. Но обратное скрещивание дает противоположный эффект: 87,5 % ядерных генов у потомков оказываются неприспособленными к согласованной работе с митохондриями. Неудивительно, что такие особи на ладан дышат.
Что такое гибридное разрушение? Многие знакомы с явлением гетерозиса – увеличением приспособленности гибридов. Скрещивание неродственных линий выгодно: тогда организмы с меньшей вероятностью несут одинаковые мутации в одних и тех же генах. Наборы генов, полученные от отца и от матери, компенсируют друг друга, что повышает приспособленность. Но эффект гетерозиса встречается сравнительно редко. Гораздо чаще скрещивание между неродственными видами дает нежизнеспособное или бесплодное потомство. Это и есть гибридное разрушение. Репродуктивные барьеры между близкородственными видами далеко не такие жестки, как это преподносится в учебниках, и виды, которые в дикой природе обычно не проявляют интереса друг к другу, нередко успешно спариваются в неволе. Традиционное понимание видов как популяций, не способных при скрещивании давать способное к размножению потомство, в случае многих близкородственных организмов просто не работает. Тем не менее в процессе расхождения популяций возникают репродуктивные барьеры. Такие барьеры должны начать проявляться в скрещиваниях между популяциями особей одного вида, которые долгое время были репродуктивно изолированы друг от друга. В случае рачков, которых изучает Рон Бертон, гибридное разрушение целиком обусловлено несовместимостью митохондриальных и ядерных генов. Но, может быть, механизм гибридного разрушения распространен шире и сыграл роль в происхождении гораздо большего числа видов?
Я подозреваю, что дело обстоит именно так. Конечно, это лишь один из множества механизмов видообразования, но случаи “митонуклеарного” гибридного разрушения обнаружены у многих организмов: у мух, ос, у пшеницы, у дрожжей и даже у мышей. Этот механизм возникает из-за необходимости согласованной работы двух генов, что у эукариот неизбежно приводит к видообразованию. Впрочем, эти эффекты в разной степени выражены у разных организмов – по всей видимости, из-за разной скорости изменения митохондриальных генов. У веслоногих рачков скорость эволюции митохондриальных генов может быть в 50 раз выше, чем у генов ядра. А митохондриальные гены плодовой мушки (Drosophila) изменяются гораздо медленнее – примерно в два раза быстрее ядерных генов. Соответственно, эффект митонуклеарного разрушения гибридов у веслоногих рачков выражен гораздо сильнее, чем у плодовых мушек. Чем выше скорость изменения, тем больше появляется различий в нуклеотидной последовательности за заданный промежуток времени, и, следовательно, тем выше вероятность возникновения несовместимости митохондриальных и ядерных геномов при скрещивании особей из разных популяций.
Точные причины того, почему митохондриальные гены животных эволюционируют гораздо быстрее ядерных, неизвестны. Дуглас Уоллес, основоположник митохондриальной генетики, считает, что митохондрии – это авангард процесса адаптации. За счет быстрых изменений митохондриальных генов животные могут задолго до появления более медленных морфологических адаптаций приспосабливаться к изменению кормовой базы и климата. Эта идея мне нравится, хотя у нее пока слишком мало убедительных доказательств или опровержений. Но если Уоллес прав, то повышение приспособленности обусловлено непрерывным появлением новых вариантов митохондриального генома, на которые может воздействовать естественный отбор. Эти изменения не только служат начальным механизмом, облегчающим адаптацию к новым условиям, но и являются одними из предвестников видообразования. Это согласуется со старым, очень занятным биологическим правилом, которое сформулировал Дж. Б. С. Холдейн, один из отцов-основателей эволюционной биологии. Новая интерпретация этого правила предполагает, что митонуклеарная коадаптация может быть важна в процессах возникновения видов, а также играть большую роль для нашего здоровья.
Определение пола и правило Холдейна
Холдейн всегда питал слабость к ярким высказываниям. В 1922 году он выступил со следующим примечательным заявлением:
Если в потомстве животных, принадлежащих к двум разным видам, один пол отсутствует, встречается редко или стерилен, то этот пол гетерозиготен [гетерогаметен].
Проще сказать “…этот пол – мужской”, но тогда область применимости этого правила сузилась бы. У млекопитающих мужской пол гетерозиготен (гетерогаметен). Это означает, что у самцов две половые хромосомы: Х и Y. Самки млекопитающих имеют две X-хромосомы, а значит, гомозиготны (гомогаметны). У птиц и некоторых насекомых все наоборот: женские особи гетерогаметны и обладают двумя разными половыми хромосомами, W и Z, а у гомогаметных самцов две половые хромосомы Z. Представьте себе скрещивание самца и самки, принадлежащих к двум близкородственным видам: в результате рождается жизнеспособное потомство. Но если мы посмотрим на это потомство внимательней, выяснится, что оно включает либо только девочек, либо только мальчиков. Или, если присутствуют оба пола, один из них стерилен или неполноценен в чем-либо еще. Согласно правилу Холдейна, у млекопитающих таким ущербным полом будет мужской, а у птиц – женский. Список примеров, который пополняется с 1922 года, весьма впечатляет: правило подтверждается сотнями случаев для животных из множества таксонов. Исключений из этого правила для такой области, как биология, удивительно мало.
В разное время предлагалось много довольно правдоподобных объяснений правила Холдейна, однако ни одно из них не применимо ко всем случаям, а значит, не является полностью удовлетворительным. Например, такое: половой отбор сильнее среди самцов, которые должны бороться друг с другом за внимание самок (самцы гораздо сильнее различаются по степени репродуктивного успеха, чем самки, и мужские половые признаки лучше “видны” отбору). Это, в свою очередь, делает самцов уязвимее для “гибридного разрушения” при скрещивании между популяциями. Но эта гипотеза не объясняет, почему самцы птиц менее самок подвержены “гибридному разрушению”.
Другая трудность: сомнительно, что правило Холдейна затрагивает лишь половые хромосомы – ведь хромосомное определение пола есть далеко не у всех организмов. У многих рептилий и амфибий вообще нет половых хромосом, а пол определяется температурой: из яиц, инкубируемых в более теплых условиях, развиваются самцы, или (реже) наоборот. На самом деле механизмы определения пола поразительно разнообразны, и, учитывая их огромную важность для живых организмов, это приводит в недоумение. Пол может определяться паразитами, числом хромосом, гормонами, факторами внешней среды, стрессом, плотностью популяции и даже митохондриями. Известно, что межпопуляционное скрещивание хуже сказывается на одном из полов, даже если определение пола вовсе не хромосомное. Это наводит на мысль, что здесь действует некий более глубокий механизм. Более того, сам факт многообразия способов определения пола – при том, что количество полов (два) столь консервативно, – указывает, что, возможно, существует базовая, глубинная основа определения пола (процесса, запускающего развитие либо по женскому, либо по мужскому пути), а над ней за счет разных генов лишь появляются надстройки.
Одна из возможных основ – скорость метаболизма. Даже древние греки понимали, что мужчины в буквальном смысле горячее женщин. У млекопитающих, например человека и мыши, наиболее рано проявляющееся различие между полами – это скорость роста: эмбрионы мужского пола растут чуть быстрее. Разница может быть зафиксирована в течение нескольких часов после зачатия при помощи линейки (не пытайтесь повторить это в домашних условиях). Ген SRY, расположенный на Y-хромосоме и определяющий у людей развитие по мужскому пути, ускоряет рост за счет активации множества ростовых факторов. У ростовых факторов нет половой специфичности: в норме они активны и у самцов, и у самок, однако у самцов устанавливается более высокий уровень их активности. Мутации, повышающие активность этих факторов и тем самым увеличивающие скорость роста, могут индуцировать смену пола, направляя развитие женских эмбрионов без Y-хромосомы (или гена SRY) по мужскому пути. И наоборот: мутации, снижающие активность этих факторов, могут иметь противоположный эффект, превращая самцов с прекрасно функционирующей Y-хромосомой в самок. Все это свидетельствует о том, что скорость роста – реальная сила, стоящая за половым развитием, по крайней мере у млекопитающих. Гены лишь “держат поводья” и в процессе эволюции могут легко замещать друг друга: один ген, определяющий скорость роста, сменяется другим геном, который делает то же самое.
У амфибий и рептилий выбор пола определяется температурой, и это удивительно сочетается с тем обстоятельством, что скорость роста выше у самцов. В пределах допустимых значений повышение температуры тела рептилии на 10 °C (скажем, после того, как она согрелась на солнце) примерно вдвое увеличивает скорость метаболизма, что, в свою очередь, позволяет поддерживать более высокую скорость роста. При повышенной температуре не всегда (по многочисленным причинам) развиваются самцы, но связь между половой принадлежностью и скоростью роста (через гены ли, через температуру она реализуется) гораздо глубже, чем любой механизм. Очень похоже, что время от времени новые гены приспосабливались к этой задаче и “перехватывали поводья”, определяя, при какой скорости развитие пойдет по женскому пути, а при какой – по мужскому. Между прочим, это одна из причин, почему мужчинам не стоит бояться того, что Y-хромосоме придет конец: ее функцию, вероятнее всего, возьмут на себя какие-нибудь другие факторы – может, ген, а может, другая хромосома. Они и будут устанавливать более высокую скорость метаболизма, необходимую для развития по мужскому пути. Этим также может объясняться странное наружное положение яичек у млекопитающих: потребность в нужной температуре гораздо глубже укоренена в нашей биологии, чем обладание мошонкой.
Эти идеи, должен признаться, явились для меня откровением. Гипотезу о том, что пол определяется главным образом скоростью метаболизма, несколько десятилетий разрабатывала Урсула Миттвоч, моя коллега из Университетского колледжа (Лондон). В свои девяносто лет она замечательно активна и публикует очень важные статьи. Они не так широко известны, как следовало бы – возможно, из-за того, что в век молекулярной биологии и секвенирования геномов измерение таких “незамысловатых” параметров, как скорость роста, размер эмбриона, содержание ДНК и белка в гонадах выглядит старомодно. Теперь, на пороге новой эры – эры эпигенетики (какие факторы контролируют экспрессию генов), ее работы стали больше соответствовать современным веяниям в науке, и я надеюсь, что они займут заслуженное место в истории биологии[94].
Какое отношение все это имеет к правилу Холдейна? Стерильность и нежизнеспособность сопутствуют нарушению нормальных функций. За пределами нормы орган или организм погибает. Лимит работоспособности определяется двумя факторами: энергетической “стоимостью” выполнения задачи (например производства спермы) и доступными энергетическими ресурсами. Если их меньше, чем требуется, орган (организм) умирает. Эти критерии могут показаться слишком грубыми для мира генетических сетей, но они так или иначе играют очень важную роль. Надев на голову пластиковый пакет, вы резко снизите количество доступной энергии в сравнении с вашими потребностями. Спустя чуть более минуты организм прекратит функционировать (по меньшей мере перестанет работать мозг). Энергетические нужды вашего мозга и сердца высоки, поэтому эти органы умрут первыми. Клетки кожи и кишечника могут прожить дольше, так как их метаболические потребности гораздо ниже. Остатков кислорода хватит, чтобы они прожили еще несколько часов, а то и дней. Для совокупности клеток, из которых мы состоим, смерть – это не мгновенное превращение в ничто, а растянутый во времени процесс. Мы представляем собой констелляцию клеток, а они не умирают одновременно. Клетки с наиболее высокими потребностями раньше остальных сталкиваются с невозможностью их удовлетворить.
Именно эта проблема возникает при митохондриальных заболеваниях. Большая их часть вызывает нейромышечную дегенерацию и нарушает работу мозга и скелетной мускулатуры, ткани которых имеют наиболее высокую скорость метаболизма. Особенно уязвимо зрение: скорость метаболизма клеток сетчатки и зрительного нерва – самая высокая в организме. Митохондриальные болезни (например наследственная оптическая нейропатия Лебера) поражают зрительный нерв, вызывая слепоту. Довольно трудно выводить общие закономерности для митохондриальных заболеваний, потому что их тяжесть зависит от множества факторов: типа мутации, числа мутантов, тканевой локализации. Но если оставить это в стороне, факт остается фактом: митохондриальные заболевания в первую очередь поражают ткани с самыми высокими энергетическими потребностями.
Представьте себе две клетки с одинаковым количеством однотипных митохондрий. За счет этого их возможности по производству АТФ примерно совпадают. Если их метаболические потребности различаются, то прогноз на будущее для этих клеток будет разным (рис. 33). Предположим, что у первой клетки низкие метаболические потребности: она спокойно может их удовлетворять, поскольку производит АТФ более чем в достаточном объеме и может тратить его на все, что нужно. А теперь представьте, что у второй клетки потребности гораздо выше: они превосходят даже ее максимально возможную продукцию АТФ. Клетка пытается свести концы с концами, собрав все свои физиологические силы. Электроны рекой льются в дыхательные цепи, но это мало помогает: они поступают на цепь быстрее, чем успевают ее покинуть. Окислительно-восстановительные центры перевосстановливаются и начинают реагировать с кислородом с образованием свободных радикалов. Те, в свою очередь, окисляют близлежащие мембранные липиды, в результате чего высвобождается цитохром c. Потенциал на мембране падает, и клетка умирает в результате апоптоза. Так работает отбор на тканевом уровне: клетки, которые не могут удовлетворить свои метаболические потребности, элиминируются, а те, которые способны себя обеспечить, остаются жить.
Устранение клеток, работающих недостаточно хорошо, улучшает общее состояние ткани лишь в том случае, если им на смену приходят новые клетки, которые развиваются из стволовых. Главная проблема нейронов и мышечных клеток заключается в том, что они не могут быть замещены. Как можно заменить нейрон? В нейронных сетях хранится наш опыт, а каждый нейрон – узел сети – образует около 10 тыс. синапсов. Если нейрон погибает путем апоптоза, его синаптические связи навсегда теряются вместе со всеми воспоминаниями, знаниями и свойствами личности, которые могли быть в них зашифрованы. Этот нейрон невозможно заменить – он “невозобновим”. На самом деле клетки любых тканей, прошедшие окончательную дифференцировку, невозобновимы: само их существование невозможно без глубокого разделения между зародышевой линией и остальными соматическими клетками (об этом разделении шла речь в предыдущей главе). Основа отбора, его субстрат, – это потомство. Если организмы с крупным невозобновляемым мозгом будут оставлять больше жизнеспособного потомства, чем организмы с маленьким возобновляемым мозгом, то в определенный момент первые восторжествуют над вторыми. Таким образом, отбор может действовать лишь в том случае, если присутствует разделение клеток на зародышевые и соматические. Но при этом тело становится “одноразовым”, срок жизни – небесконечным, а собственные клетки, у которых не получается удовлетворить метаболические потребности, в конце концов нас убивают.
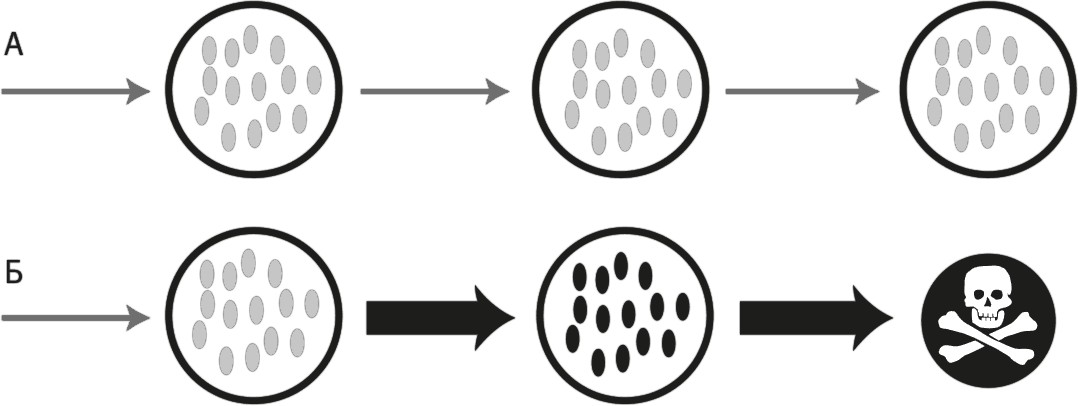
Рис. 33. Судьба клетки зависит от ее умения удовлетворять свои потребности.
Изображены две клетки, митохондрии которых способны вырабатывать одинаковое суммарное количество энергии. При этом у клеток разные потребности. У клетки А потребности умеренные (на это указывает толщина стрелок). Митохондрии могут их удовлетворять, не перевосстанавливаясь (митохондрии в нормальном состоянии обозначены серыми овалами). У клетки Б уровень потребностей изначально нормален, но впоследствии значительно повышается. Соразмерно увеличивается количество электронов, поступающих в митохондрии, но их энергии недостаточно, и дыхательные комплексы перевосстанавливаются, то есть приобретают избыточный заряд. Если возможности клетки в ближайшее время не расширятся, итогом станет клеточная смерть (рис. 32).
Вот почему важна скорость метаболизма. Клеткам с более высокой скоростью метаболизма угрожает опасность не справиться со своими потребностями, если их митохондрии будут производить столько же энергии, как и митохондрии других клеток. Не только митохондриальные заболевания, но и обыкновенное старение и связанные с ним болезни будут поражать в первую очередь ткани с самыми высокими метаболическими потребностями. И, чтобы завершить круг, вспомним, как различается скорость метаболизма у двух полов. У самцов (по крайней мере, у млекопитающих) скорость метаболизма выше, чем у самок. Генетические дефекты митохондрий будут проявляться сильнее у пола, для которого характерна более высокая скорость метаболизма: у мужского. Некоторые митохондриальные заболевания и в самом деле шире распространены среди мужчин. Так, наследственная оптическая нейропатия Лебера встречается у них в пять раз чаще, чем у женщин, а болезнь Паркинсона, также имеющая заметную митохондриальную составляющую, – в два раза чаще. Вдобавок самцы более чувствительны к митохондриально-ядерным рассогласованиям. Если такие рассогласования появляются при скрещивании между репродуктивно изолированными популяциями, это ведет к гибридному разрушению. Получается, гибридному разрушению сильнее подвержен пол с наиболее высокой скоростью метаболизма, а у особей этого пола, в свою очередь, наибольшей опасности подвергаются ткани с повышенной скоростью метаболизма. И все это закономерные последствия того, что для сложной жизни необходимо два генома.
Эти соображения позволяют дать красивое и простое объяснение правилу Холдейна: особи того пола, для которого характерна более высокая скорость метаболизма, чаще оказываются стерильными или нежизнеспособными. Но так ли это? И важно ли? Что ж, объяснение может быть верным и при этом простым (даже банальным), к тому же ничто из сказанного не противоречит другим возможным причинам, в силу которых может выполняться правило Холдейна. Никто не говорит, что скорость метаболизма должна выступать единственной причиной, но действительно ли она важна? Я думаю, да. Например, известно, что температура приближает гибридное разрушение. Потомство от скрещивания двух близкородственных видов жуков-чернотелок Tribolium castaneum и Tribolium freeman остается здоровым при обычной для них температуре 29 °C, но при повышении температуры до 34 °C самки (в данном случае именно они) развиваются с уродствами конечностей и антенн. Такая разновидность температурной чувствительности широко распространена и, как правило, вызывает бесплодие у представителей лишь одного из полов. Этот механизм проще понять, приняв во внимание скорость метаболизма: перейдя границы допустимых потребностей, определенные ткани начинают разрушаться.
В числе таких тканей часто оказываются ткани половых органов, в особенности мужских, где на протяжении всей жизни идет производство спермы. Весьма впечатляющий пример из растительного мира – цитоплазматическая мужская стерильность. Большинство цветущих растений – гермафродиты, но при этом среди них высока доля особей, у которых развивается мужская стерильность. Получаются как бы два “пола”: гермафродиты и женские растения (на самом деле гермафродиты с мужской стерильностью). Данное явление вызывается митохондриями, и этот случай традиционно рассматривался как проявление эгоистического конфликта[95]. Однако молекулярные исследования показали, что мужская стерильность может просто отражать скорость метаболизма. Оксфордский ботаник Крис Ливер показал, что цитоплазматическую мужскую стерильность у подсолнечника вызывает ген, кодирующий одну из субъединиц митохондриальной АТФ-синтазы. Проблема в ошибке рекомбинации, которая затрагивает относительно небольшую долю АТФ-синтаз. Из-за этого снижается максимально возможная скорость синтеза АТФ. В большей доле тканей эта мутация никак себя не проявляет, деградируют лишь мужские половые органы – пыльники (не поддающиеся замене клетки умирают в результате апоптоза, который запускается высвобождением цитохрома c из митохондрий, как и у нас). Похоже, пыльники у подсолнечника – единственный орган, ткани которого имеют настолько высокие метаболические потребности, что начинается разрушение: лишь там мутантные митохондрии оказываются неспособны удовлетворить метаболические запросы клеток ткани. Результат – мужская стерильность.
То же самое обнаружено у плодовой мушки. Пересаживая ядро из одной клетки в другую, можно сконструировать цитоплазматические гибриды (цибриды) с идентичными геномами, но разными наборами митохондриальных генов[96]. Из яйцеклеток, подвергнутых такой операции, развиваются зародыши мух с одинаковыми ядерными геномами, но с митохондриальными генами разных родственных видов. В итоге из-за различий в митохондриальных геномах насекомые оказываются поразительно не похожими друг на друга. В самых удачных случаях новорожденные мухи абсолютно нормальны. При наихудших сочетаниях двух геномов самцы рождаются стерильными: мужской пол у дрозофилы гетерогаметен[97]. Наиболее интересны промежуточные ситуации, когда мухи, на первый взгляд, нормальны. Но если изучить активность генов в различных органах, выясняется, что она нарушена, например в тканях тестикул. Экспрессия более 1 тыс. генов в тестикулах и сопутствующих половых органах оказывается повышенной. Пока неясно, что именно при этом происходит, но самое простое объяснение, на мой взгляд, таково: эти органы не могут справиться с обеспечением энергией собственных функций. Митохондрии в клетках этих органов не в полной мере совместимы с ядерными генами. Клетки тестикул, с их высокими метаболическими потребностями, испытывают физиологический стресс, а он провоцирует ответ, в который вовлекается значительная часть генома. Как и в случае цитоплазматической мужской стерильности у растений, несовместимость геномов сказывается лишь на органах с наиболее высокой метаболической активностью – на половых, причем исключительно мужских[98].
Если так, то почему у птиц самки сильнее подвержены подобным нарушениям? Примерно по тем же причинам, но здесь есть некие интересные отличия. У некоторых птиц, в особенности хищных, самки крупнее самцов и, возможно, поэтому растут быстрее. Но это не является общим правилом. Урсула Миттвоч показала, что яичники у цыплят спустя несколько недель замедленного роста начинают опережать в развитии семенники. Можно предположить, что в подобных случаях женские особи будут страдать скорее от бесплодия, чем от нежизнеспособности – ведь у них быстрее растут лишь половые органы. Но это не так. В большинстве случаев, когда выполняется правило Холдейна, гибриды оказываются как раз нежизнеспособными, а не стерильными. Это сбивало меня с толку, пока в прошлом году Джефф Хилл, специалист по половому отбору у птиц, не прислал мне статью о том, как работает правило Холдейна на птицах. Хилл показал, что у птиц некоторые ядерные гены, кодирующие дыхательные белки, расположены на Z-хромосоме (вспомните, что самцы имеют две Z-хромосомы, тогда как у самок присутствует и Z-хромосома, и W-хромосома одновременно; а это означает, что женский пол гетерогаметен). Почему это имеет значение? Если самки птиц наследуют одну копию Z-хромосомы, они получают лишь по одной копии нескольких критически важных ядерных генов, кодирующих дыхательные белки, – от отца. Если мать была не слишком придирчива при выборе супруга, ее митохондриальные гены могут оказаться несовместимы с его ядерными генами (которые у птенца будут в единственном экземпляре). Вырождение последует незамедлительно.
Хилл утверждает, что такое положение вещей обязывает самок птиц подходить к выбору партнера как можно тщательней, иначе их дочери погибнут. Этим, в свою очередь, могут объясняться огромные хвосты и яркая окраска самцов. Если Хилл прав, то сложный узор на хвосте сообщает о качестве митохондрий: грубые нарушения узора сигнализируют о грубых отклонениях в митохондриальной ДНК. Самки рассматривают узор как тест на совместимость. Но самец, который хорошо выглядит, на самом деле может быть очень плохим экземпляром. Хилл считает, что игра цвета отражает работу митохондрий, так как в митохондриях синтезируется большая часть пигментов. Ярко окрашенные самцы должны обладать митохондриальными генами превосходного качества. Пока эту гипотезу мало что подтверждает, но зато она показывает, сколь широко может распространяться влияние митонуклеарной коадаптации. Очень поучительно, что наличием двух геномов у сложных организмов могут объясняться такие разные загадки эволюции, как происхождение видов, возникновение полов и яркая окраска у самцов птиц.
Влияние может распространяться и глубже. За митонуклеарную несовместимость приходится платить, но и правильное сочетание имеет свою цену, делая совместимость необходимой. Баланс затрат и прибыли у разных видов может различаться в зависимости от потребности в кислороде. Как мы увидим, приходится выбирать между приспособленностью и плодовитостью.
На пороге смерти
Представьте, что вы умеете летать. На грамм массы вашего тела приходится в два раза больше энергии, чем у бегущего гепарда. Вы являете собой великолепное сочетание силы, легкости и высокой аэробной производительности. Однако вам стоит оставить мечты о полете, если только ваши митохондрии не близки к совершенству. Поговорим о конкуренции за пространство, которая разворачивается в предназначенной для полета мускулатуре. Разумеется, вам требуются миофибриллы – “скользящие нити”, которые осуществляют мышечное сокращение. Чем больше таких структур вы сможете вместить, тем сильнее будете: сила мышцы, как и прочность веревки, зависит от площади поперечного сечения. Но, в отличие от веревки, для сокращения мышцы требуется АТФ. Чтобы долгое время сохранять мышечное напряжение, необходимо на месте синтезировать АТФ. Значит, митохондрии должны помещаться непосредственно в мышцах. Они занимают место, которое также можно заполнить миофибриллами. Еще митохондриям нужен кислород. Следовательно, необходимы капилляры, чтобы доставлять кислород и удалять отходы. Оптимальная организация пространства в аэробной мышце такова: треть приходится на миофибриллы, треть – на митохондрии, еще треть – на капилляры. Такое соотношение наблюдается у нас, а также у гепардов и колибри (у них самая высокая скорость обмена веществ среди позвоночных). Итак, теперь понятно, что нельзя увеличить силу, просто набрав побольше митохондрий.
Следовательно, единственный способ, при помощи которого птицы смогут получать достаточно энергии, чтобы долго оставаться в полете, – это обзавестись “супермитохондриями”, которые вырабатывали бы больше АТФ за секунду, чем обычные митохондрии. Поток электронов от питательных веществ на кислород должен быть быстрым. Отбор должен действовать на каждом шаге, увеличивая максимальную скорость работы каждого дыхательного белка. Эти скорости можно измерить, и мы знаем, что ферменты в митохондриях птиц действительно работают быстрее, чем у млекопитающих. Но, как мы видели, дыхательный белок – это мозаика, составленная из субъединиц, закодированных в разных геномах. Быстрый поток электронов означает жесткий отбор на качественную совместную работу двух геномов – митонуклеарную коадаптацию. Чем выше уровень потребления кислорода, тем сильнее должен быть отбор на коадаптацию. Клетки, два генома которых работают недостаточно слаженно и эффективно, элиминируются, вступая в апоптоз. Самое подходящее время для такого отбора – эмбриональное развитие. Если геномы у эмбриона работают недостаточно слаженно для поддержания полета, лучше оборвать развитие как можно раньше.
Но насколько должно быть несовместимым несовместимое? Вероятно, должен быть некий порог, точка, в которой запускается апоптоз. За этим порогом скорость потока электронов по мозаичной дыхательной цепи недостаточно высока: она не подходит для работы. Отдельные клетки, а затем и весь эмбрион, погибают из-за апоптоза. Напротив, ниже порога скорость электронов достаточно высока, и, следовательно, два генома слаженно работают. В этом случае клетки не убивают себя, и эмбрион остается жить. Развитие продолжается, и вскоре на свет появляется, например, здоровый птенец. Его митохондрии прошли предварительную проверку и “сертифицированы” для своей работы[99]. Важно то, что эта работа может быть разной. Если это обеспечение полета, то геномы должны работать с великолепной слаженностью. Цена высокой аэробной производительности – низкая плодовитость. Чтобы большее число эмбрионов получило возможность выжить, приходится жертвовать другими, менее важными целями: приносить их на алтарь совершенства. Мы можем найти последствия этого даже в митохондриальных генах. У птиц они изменяются медленнее, чем у большинства млекопитающих (кроме летучих мышей, которые сталкиваются с теми же проблемами, что и птицы). У нелетающих птиц, на которых эти ограничения не действуют, замены происходят с более высокой скоростью. У большинства птиц низкие темпы мутационной изменчивости из-за того, что их митохондриальные последовательности уже наилучшим образом приспособлены для полета. Отклонения от этого идеала плохо сказываются на птицах и поэтому обычно отсеиваются отбором. Если большинство изменений элиминируется, оставшаяся часть относительно постоянна.
Но предположим, что я крыса и полеты меня не интересуют. Глупо жертвовать большей частью моего многочисленного будущего потомства ради совершенства. Мы уже знаем, что сигналом, запускающим апоптоз (форму функционального отбора), служит образование свободных радикалов. Медленный, ленивый поток электронов по дыхательной цепи выдает плохую совместимость митохондриального и ядерного геномов. Перевосстановление компонентов дыхательных цепей приводит к образованию свободных радикалов. Цитохром c выходит из митохондрий, и потенциал на мембране падает. Будь я птицей, сочетание этих факторов послужило бы сигналом для запуска апоптоза. Мои дети умирали бы еще на эмбриональной стадии. Но я крыса, и мне это не нужно. Что, если при помощи какого-либо биохимического фокуса я смогу “проигнорировать” свободнорадикальный сигнал, который должен вызвать смерть моего потомства? Я подниму порог смерти. Это будет означать, что образование свободных радикалов сможет достигать больших масштабов прежде, чем вызвать апоптоз. Так я получу преимущество: большая часть моего потомства переживет эмбриональный период, и я стану гораздо плодовитее. Но какую цену мне придется заплатить за феерическую продуктивность?
Летать я определенно не смогу. Более того, моя аэробная производительность окажется ограниченной. У моего потомства будет очень мало шансов заполучить оптимальную комбинацию митохондриальных и ядерных генов. Вот мы и подошли к следующей точке баланса затрат и прибылей: приспособленности против болезней. Вспомните гипотезу Дугласа Уоллеса о том, что быстрая эволюция митохондриальных генов у животных способствует их адаптации к разному климату и питанию. Мы не знаем, как именно это работает (если работает), но удивительно, если бы в этой гипотезе не оказалось зерна истины. Самые значимые факторы, к которым стоит приспособиться (иначе мы недолго протянем), – это рацион и температура тела. Митохондрии очень важны и в том, и в другом случае. Работа митохондрий в высокой степени зависит от митохондриальной ДНК. Различные последовательности ДНК обеспечивают разное качество работы в разных условиях. Одни будут лучше работать при более низкой температуре, другие – при более высокой. Одни лучше подойдут для повышенной влажности, другие – для сжигания калорий при диете с повышенным содержанием жиров. И так далее.
Есть намеки на то, что отбор в определенных условиях действительно идет: например, в человеческих популяциях довольно четко наблюдается распределение по типам митохондриальной ДНК в соответствии с географическими областями. Это не более чем намеки. И все же нет сомнений в том, что у птиц разнообразие митохондриальной ДНК гораздо ниже. Уже тот факт, что большинство отклонений от оптимальной для полета нуклеотидной последовательности элиминируется в ходе отбора, означает, что чем ниже изменчивость оставшейся ДНК, тем менее широк простор для отбора. Становится сложнее подобрать вариант митохондриальной ДНК, который хорошо подходил бы, например, для холода или же для богатой жирами диеты. В этом отношении особенно интересен тот факт, что птицы часто мигрируют вместо того, чтобы страдать от сезонных изменений в условиях среды обитания. Возможно ли, что их митохондрии лучше приспособлены для того, чтобы обеспечивать длительную нагрузку в процессе миграции, чем к работе в более жестких условиях, с которыми они могут столкнуться, если птицы останутся в одной местности? У крыс, напротив, нет проблем с вариативностью, и, казалось бы, за счет этого они должны иметь обширный материал для адаптаций. Действительно ли это так? Откровенно говоря, я не знаю, но эти звери отлично умеют приспосабливаться. Черт бы взял всех этих крыс, от которых не спастись.
Но, конечно, широкое разнообразие митохондриальных генов имеет свою цену. Это болезни. В сущности, этого можно избежать, осуществляя отбор клеток зародышевой линии и избавляясь от тех, которые несут митохондриальные мутации, еще до их созревания. Есть некоторые свидетельства того, что такой отбор имеет место: у мышей и крыс тяжелые митохондриальные мутации обычно ликвидируются за несколько поколений, хотя менее вредные мутации и переходят к потомству почти беспрепятственно. Только задумайтесь: несколько поколений! Отбор здесь очень слабый. Если вам выпало родиться с серьезным митохондриальным заболеванием, вы не сможете утешиться надеждой, что ваши внуки (если повезет их иметь) будут здоровыми. Даже если отбор вправду действует на клетки зародышевой линии, отсеивая митохондриальных мутантов, это не дает никаких гарантий отсутствия митохондриальных заболеваний. Ядра незрелых яйцеклеток могут быть ничуть не похожи на то, что получится. Они много лет находятся в подвешенном состоянии, застыв на полпути к завершению мейоза – а в какой-то момент им приходится объединять свои потрепанные, видавшие виды гены с генами партнера. Отбор на митонуклеарную коадаптацию может происходить лишь после того, как зрелая яйцеклетка оплодотворена сперматозоидом и образовалось новое, генетически уникальное ядро. Сами по себе митохондриальные мутации не влекут гибридное разрушение: его вызывают несоответствия между ядерными и митохондриальным генами (причем и те, и другие в других обстоятельствах могут прекрасно работать). Мы видели, что сильный отбор, отсеивающий клетки с митонуклеарной несовместимостью, неизбежно увеличивает вероятность бесплодия. Если мы не хотим оказаться бесплодными, то должны заплатить другую цену – у нас будет повышенный риск возникновения болезней. Столкновение с этим выбором – плодовитость и заболевания или бесплодие и здоровье в остальном – также является закономерным следствием необходимости обладать двумя геномами.
Это гипотетический порог смерти (рис. 34). Оказавшись за ним, клетка (а вместе с ней, возможно, и весь организм) погибает в результате апоптоза. Ниже порога клетка и организм выживают. Высота этого порога у разных видов различна. Для летучих мышей, птиц и других созданий с высоким уровнем потребления кислорода порог должен быть низким: даже небольшой уровень свободных радикалов в ущербных митохондриях (вместе с небольшими несоответствиями митохондриального и ядерного геномов) будет запускать апоптоз и гибель эмбриона. Для крыс, ленивцев и всех существ с низкой потребностью в кислороде порог выше. Для них образование свободных радикалов в небольших количествах допустимо, митохондрии с некоторыми нарушениями функций считаются сносными, эмбрион продолжает развиваться. Оба варианта несут и выгоды, и неудобства. Низкий порог дает высокую аэробную эффективность и низкую вероятность развития заболеваний, но за это приходится платить повышенной вероятностью бесплодия и худшей приспосабливаемостью. С высоким порогом связаны низкая аэробная производительность и повышенная подверженность заболеваниям, но при этом доступны высокая плодовитость и хорошая приспосабливаемость. Вот волшебные слова, их можно повторять, как мантру. Плодовитость. Приспособляемость. Аэробная эффективность. Болезни. Мы подошли к сути естественного отбора – ближе некуда. Повторюсь: необходимость идти на компромиссы неизбежно вытекает из потребности иметь два генома.
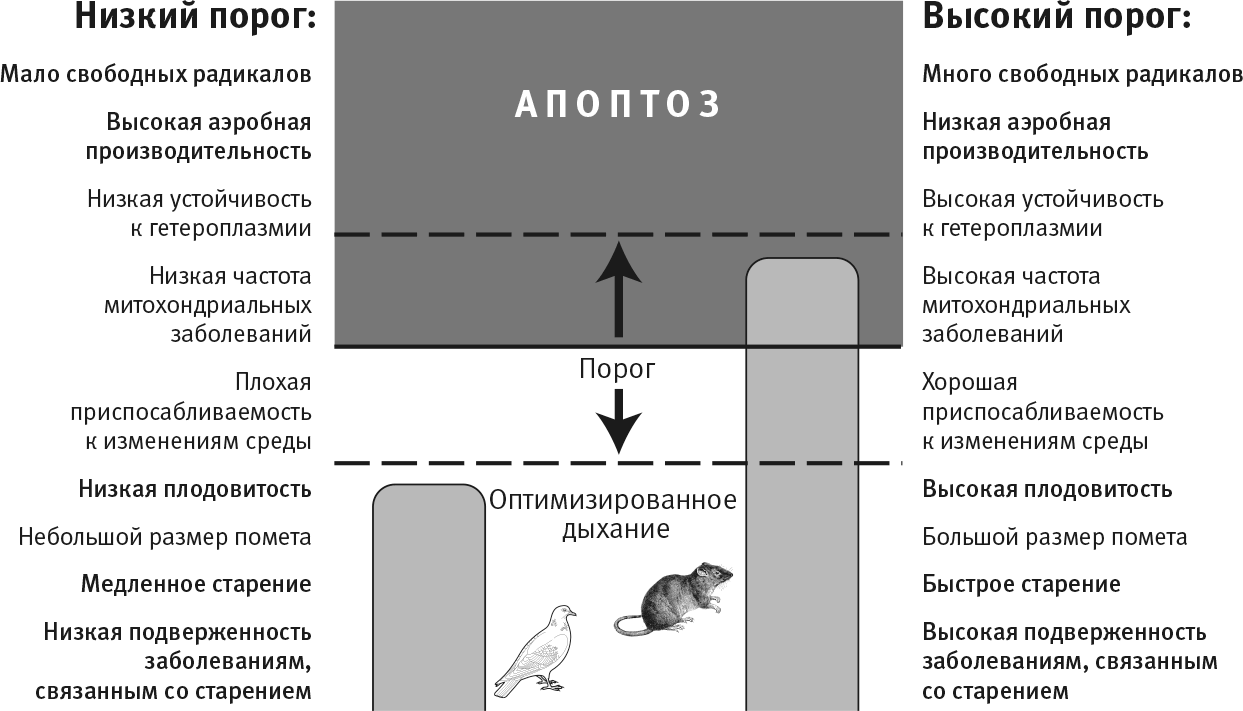
Рис. 34. Порог смерти.
Порог, при достижении которого утечка свободных радикалов влечет клеточную смерть (апоптоз), должен различаться у разных видов в зависимости от аэробной эффективности. Организмы с высокой потребностью в кислороде должны иметь очень хорошо сочетающиеся митохондриальный и ядерный геномы. Низкое соответствие выражается в высокой скорости утечки свободных радикалов из дисфункциональной дыхательной цепи (рис. 32). Если требуется очень хорошая совместимость, то клетки должны быть чувствительнее к утечке свободных радикалов. Даже слабые сигналы утечки, указывающие на недостаточную сочетаемость, включают механизм клеточной смерти (низкий порог). Напротив, если потребность в кислороде невысока, то нет смысла убивать клетки. Такие организмы будут выдерживать более высокие уровни утечки свободных радикалов без запуска апоптоза (высокий порог). Прогнозы для низкого и высокого порогов смерти – по сторонам картинки. У голубей предположительно низкий порог, а у крыс – наоборот. Эти два вида имеют одинаковые размеры тела и базальную скорость метаболизма, но у голубей скорость утечки свободных радикалов гораздо ниже. Неизвестно, насколько эти предположения отражают реальность, но тот факт, что крысы живут три-четыре года, а голуби – до 30 лет, впечатляет.
Я выбрал название – “гипотетический порог смерти”. Но действительно ли он существует? Если да, вправду ли он настолько важен? Подумайте о нас, людях. В 40 % случаев беременность прерывается на ранних стадиях в результате скрытого выкидыша. “Ранние” в данном случае означает по-настоящему ранние – в первые несколько недель, до появления признаков беременности. Женщина не может быть уверена, что не была беременной. Скрытый – значит прошедший незамеченным, не подтвержденный клинически. Мы не знаем, почему это происходит. Ни один из обычно предполагаемых факторов не служит причиной таких выкидышей – например нарушение расхождения хромосом, в результате которого получается “трисомия” или нечто подобное. А может, у проблемы биоэнергетическая природа? Трудно сказать, как все обстоит на самом деле, но в дивном новом мире, где можно в короткий срок секвенировать целые геномы, есть надежда это выяснить. Случалось, что эмоциональные расстройства, сопутствующие бесплодию, толкали людей на довольно нездоровые эксперименты с факторами, способствующими эмбриональному росту. При помощи грубого приема – инъекции АТФ в ткани – можно продлить существование ослабленного зародыша. Получается, биоэнергетические факторы явно играют какую-то роль. С другой стороны, быть может, такие неудачи – к лучшему. Возможно, у этих эмбрионов были митонуклеарные несоответствия, которые послужили сигналом для запуска апоптоза. Лучше не рассматривать эволюцию в контексте морали и воздержаться от любых обвинений в ее адрес. Могу лишь сказать, что я не забуду годы собственных страданий от одной на двоих беды (к счастью, они закончились). И я, как и многие другие люди, хотел бы знать – почему. Я думаю, столь часто случающийся скрытый выкидыш на ранних стадиях действительно связан с митонуклеарной несовместимостью.
Но есть еще одна причина считать, что порог смерти существует и имеет большое значение: косвенная плата за высокий порог смерти – ускоренное старение и предрасположенность к сопутствующим болезням. Это утверждение может вызвать недоумение. Высокий порог смерти означает высокую толерантность к образованию свободных радикалов при запуске апоптоза. Это означает, что у видов с пониженной аэробной производительностью, например у крыс, должно образовываться больше свободных радикалов. И, напротив, у видов с высокой аэробной производительностью – например у голубей – должно появляться меньше свободных радикалов. Я тщательно выбирал эти виды. Масса тела у них почти одинакова, как и базальная (то есть в спокойном состоянии) скорость метаболизма. На одном этом основании большинство биологов скажет, что срок жизни у них должен быть одинаковым. Но, по данным Густаво Барха из Мадридского университета, у голубей в митохондриях образуется гораздо меньше свободных радикалов, чем у крыс[100]. Свободнорадикальная теория старения гласит, что старение вызывает образование свободных радикалов: чем выше скорость их образования, тем быстрее мы стареем. Теория подвергалась серьезной критике в последние десять лет, однако в данном случае она позволяет дать четкое предсказание: голуби должны жить дольше крыс. И это действительно так. Голубь – не просто летающая крыса. Так что же, свободнорадикальная теория старения верна? В первоначальной формулировке – нет. Но, я думаю, она верна в другой форме.
Свободнорадикальная теория старения
Свободнорадикальная теория старения выросла в 50-х годах из радиационной биологии. Ионизирующее излучение расщепляет молекулы воды с образованием реакционноспособных “осколков” с одним неспаренным электроном: свободных радикалов кислорода. Некоторые из них, например, печально известный гидроксильный радикал (OH•), чрезвычайно опасны, а другие, как супероксидный анион-радикал (O2•–), ведут себя сравнительно спокойно. Ребекка Гершман, Дэнхам Харман и другие основоположники свободнорадикальной теории старения поняли, что те же самые свободные радикалы могут образовываться внутри митохондрий непосредственно из кислорода, без всякой радиации. Они считали, что разрушительные по своей природе свободные радикалы способны повреждать белки и вызывать мутации ДНК. Все это правда: свободные радикалы и не такое могут. Они способны запускать длинные цепные реакции, в которых молекулы (как правило, мембранные липиды), перехватывая друг у друга электрон, сеют хаос в хрупких клеточных структурах. Для клетки это заканчивается, гласит теория, разгромом.
В митохондрии образуются свободные радикалы, которые реагируют со всеми оказавшимися рядом молекулами, в том числе с близко расположенной митохондриальной ДНК. Из-за этого в митохондриальной ДНК накапливаются мутации, и некоторые приводят к синтезу поврежденных дыхательных белков, которые образуют еще больше свободных радикалов. Эти радикалы еще сильнее повреждают белки и ДНК, и вскоре разрушительный процесс доходит до ядра, вызывая “катастрофу ошибок”. Если вы посмотрите на демографические графики заболеваемости и смертности, то увидите, что эти показатели экспоненциально растут на промежутке 60–100 лет. Идея катастрофы ошибок (самоподдерживающегося процесса разрушения) как будто соответствует этим графикам. И та идея, что причина процесса старения – именно кислород, без которого наша жизнь невозможна, наполняет каждый вдох смыслом.
Но если свободные радикалы вредны, антиоксиданты должны быть полезны. Антиоксиданты нейтрализуют токсический эффект свободных радикалов, обрывая цепные реакции и так предотвращая распространение повреждений. Если свободные радикалы вызывают старение, то антиоксиданты должны его замедлять, оттягивать наступление болезней и, может быть, даже продлевать жизнь. Некоторые знаменитые ученые поверили в этот миф. Например, Лайнус Полинг, который ежедневно принимал несколько ложек витамина C, умер в возрасте 92 лет, но все же не вышел за пределы продолжительности жизни обычных людей, в том числе тех, которые пили и курили. Очевидно, процесс старения далеко не так прост.
Такое упрощенное представление о свободных радикалах и антиоксидантах до сих пор тиражируется в глянцевых журналах и рекламе здорового питания, хотя большинство исследователей давно от него отказалось. Барри Холлиуэлл и Джон Гаттеридж, авторы классического учебника “Свободные радикалы в биологии и медицине”, отметили, что “к 90-м годам XX века всем стало ясно, что антиоксиданты – не панацея от старения и болезней, и лишь нетрадиционная медицина еще пытается навязать это представление”.
Свободнорадикальная теория старения – одна из тех красивых идей, которые разбиваются, столкнувшись с уродливыми фактами. Да-да, уродливыми фактами. Ни одно из положений этой теории в исходной формулировке не получило экспериментального подтверждения. Не обнаружено достоверного увеличения образования свободных радикалов в митохондриях по мере старения. Обнаружено незначительное увеличение числа митохондриальных мутаций, но их, за исключением клеток на ограниченных участках ткани, на удивление мало – гораздо меньше, чем требуется для развития митохондриальных заболеваний. В некоторых тканях действительно накапливаются повреждения, но ничего похожего на “катастрофу ошибок” не наблюдается, и наличие причинно-следственных связей здесь сомнительно. Антиоксиданты не продлевают жизнь и не защищают от болезней. Все наоборот. Идея, будто антиоксиданты способны предотвратить старение, оказалась столь соблазнительной, что за последние десятилетия сотни тысяч людей приняли участие в клинических испытаниях. Оказалось, что антиоксиданты в больших дозах представляют небольшую, но верную угрозу для здоровья. Иными словами, принимая антиоксиданты, вы рискуете умереть чуть раньше. В тканях у многих животных-долгожителей низкое содержание антиоксидантных ферментов, а у животных с малой продолжительностью жизни их, напротив, гораздо больше. Что еще страннее, прооксиданты могут увеличивать продолжительность жизни животных. Учитывая сказанное, нет ничего удивительного в том, что большинство геронтологов переключилось на другие темы. Все это я подробно обсуждал в предыдущих книгах. Мне приятно думать, что провал идеи с антиоксидантами я предугадал еще в 2002 году, в книге “Кислород”, но это не так. Безнадежность этой затеи уже тогда была всем очевидна. Миф, будто антиоксиданты способны замедлять старение, выкристаллизовался из жадности, отсутствия альтернатив и попыток выдать желаемое за действительное.
Вы спросите: а почему я продолжаю придерживаться усовершенствованной свободнорадикальной теории старения? Есть несколько аргументов. В исходной теории упущено два очень важных фактора: передача сигналов и апоптоз. Сигнальная функция свободных радикалов играет очень важную роль в физиологии клетки, в том числе в апоптозе. Угнетение свободнорадикальных сигналов при помощи антиоксидантов опасно, и (как показал Антонио Энрикес и его коллеги) антиоксиданты могут подавлять синтез АТФ в клеточных культурах. Вероятно, сигнальные функции свободных радикалов позволяют оптимизировать процесс дыхания на уровне отдельных митохондрий за счет увеличения числа дыхательных комплексов и, как следствие, повышения дыхательной производительности. Поскольку митохондрии проводят большую часть времени, то сливаясь друг с другом, то разделяясь, увеличение числа дыхательных комплексов (и числа молекул митохондриальной ДНК) приводит к увеличению числа митохондрий: митохондриальному биогенезу[101]. Таким образом, образование свободных радикалов может увеличивать количество митохондрий и усиливать производство АТФ. Соответственно, подавление свободных радикалов антиоксидантами препятствует митохондриальному биогенезу и приводит к снижению синтеза АТФ, как показал Энрикес (рис. 35). Антиоксиданты могут нарушать выработку энергии в клетке.
С другой стороны, повышение уровня свободных радикалов после достижения предела запускает апоптоз. Так что делают свободные радикалы: оптимизируют процессы дыхания или уничтожают клетки? На самом деле противоречия нет. Повышенное образование свободных радикалов сигнализирует о снижении дыхательной производительности относительно затрат. Если проблему удается решить путем увеличения количества дыхательных комплексов, все заканчивается благополучно. Но если это не помогает, клетка просто кончает с собой, избавляя клеточную популяцию от неисправных генов. Когда на место поврежденной клетки придет исправная (которую произвела стволовая клетка), проблема окажется решена, точнее, устранена.
Эта чрезвычайно важная роль свободнорадикальных сигналов в оптимизации дыхания позволяет объяснить, почему антиоксиданты не продлевают жизнь. Они могут подавлять дыхательные процессы в культуре клеток, поскольку в ней нет защитных систем, которые в норме присутствуют в целом организме. Большие дозы антиоксидантов, например витамина C, плохо усваиваются (часто это вызывает понос). Избыток, который все же попал в кровь, быстро выводится с мочой. Словом, концентрация антиоксидантов в крови держится на постоянном уровне. Это не означает, что вы должны избегать употребления пищи, содержащей антиоксиданты, особенно овощей и фруктов: они необходимы. Для вас может даже оказаться полезным дополнительный прием антиоксидантов, если вы плохо питаетесь или если у вас авитаминоз. Но бессмысленно пичкать себя антиоксидантами, если вы и так нормально питаетесь (принимаете пищу, которая содержит и антиоксиданты, и прооксиданты). Если бы внутренний баланс организма позволил повышение концентрации антиоксидантов в клетке, это вызвало бы нарушения и даже могло бы привести к смерти из-за недостатка энергии. Поэтому организм старается не допустить этого и регулирует уровень антиоксидантов внутри и снаружи клеток.
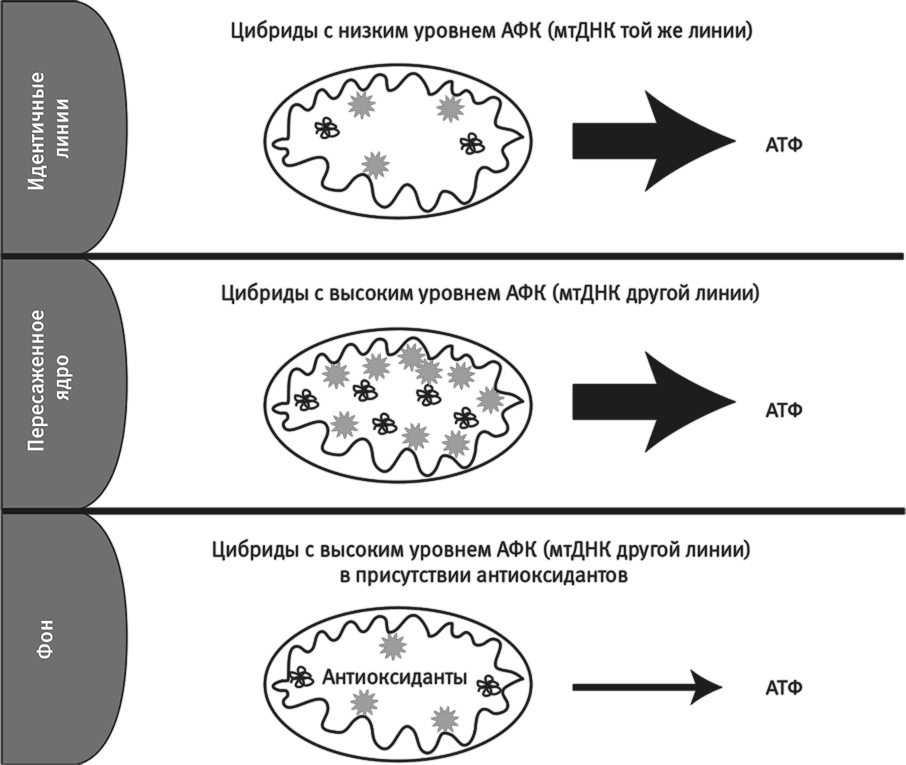
Рис. 35. Антиоксиданты могут быть опасны.
Показаны результаты эксперимента с цитоплазматическими гибридами клеток (цибридами). В каждом случае набор ядерных генов в клетках почти идентичен (главные различия – в митохондриальных геномах). В эксперименте фигурируют митохондриальные ДНК двух типов: первые принадлежат той же линии мышей, что и ядерные гены (верхняя схема), вторые – родственной линии мышей, у которых митохондриальный геном сильно отличается (средняя схема). Аббревиатура “АФК” обозначает активные формы кислорода. На уровень синтеза АТФ указывает толщина стрелки. Этот показатель одинаков у цибридов и с низким, и с высоким уровнем АФК. При этом цибриды с низким уровнем АФК в процессе синтеза АТФ не испытывают проблем со свободными радикалами (“вспышки” внутри митохондрий) – их формируется мало. А у цибридов с высоким уровнем АФК свободных радикалов образуется более чем в два с лишним раза больше, и у них вдвое больше молекул митохондриальной ДНК. Видимо, образование свободных радикалов активизирует процессы дыхания. Эта интерпретация подтверждается нижней схемой. Антиоксиданты уменьшают количество свободных радикалов, при этом вызывая снижение числа молекул митохондриальных ДНК, и, главное, подавляют синтез АТФ. Таким образом, антиоксиданты нарушают сигнальную функцию свободных радикалов, которая в норме оптимизирует процессы дыхания.
Апоптоз, уничтожая дефектные клетки, стирает все следы того, что вообще имелись какие-либо неполадки. Сигнальные функции свободных радикалов вместе с апоптозом опровергают большинство предсказаний свободнорадикальной теории старения в ее исходном виде, сформулированной задолго до открытия этих процессов. Именно по этим причинам не обнаружено ни достоверного повышения скорости образования свободных радикалов, ни увеличения числа митохондриальных мутаций, ни накопления окислительных повреждений, ни положительных эффектов антиоксидантов, ни ошибки катастроф. Все это порождает цельную картину, объясняющую, почему неверны почти все предсказания оригинальной свободнорадикальной теории старения. Но это не дает никаких подсказок, почему свободнорадикальная теория все же может оказаться верна. Ведь если свободные радикалы в клетке находятся под строгим контролем и даже выполняют полезную функцию, то какое отношение они имеют к старению?
Свободные радикалы позволяют объяснить различия в продолжительности жизни у разных видов. Уже в 20-х годах XX века было известно, что она зависит от скорости метаболизма. Одна из первых статей, посвященных этой теме, за авторством Реймонда Перла, так и называлась: “Почему лентяи живут дольше”. (На самом деле все наоборот.) С этой статьи Перл начал развивать свою знаменитую “теорию темпа жизни”, некоторые предпосылки которой действительно справедливы. Животные с низкой скоростью метаболизма (чаще всего крупные, например слоны), как правило, живут дольше животных с высокой скоростью метаболизма, например крыс и мышей[102]. Это правило применимо внутри таких больших групп, как рептилии, млекопитающие и птицы, но плохо работает между этими группами. Поэтому к идее Перла относились с сомнением или игнорировали ее. На самом деле эти несоответствия легко объяснить через образование свободных радикалов.
Свободнорадикальная теория старения предполагает, что свободные радикалы – это неизбежный побочный продукт дыхания. Считалось, что в них превращается 1–5 % потребляемого кислорода. Это неверно по двум причинам. Во-первых, эти цифры получены в результате измерений, сделанных на клетках или тканях, которые подвергались воздействию атмосферного кислорода, концентрация которого значительно превышает концентрацию кислорода в организме. Реальное количество свободных радикалов может быть ниже на несколько порядков, но мы не знаем, как именно это проявляется. Во-вторых, свободные радикалы являются не неизбежным побочным продуктом дыхания, а целенаправленно производимыми сигнальными молекулами, и скорость их образования сильно различается у разных видов и в разных тканях. Эта скорость зависит от времени суток, гормонального состояния, потребления калорий и физической активности. Выполняя физические упражнения, вы потребляете больше кислорода, и поэтому в клетках образуется больше свободных радикалов, правильно? А вот и нет. Их количество не меняется – или даже уменьшается. Это обусловлено тем, что при повышенном потреблении кислорода ускоряется поток электронов по дыхательной цепи, и дыхательные комплексы становятся менее восстановленными и с меньшей вероятностью реагируют с кислородом (рис. 36). Детали для нас не важны, а вывод такой: прямой взаимосвязи между скоростью метаболизма и выработкой свободных радикалов нет. Мы упоминали, что птицы, если судить по скорости метаболизма, живут гораздо дольше, чем “должны” бы. У них очень быстрый метаболизм, но при этом относительно малая скорость образования свободных радикалов и большая продолжительность жизни. Существует корреляция между уровнем образования свободных радикалов и продолжительностью жизни. Хорошо известно, что не все корреляции свидетельствуют о существовании причинно-следственной связи, но эта выглядит многообещающе. Есть ли здесь причинно-следственная связь?
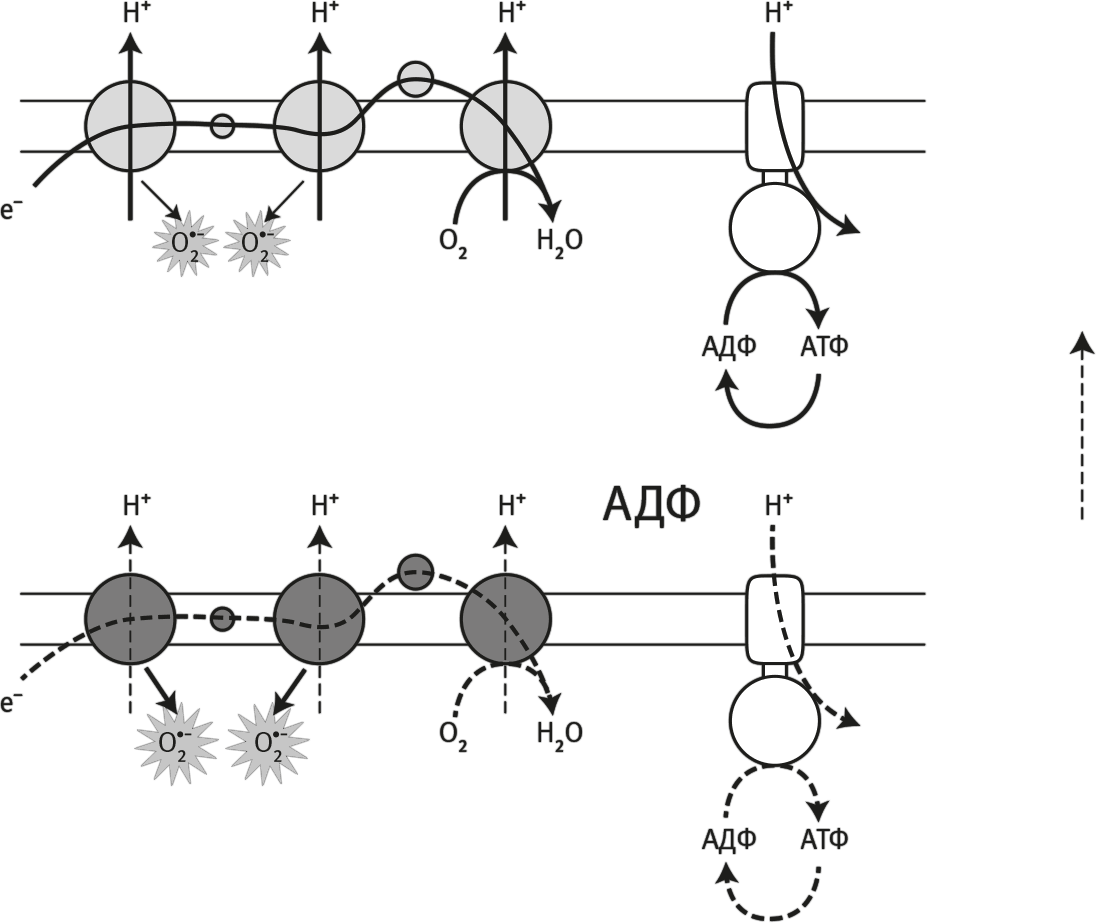
Рис. 36. Почему лениться вредно для здоровья.
Согласно свободнорадикальной теории старения, в процессе дыхания небольшая часть электронов “утекает” из дыхательной цепи, непосредственно взаимодействуя с кислородом, что приводит к образованию свободных радикалов, например супероксидного анион-радикала (O2•–). При физической активности мы потребляем больше кислорода, и поток электронов по цепи ускоряется. Предполагалось, что даже если доля “утекающих” электронов остается прежней, свободных радикалов должно становиться больше. Но это не так. На верхней схеме отражена ситуация при физической нагрузке: электроны быстро движутся по цепи, поскольку АТФ потребляется с высокой скоростью. Это позволяет протонам течь через АТФ-синтазу. В результате потенциал на мембране снижается, белки дыхательной цепи могут перекачивать больше протонов, а это заставляет электроны быстрее бежать по цепи к кислороду. Накопления электронов на дыхательных комплексах не происходит, и степень их восстановления снижается (показано светло-серым цветом). Это означает, что во время физической нагрузки образуется мало свободных радикалов. Наоборот дело обстоит во время отдыха (нижняясхема): в отсутствие активности масштабы образования свободных радикалов могут быть весьма велики. Низкое потребление АТФ означает, что мембранный потенциал высокий. Клеткам становится трудно перекачивать протоны, дыхательные комплексы постепенно переполняются электронами (показано темно-серым цветом), а свободных радикалов образуется больше. В общем, лучше не лежать, а побегать.
Рассмотрим последствия, к которым приводят свободнорадикальные сигналы в митохондриях: оптимизацию дыхательных процессов и уничтожение нефункциональных митохондрий. Те митохондрии, в которых образуется больше свободных радикалов, дадут больше своих копий: свободные радикалы сигнализируют о недостаточной активности процессов дыхания и, чтобы это компенсировать, вызывают увеличение числа митохондрий. Но что если недостаточная активность дыхательных процессов вызвана не низким количеством дыхательных комплексов и митохондрий, а несовместимостью митохондриального генома с ядерным? С возрастом могут происходить митохондриальные мутации, приводящие к образованию смеси митохондрий разных типов, и некоторые из них лучше других сочетаются с ядерными генами. И возникает проблема. Митохондрии, которые хуже всего подходят к ядерному геному, будут производить больше всего свободных радикалов и поэтому будут активнее всего размножаться. Возможны два варианта развития событий: либо клетка уходит в апоптоз и погибает вместе с мутантными митохондриями, либо этого не происходит. Сначала рассмотрим, что будет, если клетка погибнет. В этом случае она либо заменяется другой клеткой, либо нет. Если заменяется, то все заканчивается хорошо. Но если она не заменяется, как происходит в мозге или в мышцах сердца, то такие ткани будут медленно терять в весе. Так как число клеток становится меньше, а объем работы остается прежним, увеличивается нагрузка на клетки. Это вызывает у них физиологический стресс, который сопровождается изменением активности тысяч генов (как это происходит в семенниках дрозофил, страдающих митонуклеарной несовместимостью). Заметьте, что для этого не нужно, чтобы свободные радикалы повреждали белки или вызывали “катастрофу ошибок”. Все это возникает из-за коварных свободнорадикальных сигналов внутри митохондрий, которые приводят к разрушению тканей, физиологическому стрессу и изменениям в регуляции генов – ко всем признакам, ассоциированным со старением.
А если такая клетка не вступает в апоптоз и не погибает? Если ее собственные энергетические потребности невысоки, их можно удовлетворить за счет работы дефектных митохондрий или молочнокислого брожения (которое ошибочно называют анаэробным дыханием). Клетка, накопившая митохондриальные мутации, становится “стареющей”. Она перестает расти, но ее присутствие в тканях может представлять опасность, поскольку такие клетки нередко вызывают хронические воспаления и нарушение баланса факторов роста. Это стимулирует деление клеток, которые склонны к активному росту, например стволовых клеток и клеток кровеносных сосудов, и они могут начать делиться тогда, когда не следует. Если вам не повезет, они превратятся в злокачественную опухоль. Как известно, возникновение раковых опухолей в большинстве случаев связано со старением.
Еще раз подчеркну: этот процесс развивается из-за недостатка энергии, который связан со свободнорадикальными сигналами внутри митохондрий. С возрастом мутации накапливаются, и это вызывает рассогласование митохондрий с ядром и нарушает их производительность. Здесь принципиальное отличие моей теории от исходной свободнорадикальной теории старения: в моей теории не фигурируют окислительные повреждения митохондрий или каких-либо других структур (это не исключено, но можно обойтись и без этого). Свободные радикалы служат сигналами, повышающими выработку АТФ. Это объясняет, почему антиоксиданты не помогают: не продлевают жизнь и не предотвращают заболевания. Ведь если антиоксиданты все-таки проникнут внутрь митохондрии, они будут нарушать выработку энергии[103]. Эта теория также способна объяснить экспоненциальный рост заболеваемости и смертности по мере старения. У тканей есть запас прочности, его хватит на десятки лет, но постепенно ткань достигает состояния, когда она уже не способна нормально функционировать. Эти процессы идут в организме каждого человека, поэтому смертность в последние десятилетия жизни экспоненциально возрастает.
Реймонд Перл заблуждался: лентяи не живут дольше. Напротив, физические упражнения увеличивают продолжительность жизни. Кроме них, полезны определенные ограничения в потреблении калорий, а также низкоуглеводная диета. Все это активизирует физиологические реакции ответа на стресс (в том числе прооксиданты), которые могут избавлять организм от поврежденных клеток и дефектных митохондрий и ненадолго продлевать жизнь, но, как правило, ценой снижения плодовитости[104]. Мы снова наблюдаем взаимосвязь между аэробной производительностью, плодовитостью и продолжительностью жизни. Но у изменений, которых можно добиться, подкручивая настройки нашего организма, есть предел. Максимально возможная продолжительность жизни, определенная ходом эволюции, в конечном счете зависит от сложности синаптических контактов в мозге и от размеров популяций стволовых клеток в других тканях. Говорят, однажды Генри Форд дал указание обследовать автомобильные свалки, чтобы определить, какие детали ломаются реже всего. Когда он это выяснил, то распорядился, чтобы эти части заменяли теми, что дешевле. Эволюция руководствуется сходной логикой. Например, нет смысла держать в выстилке желудка большую популяцию стволовых клеток: они не пригодятся, потому что мозг выйдет из строя раньше. Так организм оказался оптимизирован под ожидаемую продолжительность жизни. Не думаю, что мы сумеем жить дольше 120 лет лишь благодаря точной регулировке организма.
Но добиться этого в ходе эволюционных процессов – совсем иное дело. Вернемся к различиям высоты “порога смерти” у разных организмов. У видов с высокой активностью дыхательных процессов, например птиц и летучих мышей, этот порог низкий. Это означает, что даже небольшие количества свободных радикалов в ходе эмбрионального развития вызывают апоптоз, поэтому развиваются лишь те особи, у которых свободных радикалов образуется очень мало. Низкий уровень формирования свободных радикалов обусловливает большую продолжительность жизни (по причинам, которые мы только что рассмотрели). И наоборот, у животных с низкой активностью дыхательных процессов (мышей, крыс и т. д.) “порог смерти” высок: они устойчивы к большим количествам свободных радикалов, и их жизни из-за этого короче[105]. Отсюда прямо следует, что отбор в пользу увеличения аэробной производительности на протяжении многих поколений должен приводить к увеличению продолжительности жизни. И это действительно так. Например, крыс можно отбирать по их способности бегать на беговой дорожке. Если скрещивать между собой лучших бегунов, через несколько поколений продолжительность жизни крыс в этой группе возрастает. Если то же самое проделать с худшими бегунами, продолжительность жизни этих крыс, напротив, снижается. Через десять поколений аэробная производительность хороших бегунов по сравнению с плохими выросла на 350 %, а продолжительность жизни крыс-атлетов увеличилась почти на год (довольно много, учитывая, что обычно крысы живут около трех лет). Я считаю, что подобный отбор действовал в ходе эволюции летучих мышей, птиц и вообще всех теплокровных животных, что привело к увеличению срока их жизни на порядок[106].
Разумеется, никому не хочется подвергать себя отбору по такому признаку: это уже превращается в евгенику. Даже если такой отбор действительно привел бы к увеличению продолжительности жизни людей, от него было бы больше вреда, чем пользы. Но на самом деле с нами это уже произошло. Наша аэробная производительность выше, чем у других гоминид, и живем мы значительно дольше их: почти вдвое дольше шимпанзе и горилл, обладающие схожим уровнем метаболизма. Вероятно, мы обязаны этим далеким предкам, которые гонялись за газелями по африканской саванне. Стайерский бег, может быть, и не доставляет особенного удовольствия, однако именно он сформировал человека как вид. Страдания закаляют нас. На основании особенностей взаимодействия двух геномов мы можем предположить, что наши предки увеличили аэробную производительность и уменьшили масштабы образования свободных радикалов. При этом продолжительность их жизни выросла, а плодовитость снизилась. Насколько эта гипотеза справедлива? Можно проверить эмпирически. Но, так или иначе, она неизбежно вытекает из мозаичности митохондрий. Мозаичность возникла 2 млрд лет назад вместе с появлением эукариотической клетки: уникальным событием, которое освободило бактерий от энергетических ограничений и позволило им выйти на новый уровень. И неудивительно, что вид заката над африканскими равнинами заставляет сердце биться быстрее: это позволяет нам прикоснуться к странной, запутанной и чудесной цепи событий, которая уходит вглубь времен, к нашим обезьяноподобным предкам, а от них и к моменту зарождения жизни.
| <<< Назад Часть IV Предсказания |
Вперед >>> Эпилог Из глубины |
- 753. Какую часть мировых пищевых ресурсов дает океан?
- Один из корундов (сапфир)
- Мезозойский период
- § 40. Круговорот веществ и энергии в биосфере
- Поход в Средиземное море
- Калийные удобрения
- 2. Ботулизм
- Глава 2 Вырасти себя сам
- Окрас радужины глаза
- Часть 3. «На острие социальной эволюции: “Я” – “Мы” – “Они”»
- 10.3. Деградация почвенного покрова
- Евреи, пуштуны и осетины гаплогруппы G
![Вопрос жизни [Энергия, эволюция и происхождение сложности]](https://ours-nature.ru/new_site/img/1377312123/cover.jpg)