Книга: Старение и увеличение продолжительности жизни
Нейрогормональный контроль
| <<< Назад Нейронный транспорт веществ |
Вперед >>> Местные механизмы регуляции |
Нейрогормональный контроль
Современная наука пытается выяснить физиологические механизмы поведения, эмоций, инстинктов, памяти. Однако она еще далека от того, чтобы понять, почему один человек гениален, а другой примитивен; почему один страстен, а другой холоден. В поиске этих механизмов, так же как и в анализе приспособительных возможностей организма, большое внимание уделяется гормонам.
Гормоны — физиологически высокоактивные вещества. Они синтезируются в железах внутренней секреции, оказывают также регуляторное влияние на все важнейшие стороны метаболизма клеток, включая и генетический аппарат, биосинтез белка. Роль гормонов в регуляции деятельности организма так велика, что недостаток или избыток ничтожного их количества может стать причиной грубых нарушений в организме, болезней, резких изменений психики, поведения, эмоций, ослабления работоспособности.
Пожалуй, ни в одной другой области геронтологии исследователи не были так категоричны, как при изучении роли желез внутренней секреции в механизме старения. Подкупало внешнее сходство явлений: удаление ряда желез вызывает сдвиги в организме, напоминающие признаки старения, а введение гормонов, экстрактов желез, их подсадка во многом восстанавливают уровень деятельности организма. Это привело к тому, что в последние годы пристальное внимание исследователей привлекают возрастные изменения гормональной регуляции, используются новые методические возможности, накапливается большой фактический материал. Представление о снижении концентрации всех гормонов в крови оказалось неверным. Концентрация половых гормонов, гормонов щитовидной железы, некоторых гормонов гипофиза к старости падает; содержание гормонов коры надпочечников — альдостерона, кортизола — не изменяется, а концентрация многих гормонов гипофиза — аденокортикотропного гормона (АКТГ), фолликулостимулирующего (ФСГ), лютеинизирующего (ЛГ) — в старости растет. Каждая клетка находится одновременно под контролем многих гормонов, и характер этого влияния сложно изменяется (рис. 25).
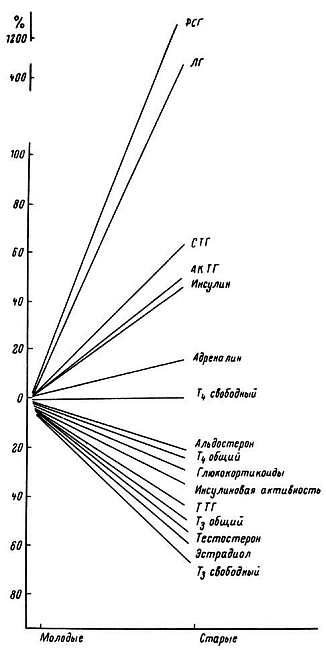
Рис. 25. Изменение концентрации различных гормонов в крови (сдвиг по отношению к молодому возрасту).
ФСГ — фолликулостимулирующий гормон гипофиза; ЛГ — лютеинизирующий гормон гипофиза; СТГ — соматотропный гормон гипофиза; АКТГ — адренокортикотропный гормон гипофиза; ТТГ — тиреотропный гормон гипофиза; Т3 и Т4 — гормоны щитовидной железы
Принципиально важен системный подход, анализ гормональных механизмов с позиций саморегуляции. В подавляющем большинстве случаев, анализируя возрастные изменения, исследователи ограничивались характеристикой деятельности железы, секреции того или иного гормона. Вместе с тем, чтобы объяснить возрастные изменения гормональной регуляции, необходимо для каждого из ее типов проследить сдвиги в разных звеньях цепи нейрогормональной саморегуляции: гипоталамо-гипофизарный контроль железы (образование и выделение гормонов) — транспортные формы гормона в крови — обмен гормона в ткани — реакция тканей на действие гормона (прямая связь) — влияние гормонов на центры (обратная связь) и др.
Сложнейшие взаимоотношения между нервной и эндокринной системами определяются, как мы уже указывали, функцией гипоталамуса, его нейросекреторной деятельностью. В составе нейросекрета много посредников, активизирующих или угнетающих гормонообразование в гипофизе. Эти гипоталамические медиаторы (посредники) называются рилизинг-факторами (от англ. "releasing" — освобождающий). Кроме рилизинг-факторов, в гипоталамусе образуются вещества — химические предшественники некоторых гормонов гипофиза.
Клетки, образующие нейросекрет, в свою очередь находятся под влиянием выделяющихся в окончаниях нейронов медиаторов — норадреналина, серотонина, ацетилхолина, ?-аминомасляной кислоты и др. Одни из этих медиаторов в большей мере активируют, другие подавляют синтез рилизинг-факторов. Более того, возбуждающие и тормозные влияния могут осуществляться одним и тем же медиатором за счет соединения с различными рецепторами клетки. При старении неодинаково в разных ядрах гипоталамуса изменяется синтез медиаторов, что изменяет запуск всей нейрогормональной цепи. В ряде ядер существенно падает обмен этих веществ. При старении ослабляется синтез ряда рилизинг-факторов. Вместе с тем секреция многих гипофизарных гормонов растет. Это происходит в результате роста чувствительности секреторных клеток гипофиза к рилизинг-факторам.
Многие гормоны находятся в крови как в свободном, так и в связанном состоянии. Оказалось, что при старении снижается доля связанного гормона (щитовидной железы, коры надпочечников), и за счет этого поддерживается достаточный уровень физиологически активной свободной формы. При старении изменяется реакция клеток на действие ряда гормонов.
Важно и то, что возрастные изменения реакции тканей не укладываются в количественные категории "больше — меньше". Часто возникают качественные различия в реакциях. К примеру, половые гормоны, активизируя у молодых и взрослых животных синтез белка, у старых могут стимулировать распад. Адреналин вызывает у старых животных не рост, а падение тонуса сосудов и т. д. Тироксин может у старых животных стимулировать синтез белка, а у молодых — распад. Чрезвычайно важно, что дозы гормона, стимулирующие у молодых животных ту или иную функцию, у старых могут ее подавлять. Иными словами, один из механизмов старения может состоять в активном подавлении гормоном функции той или иной железы, ткани-мишени.
Большую роль в механизме старения играет угасание функции половых желез. Оно приводит к ослаблению половой активности, потере репродуктивной способности, к большому комплексу возрастных изменений, происходящих во время климактерического периода. Неверно связывать, как это делают многие, начало старения с развитием климакса. Ведь климактерический период — следствие предшествующего старения. Климакс, потеря репродуктивной способности ограждают будущие поколения от передачи нарушенной генетической информации, накапливающейся в половых клетках с возрастом. В этой сопряженности генетической и гормональной перестройки — важный адаптивный механизм сохранения полноценности вида. Угасание функции половых желез благодаря множеству связей перестраивает весь контур нейрогуморальной регуляции в стареющем организме. Эти сдвиги нередко становятся возрастной предпосылкой развития атеросклероза, артериальной гипертонии, ишемической болезни сердца, опухолей. Кроме того, половые гормоны обладают анаболическим действием, активируют биосинтез белка, и изменение их концентрации в крови существенно влияет на старение организма.
Система саморегуляции половых желез может быть представлена так: гипофизарные гонадотропные гормоны (ФСГ и ЛГ) активируют синтез половых гормонов (прямая связь), а половые гормоны действуют на ткани и по принципу обратной связи влияют на синтез гонадотропных гормонов. В старости у мужчин существенно снижается секреция мужского полового гормона — тестостерона (рис. 26). Концентрация женского полового гормона (эстрадиола), количество которого у мужчин невелико, в старости даже нарастает. У женщин падает содержание в крови эстрадиола и прогестерона. Наряду с этим растет концентрация гонадотропных гормонов гипофиза (ФСГ и ЛГ). Можно полагать, что события развиваются следующим образом: сначала ослабевает секреция половых желез, а затем по принципу обратной связи активируется синтез гонадотропных гормонов. О правоте этого предположения свидетельствуют данные Н. С. Верхратского и Е. В. Мороз. Они показали, что снижение концентрации половых гормонов в крови наступает у мужчин и женщин раньше, чем рост ФСГ и ЛГ (рис. 26).
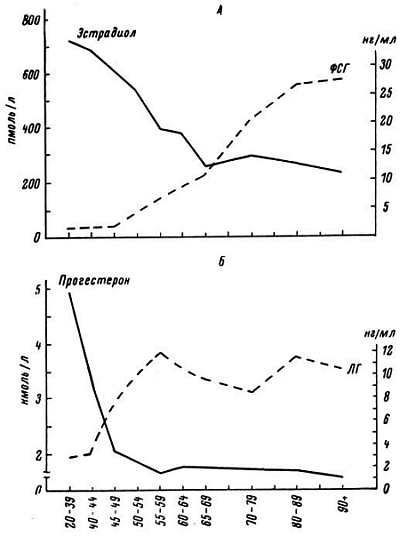
Рис. 26. Изменение с возрастом у женщин концентрации гонадотропных и половых гормонов (эстрадиола и прогестерона) в крови. Обозначения те же, что на рис. 25
В механизме старения организма играют роль изменения функций щитовидной железы. Известно, что ее гормоны — тироксин и трийодтиронин — регулируют активность более ста ферментов, влияют на процессы биосинтеза белка и генерации энергии в клетке. При старении снижается активность системы тиреоидной регуляции, и это может стать одной из причин многообразных сдвигов: падения потребления кислорода, образования богатых энергией соединений, изменения в биосинтезе белка, сдвигов в течении основных процессов в центральной нервной системе, снижения сократительной функции сердца и др.
С возрастом наступают неравномерные изменения как на этапе прямой, так и обратной связи в системе тиреоидной регуляции. Наряду со старением развиваются и процессы витаукта. Они направлены на сохранение функции щитовидной железы. К ним можно отнести снижение количества связанных и увеличение свободных форм гормона, повышение чувствительности щитовидной железы к тиреоидному гормону гипофиза а тканей — к действию гормонов щитовидной железы и др. Однако, несмотря на эти проявления витаукта снижение надежности функции щитовидной железы с возрастом нарастает. В основе этого лежат нарушения обмена веществ и структуры клеток щитовидной железы.
С возрастом развивается скрытая инсулиновая недостаточность. Уровень сахара крови у здоровых старых людей существенно не изменяется, однако их толерантность, устойчивость к углеводам падает. При сахарной нагрузке у пожилых и старых людей, по сравнению с молодыми, концентрация сахара крови становится выше и медленнее возвращается к исходному уровню. Более того, инсулиновая недостаточность нарастает, чаще развивается диабет. В США заболеваемость диабетом у мужчин до 25 лет — 1.1 на 1000 человек населения, у 55-64-летних — 25.2, у 65-74-летних — 37.4.
Известен ряд гормонов, вызывающих мобилизацию углеводов из тканей и, соответственно, рост уровня сахара в крови: адреналин, глюкагон, глюкокортикоиды и др. Им всем противостоит всего один гормон — инсулин. Быть может, в этом одна из причин возможного срыва столь важного механизма. По современным представлениям, инсулин усиливает транспорт сахара, аминокислот, ионов через клеточную мембрану, стимулирует биосинтетические процессы, а также снижает катаболическое действие других гормонов (гормона роста, гормонов коры надпочечников).
Долгое время все казалось ясным и простым: при старении снижается функция поджелудочной железы, и это ведет к недостатку инсулина в крови со всеми последующими нарушениями обмена веществ в организме. Однако работы последних лет, в том числе данные, полученные в нашей лаборатории, показали, что дело обстоит значительно сложнее.
Оказалось, что у пожилых людей с пониженной толерантностью к углеводам, т. е. у людей, медленнее усваивающих этот углевод, количество инсулина в крови велико, однако он не активен. Частично это связано с тем, что при старении в крови нарастает концентрация веществ, ингибирующих, подавляющих активность свободного инсулина. Комплекс инсулина с этими веществами становится неактивным. Инактивация части свободного инсулина в старости была показана большой серией опытов. Инсулин в одном и том же количестве добавлялся к сыворотке крови молодых и старых животных. Вслед за тем сравнивалось действие этих растворов на сахар крови, образование гликогена, МП клеток, электрическую активность мозга и др. Результат был однозначен: во всех случаях минимальный эффект вызывал инсулин, находящийся в сыворотке крови старых животных. Следовательно, в крови старых животных действительно содержатся вещества, инактивирующие свободный инсулин. Их природа до конца не изучена. Судя по всему, это — белки, один из которых — синальбумин. Низкая активность инсулина может быть также связана с переходом в кровь проинсулина — предшественника активного гормона. Кроме того, напомним, что инсулин в регуляции углеводного обмена противостоит целой группе гормонов. С возрастом соотношение сдвигается в сторону этих контринсулярных факторов.
Ингибирование свободного инсулина приводит к тому, что он становится неэффективным; на этой основе может развиваться инсулиновая недостаточность. В ответ мобилизуются определенные механизмы, направленные на восстановление уровня инсулиновой активности крови. Известно, что кровь, оттекающая из поджелудочной железы, попадает в печень. В клетках печени содержится фермент инсулиназа, который расщепляет часть поступающего из поджелудочной железы инсулина. По нашим данным, в старости резко, почти вдвое, снижается активность инсулиназы: (84.7±4.8)% У молодых крыс, (48.3±8.9)% У старых. Это предупреждает от разрушения значительные количества инсулина и способствует нарастанию его содержания в крови.
Инсулин синтезируется в ?-клетках поджелудочной железы. Существуют два фактора регуляции процесса синтеза и выхода инсулина из железы: глюкоза и холинергические нервные влияния. Клетки поджелудочной железы имеют специфическую систему, рецепторы, чувствительные к глюкозе. Раздражение рецепторов глюкозой передается на внутреннюю поверхность мембраны, и здесь активируется фермент аденилатциклаза, катализирующий образование из АТФ своеобразного внутриклеточного медиатора — циклического 3,5-АМФ. Это соединение уже внутри клетки активизирует специфические процессы синтеза гормона.
В старости снижены потенциальные возможности ?-клеток поджелудочной железы. Кроме того, при старении ослабевает нервная регуляция поджелудочной железы, снижается активность ферментов, участвующих в медиаторной передаче.
При старении возникает сложная и опасная ситуация. Она создает скрытую инсулиновую недостаточность организма. Благодаря этому ограничиваются мобилизационные способности организма и легче, чаще возникает диабет. В старости в клетках поджелудочной железы наступают деструктивные изменения, часть их гибнет. Снижение активности инсулина в крови, подстегивая поджелудочную железу, способствует истощению и без того измененных ?-клеток.
Итак, в старости создается комплекс внепанкреатических и панкреатических предпосылок развития инсулиновой недостаточности, способствующей возникновению диабета.
Представленный подход важен еще потому, что он открывает новые возможности в терапии диабета. Если в старости содержание инсулина в крови растет и в то же время он ингибирован, инактивирован, то можно восстановить уровень инсулиновой обеспеченности организма, разрывая связь между ингибитором и гормоном.
Описанная ситуация усугубляется еще и тем, что при старении снижается реактивность тканей к действию гормона. Это связано с тем, что с возрастом падает число рецепторов клеток, реагирующих на действие инсулина. Снижение инсулиновой активности приводит к последовательному нарушению многих видов обмена. Инсулин воздействует на ключевой фермент химических превращений глюкозы — гексокиназу. Снижение активности свободного инсулина в старости ведет к тому, что затрудняется переход глюкозы в клетку, ее усвоение, ослабевает синтез гликогена. Именно в связи с этим при различных нагрузках более длительно поддерживается высокий уровень сахара в крови, гипергликемия, и это в какой-то мере способствует переходу его в клетки. В связи со сдвигами в углеводном обмене снижается синтез основного источника энергии в клетке — АТФ. Возрастные сдвиги в инсулиновой обеспеченности объясняют многие нарушения жирового обмена.
Повышение содержания связанной формы инсулина приводит к усилению синтеза жира из углеводов в жировой ткани. Быть может, этим объясняется ожирение, тучность многих пожилых людей. Вместе с тем в печени, в мышечной ткани, из-за снижения активности свободного инсулина процессы обмена жира ослабевают, страдает окисление жиров, накапливаются продукты промежуточного обмена. Нарушение окисления углеводов способствует образованию и накоплению холестерина. Сдвиги в жировом обмене в разных тканях существенно влияют на энергетику клетки; ей становится труднее использовать в качестве субстрата жирные кислоты.
И, наконец, нарастающая при старении инсулиновая недостаточность способствует сокращению потенциальных возможностей системы биосинтеза белка. Известно, что инсулин повышает проницаемость клеточной мембраны к аминокислотам, активирует сборку белка в рибосомах.
В механизме осуществления приспособительных реакций организма велика роль коры надпочечников. В ней вырабатываются минералкортикоиды (альдостерон), гормон, регулирующий обмен ионов, и глюкокортикоиды (кортизол и др.), обладающие очень широким спектром действия.
На рис. 27 приведены данные Л. В. Магдич, свидетельствующие о том, что в системе регуляции альдостерона как на этапе прямой, так и обратной связи возникают явления старения и витаукта. Как видно, секреция альдостерона у старых животных снижается. Однако концентрация его в крови остается на прежнем уровне, так как ослабевает распад гормона. Наряду с этим растет чувствительность механизмов секреции гормона к стимулам, идущим от нервной системы (АКТГ, вазопрессин), и, что очень важно, к повышению концентрации ионов калия в крови — физиологического стимулятора синтеза альдостерона. Важное значение имеет и повышение чувствительности тканей к гормону. Можно полагать, что сдвиги в альдостероновой регуляции вносят существенный вклад в развивающиеся при старении нарушения ионного гомеостаза, который в свою очередь влияет на все стороны деятельности клеток.
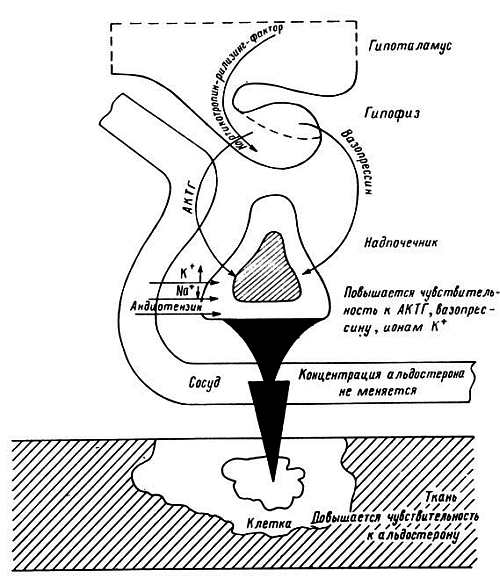
Рис. 27. Схема изменения альдостероновой регуляции в старости
Концентрация другого гормона коры надпочечников — кортизола — с возрастом практически не изменяется. Однако за этой неизменностью скрываются сдвиги во всех звеньях системы его регуляции — рост количества АКТГ, стимулирующего синтез гормона, повышение чувствительности железы к ряду регуляторных воздействий.
В клетках существует специальный механизм, позволяющий реагировать на действие гормонов. Это клеточные рецепторы — своеобразные высокочувствительные антенны. Реакция клетки не просто следует за количеством действующего гормона, а во многом зависит от числа и свойств этих рецепторов. Одни из них расположены на клеточной мембране, другие — внутри клетки. Как уже указывалось, влияние многих гормонов на клеточные рецепторы осуществляется через специальную систему — аденилатциклаза — циклические нуклеотиды. В изменении реактивности клетки решающее значение имеют сдвиги в состоянии ее рецепции. Накопилось немало данных об уменьшении числа рецепторов к различным гормонам в старости. Однако все оказалось значительно сложнее. Обычно оценивается число рецепторов, т. е. пусковых точек действия в клетке, и их сродство — способность рецептора реагировать с гормоном. В сердце число рецепторов к адреналину падает, а сродство повышается. В результате чувствительность сердца к адреналину и норадреналину растет, а реакционная способность, возможная амплитуда реакции падает, так как снижается число адренорецепторов. Не все рецепторы к гормонам изменяются именно таким образом. Так, число рецепторов к альдостерону в почках растет, а их сродство к гормону падает. Если снижается реактивность клеток к гормону, то это не всегда означает, что уменьшилось число рецепторов. С. А. Танин показал, что рецепторы могут быть, но они как бы "молчат", становятся неактивными. Так, у старых животных отсутствует реакция нервных клеток спинного мозга на половые гормоны. Если животному предварительно ввести антиоксидант дибунол, то реакция восстанавливается. Важно, что, влияя на синтез рецепторов, на их сродство к гормонам, можно управлять реактивностью клетки в старости. Есть вещества, конкурирующие с гормонами за рецептор. К ним относятся так называемые адреноблокаторы. Молекулы их "садятся" на рецептор и предупреждают действие адреналина и норадреналина. Когда нужно ослабить симпатические нервные влияния, действие катехоламинов (а это необходимо с лечебной целью при артериальной гипертонии, инфаркте миокарда, аритмиях), используют эти вещества. Концентрация в крови вазопрессина — гормона гипофиза — увеличивается с возрастом, и это способствует развитию артериальной гипертонии, коронарной недостаточности. Вазопрессин действует через специфические рецепторы в клетке. Удалось создать вещества, конкурирующие за рецепторы вазопрессина, и они оказались эффективными при лечении экспериментальной коронарной недостаточности, артериальной гипертонии.
Число рецепторов в клетке — величина не постоянная. При изменении концентрации гормона в крови может активироваться или подавляться их синтез. Одна из причин "косности" реакций клеток в старости — снижение способности регулировать число рецепторов.
| <<< Назад Нейронный транспорт веществ |
Вперед >>> Местные механизмы регуляции |
- Генорегуляторная гипотеза
- Энергетические процессы
- Последовательность старения клеток
- Структура клетки
- Функция клетки
- Мембранно-геномные механизмы
- От нейрона до мозга
- Вегетативная нервная система
- Нейронный транспорт веществ
- Нейрогормональный контроль
- Местные механизмы регуляции
- Реакции объектов регуляции
- Обратные связи
- Старение и болезни
- Контроль над эмоциями
- 915. Каким образом власти штатов осуществляют контроль за сбросом отходов в океан?
- Регуляция и контроль сенсорных сигналов
- Глава 1 Нервный контроль движений
- 4.4. Физиолого-педагогический контроль за занятиями физической культурой и физиологические критерии восстановления орган...
- Генетический контроль спорообразования
- 3. Контрольные вопросы по курсу «Основы ландшафтного планирования с элементами инженерной биологии»
- Химический контроль мозга
- Информационные технологии: интеллектуальная собственность, политкорректность и контроль над Сетью
- Контроль дыхания
