Книга: Старение и увеличение продолжительности жизни
Генорегуляторная гипотеза
| <<< Назад Глава 3. Механизмы старения и витаукта |
Вперед >>> Энергетические процессы |
Генорегуляторная гипотеза
Есть озарения, опережающие целые эпохи… Середина прошлого века. Еще неизвестно строение белков, не раскрыты их важнейшие свойства. Крупнейший химик тех времен Байер пишет: "Нет никакой надежды в ближайшее время выяснить строение белка. Должны ли мы заниматься подобного рода вопросами, если возможность их разрешения в ближайшее время невероятна, или же будем продолжать работу в тех областях, где наверное соберем богатую или хотя бы скромную жатву. Я предпочитаю последнее". И почти за двадцать лет до этого — гениальное предвидение Ф. Энгельса: "Жизнь есть способ существования белковых тел, и этот способ существования состоит по своему существу в постоянном самообновлении химических составных частей этих тел" (К. Маркс, Ф. Энгельс. Т. 20. С. 82). С тех пор прошло более ста лет. Известны характеристики живого, раскрыты тайны биосинтеза белка, и все это только подтверждает формулу Ф. Энгельса. Прямое развитие этих представлений — все современные концепции, связывающие старение с изменениями в генетическом аппарате, в механизмах биосинтеза белка.
Величайшим достижением современности явилось раскрытие роли генетического аппарата ядра клетки в синтезе белков. Здесь, в молекуле дезоксирибонуклеиновой кислоты — ДНК, заложен код, вся информация для синтеза белков. Эта информация определяет и особенности передачи по наследству, и деление клетки, и фундаментальные механизмы приспособления клетки к среде.
Генетический код, заключенный в молекуле ДНК-система расположения в ней пар нуклеотидов, — определяет последовательность расположения аминокислот в молекуле белка и его структуру. На молекуле ДНК, как на матрице, синтезируется информационная РНК (иРНК), обладающая тем же кодом, что и участок ДНК, на котором она образуется (рис. 9). Существуют гены-регуляторы, обеспечивающие порядок считывания генетической информации, и структурные гены с заключенным в них кодом построения белков.
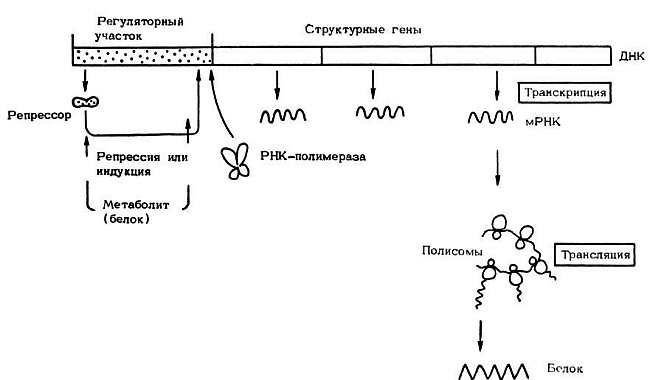
Рис. 9. Упрощенная схема регуляции биосинтеза белка. Взаимодействие специфических регуляторов (метаболисты, белки) с регуляторным участком ДНК определяет возможность для РНК-полимеразы инициировать транскрипцию, считывание генетической информации с определенных участков структурных генов. Образующаяся в результате транскрипции информационная РНК (иРНК) служит матрицей для биосинтеза белка в рибосомах
Синтез белка осуществляется в специальных органоидах клетки — рибосомах. Рибосомы либо свободно расположены в клетке, либо связаны с ее мембранами. В рибосомах 40–60 % рибосомальной РНК, а все остальное приходится на белок. Сейчас установлены основные механизмы сборки белка в рибосомах. Белок состоит из отдельных аминокислот, содержащихся в клетке. Перенос аминокислот к рибосомам осуществляется специальной транспортной РНК (тРНК). Матрицей для сборки белка является и РНК. Она несет код построения белка, отпечатанный с соответствующего участка ДНК. Информационная РНК, подобно пулеметной ленте, протягивается через рибосому. Аминокислоты, связанные с тРНК, занимают соответствующее место в образующейся цепи, а затем "сшиваются" специальными ферментами — так возникает белковая молекула. На одной иРНК могут синтезироваться все новые и новые молекулы данного белка. Процесс считывания генетической информации получил название транскрипции, а передачи информации — трансляции.
Все клетки организма произошли от одной единственной клетки — оплодотворенного яйца. Вот почему, несмотря на существование до тысячи различных типов клеток в данном организме, они содержат одинаковый геном — ДНК с одинаковым набором информации. Следовательно, дифференцировка, возникновение того или иного типа клеток, характер ее последующей структуры и функции зависят не от различий в строении ДНК в разных клетках одного и того же организма, а от особенностей реализации генетической информации, регулирования генетической активности. Человеческая память хранит множество слов. Однако для выражения определенной мысли необходимо подобрать только часть, связав их определенным смыслом. Подобно этому, для специализации, дифференцировки различных клеток нужны своя система работы генов, определенный набор белков, соответствующее пространственное их расположение, и все это определяется механизмами регуляции генома.
Сейчас все исследователи единодушны в том, что первичные механизмы старения связаны с возрастными изменениями в генетическом аппарате клеток. Первичные не потому, что они возникают раньше других, а потому, что, возникнув, они вызывают существенные нарушения в биосинтезе белка и дальнейшие нарушения в структуре и функции клеток. Не прекращаются споры о том, как и почему нарушается работа генетического аппарата, ведущая к нарушению деятельности, а затем — к гибели клеток. Среди наиболее популярных — так называемая гипотеза ошибок. Предполагается, что в течение жизни возникают ошибки в генетическом коде, что ведет к синтезу ошибочных белков, не выполняющих своей функции, более того, нарушающих деятельность клетки. Однако показано, что нуклеотидный состав ДНК с возрастом не меняется, и убедительных доказательств существования ошибочных белков пока не найдено.
В 1965 г. автор этой книги выдвинул генорегуляторную гипотезу старения, в соответствии с которой нарушения в регулировании генома играют центральную роль в механизме старения. Иными словами, не содержание хранящейся в геноме информации, а ее реализация определяет процессы старения. Очевидно, в большей мере в старении клетки играют роль нарушения в регуляторных генах, контролирующих считывание информации со структурных генов. Можно условно выделить три этапа в нарушении синтеза белка с возрастом. Первый — догеномный, когда возникают множественные нарушения в различных местах клетки, восстанавливаемые, однако, благодаря работе генетического аппарата. Второй — генорегуляторный, определяющий развитие необратимых изменений в синтезе белка, в структуре клетки. Он связан с нарушением реализации генетической информации. Третий — геноструктурный, связан с нарушением структурных генов и содержания генетической информации.
Благодаря генорегуляторным сдвигам изменяется соотношение синтеза различных белков, снижаются потенциальные возможности белоксинтезирующих систем, активируются, "пробуждаются" ранее не работавшие гены.
На основе этих изменений биосинтеза белка и происходит нарушение жизнедеятельности клеток, особенно выраженное с завершением онтогенеза.
Принципиально важно, что при изучении особенностей регулирования генома, структурно закрепленных его свойств можно понять фундаментальные механизмы развития не только старения, но и процесса витаукта. Основные механизмы жизнедеятельности организма, механизмы, направленные на увеличение продолжительности жизни, связаны с особенностями регуляции генетического аппарата. Ведь большинство различий между видами млекопитающих, столь отличающихся по продолжительности жизни, заключается в особенностях регулирования генома. Человек и шимпанзе, эволюция которых разошлась 8-20 млн. лет назад, мало отличаются по составу структурных генов. Продолжительность жизни самого человека, изменившаяся за несколько миллионов лет, связана со сдвигами в регулировании генома. Итак, существует связь между видовыми особенностями регулирования генома и продолжительностью жизни, процессами витаукта и старения. Регуляторный отдел генома, занимающий большую его часть (до 95 % ДНК), чрезвычайно активен; он менее других защищен от внутриклеточных влияний и больше всего подвержен возрастным изменениям.
В последние годы показана мозаичность структуры генов. Структурный ген, содержащий код для построения белка, разделен на отдельные участки — экзоны. Интронами называются участки ДНК, разделяющие экзоны. В процессе транскрипции (считывания) образуется РНК со всех экзонов и интронов. Затем включается процесс сплайсинга. Суть его состоит в следующем — из длинной молекулы РНК вырезаются участки, соответствующие экзонам. Вновь образованная молекула РНК проходит ядерную мембрану и переходит в цитоплазму. Оставшиеся в ядре в результате сплайсинга фрагменты РНК могут оказывать регуляторное влияние на активность генов.
Генорегуляторные изменения при старении могут быть результатом влияния этих фрагментов на считывание генетической информации, результатом изменения под их влиянием химизма ядра. О реальной роли сплайсинга в механизме старения свидетельствует и то, что вещества, подавляющие процесс транскрипции, приводят к увеличению продолжительности жизни, а стимулирующие — укорачивают ее.
Существует ряд доказательств справедливости генорегуляторной гипотезы старения.
1. В ядре клетки находится сложный молекулярный комплекс — хроматин. В нем и заключена молекула ДНК с ее генетической информацией. Кроме того, в состав хроматина входят белки, рибонуклеиновые кислоты, липиды. Хроматин является тем комплексом, благодаря которому осуществляются считывание генетической информации, регуляция генетического аппарата клетки. Вот почему наступающие с возрастом изменения структуры и функции хроматина становятся одним из ведущих генорегуляторных механизмов старения. В старости увеличивается доля неактивного хроматина и уменьшается доля активного (рис. 10). Нарастает явление так называемой гетерохроматинизации, уплотнение хроматина, делающего его менее активным. Хроматин состоит из отдельных частиц — нуклеосом, число и размеры которых изменяются при старении. Уплотнение, компактизация хроматина в старости вызвана тем, что связи между ДНК и белками становятся более прочными, между ними образуются поперечные сшивки. Все это затрудняет считывание генетической информации. Очень важно то, что уплотненные участки хроматина становятся менее доступными ферментам, "ремонтирующим" ДНК, и это способствует постепенному накоплению ее повреждений.
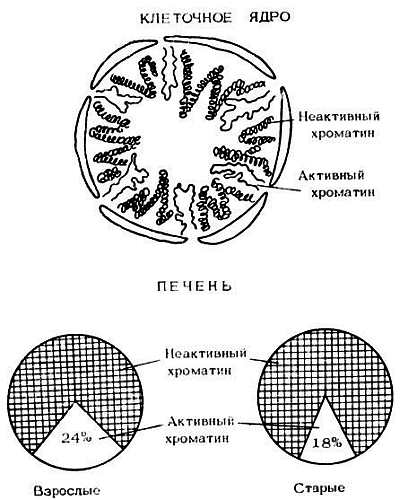
Рис. 10. Снижение количества активного хроматина в старости
2. В хроматине находятся различные группы белков — гистоновые и негистоновые. Предполагается, что гистоны в большей мере подавляют, репрессируют активность генов, а негистоновые белки — активируют, дерепрессируют. При старении изменяется соотношение этих белков и падает количество активирующих — негистоновых. Белки хроматина подвержены различным изменениям. С возрастом снижается так называемое метилирование белков хроматина. Советский исследователь Б. Ф. Ванюшин показал, что это изменяет работу регуляторных генов.
3. На молекуле ДНК синтезируются молекулы рибонуклеиновых кислот — иРНК, тРНК, рРНК. X. К. Мурадян выяснил, что при старении меняется соотношение различных классов РНК. Это говорит о перераспределении в работе отдельных генов.
4. При старении изменяется соотношение синтеза отдельных белков или их блоков, кодируемых различными генами. Многие ферменты, в том числе лактатдегидрогеназа (ЛДГ), креатинфосфокиназа и др., существуют в нескольких разновидностях. Это так называемые изоферменты. Изоферменты, в частности ЛДГ, различаются тем, что состоят из неодинаковых субъединиц, каждая из которых кодируется отдельным геном. Благодаря отличиям в структуре изоферменты более оптимально приспособлены к "работе" в том или ином органе. Субъединицы структуры изоферментов ЛДГ кодируются несколькими структурными генами, связанными с различными генами-регуляторами. За счет этого в молекуле ЛДГ могут сочетаться различные субъединицы, определяя и отличия в свойствах фермента. При старении, как показал А. Я. Литошенко, в связи с изменением регулирования генома возникают сдвиги в соотношении субъединиц в ЛДГ. Эти возрастные сдвиги также можно объяснить перераспределением активности отдельных генов-регуляторов.
В последние годы установлено, что существуют гены, регулирующие синтез отдельных полипептидов, входящих в состав белков. Вот почему изменение в регуляторных генах при старении может вести к неравномерному изменению синтеза различных полипептидов и соответственно полипептидного состава белка. Отсюда качественные изменения в белковой молекуле, в ее вторичной структуре, изменения ее специфических свойств. Среди белков лучше других изучен гемоглобин. Этот белок обеспечивает транспорт кислорода в организме. Он синтезируется в специальных клетках-предшественниках эритроцитов — эритробластах. Молекула гемоглобина состоит из четырех полипептидных цепей, представленных тремя типами — ?, ? и ?, каждый из которых кодируется отдельным геном. В зависимости от активности этих генов и от синтеза той или иной полипептидной цепи образуются молекулы гемоглобина с различными свойствами.
Гемоглобин взрослого человека состоит из двух ?- и ?-полипептидов (?2, ?2). У эмбрионов человека структура гемоглобина иная. Она состоит из двух ?- и ?-цепей (?2, ?2). Это так называемый фетальный гемоглобин. По своим свойствам он во многом отличается от гемоглобина взрослого человека и обладает большим сродством к кислороду при меньшем содержании О2 в крови. В старости содержание фетального гемоглобина увеличивается. Следовательно, в старости в молекуле гемоглобина чаще сочетаются иные, чем у взрослого человека, полипептидные цепи. Известно, что образование фетального гемоглобина увеличивается при кислородном голодании. Быть может, возникающее при старении кислородное голодание — гипоксия — стимулирует образование фетального гемоглобина. Как бы то ни было, образование его свидетельствует об изменении вторичной структуры молекул гемоглобина, связанном со сдвигами в системе генетической регуляции.
5. Важный молекулярный приспособительный механизм — явление генетической индукции. Смысл ее состоит в том, что, когда в клетке начинают накапливаться те или иные вещества, усиленно синтезируются ферменты их расщепления. Подобный эффект вызывает и ряд гормонов. Этот усиленный синтез ферментов связан с включением регуляторных механизмов, стимулирующих активность определенных генов. Благодаря генетической индукции клетка приспосабливается к условиям существования. При старении сильно изменяется генетическая индукция ферментов. Как видно на рис. 11, рост активности ферментов в ответ на различные дозы гормона в печени взрослых и старых крыс неодинаков.
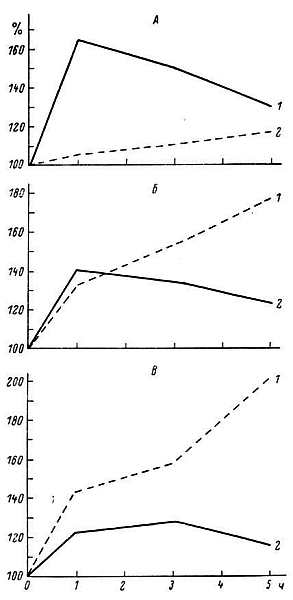
Рис. 11. Возрастные различия в изменении активности тирозинаминотрансферазы в печени в зависимости от дозы гидрокортизона.
1 — взрослые крысы; 2 — старые. За 100 % принят исходный уровень активности фермента. Введение гидрокортизона в дозе: А — 1.0; Б — 3.0; В — 5.0 мг/100 г.
6. Генорегуляторные изменения ограничивают потенциальные возможности белоксинтезирующих систем. Длительная и напряженная функция клетки приводит к усиленному образованию белка и увеличению ее размера — гипертрофии. Гипертрофия клеток приводит и к гипертрофии органа. Примером может служить гипертрофия сердца при пороках его клапанов, при артериальной гипертонии, скелетных мышц у спортсменов, одного из парных органов (почка, надпочечник) при удалении другого. В эксперименте гипертрофию сердца вызывают следующим образом: на аорту животного накладывается кольцо, суживающее в несколько раз ее диаметр. Для того чтобы в этих условиях левый желудочек обеспечивал потребность организма, он должен производить значительно большую работу. Это ведет к гиперфункции, а затем к гипертрофии миокарда. На рис. 12 представлены данные В. Г. Шевчука об особенностях развития гипертрофии сердца у взрослых и старых крыс в одинаковые сроки после наложения кольца на аорту. В этой работе удалось выяснить, что у старых животных гиперфункция сердечной мышцы ведет к слабой активации биосинтеза белка, к менее выраженной гипертрофии. В результате этого у старых животных при длительных повышенных нагрузках значительно чаще, чем у взрослых, развивается сердечная недостаточность.
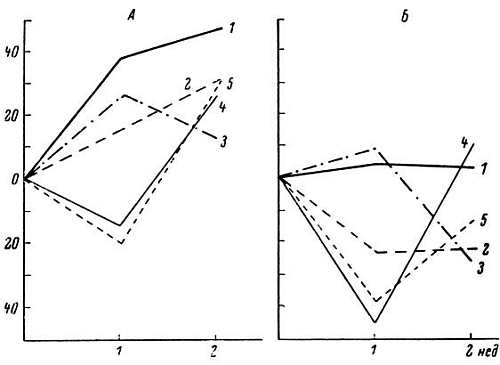
Рис. 12. Особенности развития гипертрофии сердца у взрослых (А) и старых (Б) крыс в разные сроки после сужения аорты.
1 — масса левого желудочка; 2 — содержание нерастворимых белков; 3 — растворимых белков; 4 — сердечный выброс; 5 — содержание креатинфосфатазы
Подобный же результат получен при изучении гиперфункции и гипертрофии почки. У старых животных после удаления одной почки активизация биосинтеза белка увеличение веса оставшейся почки оказались менее выражены, чем у взрослых. После кровопотери активизируется синтез белков крови, и это восполняет возникший дефект. У старых животных восстановление белков крови проходит медленнее.
Таким образом, при старении сокращается диапазон активизации биосинтеза белка в условиях напряженной деятельности клетки, органа. Этот молекулярно-генетический механизм в значительной степени ограничивает приспособительные возможности клеток в старости. Видимо, ограничение активизации биосинтеза белка связано с изменениями в системе регулирования генетического аппарата, в генах-регуляторах. Важное значение имеют и сдвиги в трансляции, в передаче информации от ДНК к рибосомам.
7. Р. И. Салганик провел интересное исследование: длительное введение в организм гормонов сначала вызывает усиленный биосинтез определенных ферментов. Однако в дальнейшем, несмотря на продолжающееся введение гормонов, активность фермента, его содержание и интенсивность биосинтеза молекул начинают падать. Развивается угасание генетической активности, ее истощение, работоспособность гена падает. В нашей лаборатории Х. К. Мурадян изучил развитие этого феномена — ограничения работоспособности гена у животных разного возраста. Животным ежедневно вводился гормон (гидрокортизон), и в разные сроки после начала введения определялась активность группы ферментов в печени. Результаты этой серии (рис. 8) показывают, что у старых крыс угнетение, истощение, подавление работоспособности генов развиваются значительно быстрее.
Биосинтез белка — сложный многозвеньевой процесс — начинается с образования иРНК и заканчивается сборкой готовой белковой молекулы. Специальный анализ показал, что все особенности угасания генетической индукции в проведенных опытах связаны с изменением считывания информации с молекул ДНК, т. е. с процессами транскрипции. Об этом свидетельствует то, что в ходе длительного введения гормона происходит не только снижение новообразования фермента, но и снижение обновления отдельных фракций РНК. В нашей лаборатории было показано, что при длительном введении гидрокортизона у старых животных быстрее развивается снижение синтеза информационной и рибосомальной РНК, подавление процесса транскрипции.
Описанный феномен — ограничение работоспособности гена — может объяснить многие возрастные сдвиги обмена и функции. Он раскрывает важнейший молекулярный механизм сокращения приспособительных возможностей клетки и организма при старении.
8. В каждой клетке "работает" только небольшая часть ее генома. Не исключено, что значительные нарушения регулирования генома в процессе старения могут привести к активизации генов, "молчавших" всю жизнь. Это вызовет появление белка, ранее не синтезировавшегося в клетке. В зависимости от его типа могут возникнуть различные сдвиги в деятельности клетки, вплоть до ее гибели. Некоторые исследователи полагают, что существуют "гены-самоубийцы", активность их на определенном этапе развития вызывает гибель клетки и организма. По мнению американского исследователя В. Денкла, в старости активизируется синтез гормона, подавляющего тканевое дыхание. В клетках находятся молчащие до поры до времени онковирусы, вызывающие раковое перерождение клетки. Изменение генной регуляции способствует их активизации и возникновению рака.
9. При деятельности клеток постоянно изменяется концентрация ионов натрия, калия, кальция внутри клеток. Доказано, что эти ионы оказывают влияние на считывание генетической информации, на сборку белка. Возрастные изменения концентрации ионов могут приводить к сдвигам регуляции генома.
Конкретные генорегуляторные механизмы старения неодинаковы в различных клетках. Известно, что отличие клеток друг от друга, например нервных, мышечных, железистых, и состоит в том, что у них "работают" различные гены, а одни и те же гены функционируют с неодинаковой интенсивностью. Именно это и определяет специфику их белкового состава, обмена и в конце концов функции. Последовательность работы генов связана с регуляцией генетического аппарата. До сих пор современная молекулярная биология при объяснении первичных механизмов старения исходит из принципа "один ген — один белок". Однако есть генетическая информация, недостаточно еще изученная, определяющая общее строение клетки, межклеточные взаимоотношения, количество клеток, форму органа и др. Мы полагаем, что наиболее общие механизмы старения связаны с нарушением этого уровня регуляции генетической информации. Именно этот генетический уровень определяет системность процесса старения и витаукта. Мы назвали его алгоритмическим. Алгоритм — порядок действия, предписание. Именно этим объясняется множественность нарушений при неглубоких изменениях в отдельных звеньях системы. Как известно, стареют и отдельные белковые молекулы. Они проходят как бы жизненный цикл от момента их синтеза до распада. В старости многие из молекул белков становятся менее доступными для ферментативной "атаки", что приводит к появлению более старых белков.
Старение клетки во многом связано с внутриклеточными и внеклеточными механизмами регуляции генетического аппарата. Удачный метод — реконструирование клеток, воздействие молодой цитоплазмы на старые ядра, и наоборот. Наши опыты показали, что цитоплазма клеток печени старых крыс несколько подавляет синтез РНК в ядрах молодых животных, а цитоплазма молодых животных несколько активизировала синтез в ядрах старых клеток печени. Очень интересны опыты, в которых ядра старых эпителиальных клеток хрусталика помещались в яйцеклетки лягушки того же вида. В результате возникали зародыши, из которых вырастали нормальные лягушки. Все эти опыты доказывают: во-первых, механизмы старения клеток связаны как с изменением в ядре клетки, так и в цитоплазме; во-вторых, возрастные изменения в ядре клетки не являются во всех случаях необратимыми, а в определенных ситуациях клетка как бы "омолаживается".
Как-то принято биосинтез белка называть пластическим обменом, подчеркивая его роль в воссоздании структур, блоков клетки. Нам хотелось бы подчеркнуть, что в ходе этого процесса могут синтезироваться и вещества, регулирующие внутриклеточный обмен. Иными словами, синтез белков обеспечивает не только целостность клетки, но и ее регуляцию. И если циклические нуклеотиды, ионы кальция и др. называют месенджерами, т. е. посредниками в реализации внеклеточных влияний на клетку, то регуляторные вещества, образующиеся в процессе синтеза белка, можно назвать инверторами. Они приспосабливают обмен веществ и функцию клетки к условиям реализации генетической информации, изменившегося биосинтеза белка. Примером этого может быть образование при активации биосинтеза белка фактора, гиперполяризующего клеточную мембрану. Месенджеры и инверторы определяют прямые и обратные связи в системе саморегуляции клетки. Нарушение их синтеза — важный механизм старения.
Генетический аппарат клеток находится под сложным гормональным контролем. Он настолько существен, что может изменять генорегуляторные механизмы. При старении изменяется функция желез внутренней секреции, концентрация гормонов в крови, и это приводит к сдвигам в работе генетического аппарата. Железы внутренней секреции сами по себе контролируются структурой мозга — гипоталамусом. В нашей лаборатории показано, что при раздражении гипоталамуса меняется концентрация гормонов, наступают сдвиги в синтезе белка. Благодаря гипоталамусу осуществляются многие приспособительные реакции организма, протекающие с участием белоксинтезирующей системы. Оказалось, что при старении изменяются эти регуляторные влияния, они вызывают иные, чем у взрослых животных, сдвиги. В старости ослабляется гипоталамический контроль над деятельностью генетического аппарата клеток. Это приводит к ограничению возможностей белоксинтезирующих систем в осуществлении общих приспособительных реакций организма. Возникает ситуация, когда периферия еще могла бы, однако центры уже не могут использовать эту возможность.
Наши представления о сущности регулирования генетического аппарата могут в будущем измениться. Может измениться и представление о взаимоотношениях генов-регуляторов, генов-операторов и т. д. В системе регулирования генома будут открыты новые звенья. Все это не изменит положение о принципиальной роли процессов регулирования в реализации генетической информации и принесет новые подтверждения первичности генетических изменений в генезисе старения.
| <<< Назад Глава 3. Механизмы старения и витаукта |
Вперед >>> Энергетические процессы |
- Генорегуляторная гипотеза
- Энергетические процессы
- Последовательность старения клеток
- Структура клетки
- Функция клетки
- Мембранно-геномные механизмы
- От нейрона до мозга
- Вегетативная нервная система
- Нейронный транспорт веществ
- Нейрогормональный контроль
- Местные механизмы регуляции
- Реакции объектов регуляции
- Обратные связи
- Старение и болезни
- Глава 8. Неадаптивная нулевая гипотеза эволюции генома и истоки биологической сложности
- Гипотеза Большого взрыва.
- Миф № 38 Человек появился не в Африке! Африканская гипотеза навязана нам политкорректными учеными, чтобы мы не любили св...
- 163. Чем доказывается гипотеза расширения океанского дна?
- 164. Как гипотеза расширения морского дна подтверждает гипотезу дрейфа материков?
- Гипотеза размножения вселенных Ли Смолина
- Что такое гипотеза «Большого взрыва»?
- Гипотеза «дино сапиенса»
- Наиболее вероятная гипотеза
- Гипотеза автора
- 3. Водородная гипотеза
- 21. Комментарий к космологическим гипотезам
