Книга: Биохимия старения
Теория генной регуляции
| <<< Назад Теория ограничения кодона |
Вперед >>> Резюме |
Теория генной регуляции
Все эукариоты обладают двумя характерными особенностями: 1) их способность адаптироваться в естественных условиях постепенно снижается после достижения половой зрелости, 2) все представители вида имеют более или менее постоянную, продолжительность жизни (табл. 1.1). Более того, установлена корреляция между длительностью развития и долголетием. Старение нельзя рассматривать как изолированную и независимую фазу жизни; его следует оценивать в совокупности с периодом развития и репродуктивным периодом, так как эти два периода влияют не только на, продолжительность жизни, но и на скорость, длительность и характер процесса старения. В этой связи уместно разобраться в следующих вопросах.
1. Имеется ряд данных, указывающих на то, что раннее, развитие есть результат последовательной активации и репрессии специфических генов.
а) Если обработать личинку Chironomus экдизоном, гормоном линьки, то гены, локализованные в различных хромосомах их слюнных желез, последовательно активируются, что заметно по образованию пуффов [18].
б) Различные цепи гемоглобина, синтез которых контролируется разными генами, при внутриутробном развитии человека образуются последовательно [134]. Гемоглобин 1-2-месячного плода представляет собой молекулы ?2?2. Затем появляется гемоглобин ?2?2, основной гемоглобин плода (foetal, HbF). Гемоглобин взрослых HbA, ?2?2, появляется сразу после рождения. Гены ?-, ?-, ?- и ?-цепей активируются последовательно один за другим, но ген ?-цепи остается активным с первого месяца внутриутробного развития до конца жизни. Кроме того, когда активируется ген ?-цепи, ген ?-цепи репрессируется, а, репрессия гена ?-цепи совпадает с активацией гена ?-цепи во, время рождения. Другой факт, на который следует указать, состоит в том, что эти гены остаются активными в течение разных промежутков времени: ? — в течение ~2 мес, ? — в течение ~8 мес и ? — всю Жизнь начиная с рождения. Факторы, ответственные за последовательное включение этих генов, неизвестны. Предполагают, что важную роль в этом процессе; играет уровень кислорода, поступающего к плоду в матке.
в) В период раннего развития морского ежа Lutechinus гистон Н1 одного типа (H1m) вырабатывается на стадии. морулы. Затем на стадии гаструлы образуется гистон другого типа, Hlg [4, 107]. Набор белков в тканях личинки Drosophila melanogaster меняется по мере ее развития [5]. Это указывает на последовательное изменение активности соответствующих генов. Все ткани личинки имеют некоторые общие белки, но каждая немногими белками все же отличается от другой.
г) Изоферменты лактатдегидрогеназы не только тканеспецифичны, они изменяются также во время развития [77, 78]. Было обнаружено [62, 115], что доля лактатдегидрогеназы М4 в сердце, головном мозгу и скелетной мышце старых (96 нед) крыс значительно снижена. Поскольку две субъединицы лактатдегидрогеназы, Н и М, кодируются разными генами, полученные данные говорят о том, что в старом возрасте ген для субъединицы М почему-то репрессируется. Аланинаминотрансфераза представляет собой димер, состоящий из субъединиц двух типов, А и В. Исследования аланинаминотрансферазы печени крыс показали, что ген А активен в раннем периоде жизни. При старении крыс ген А репрессируется, а ген В активируется, так что в старческом возрасте (100 нед) димерный фермент образуют только субъединицы В [60, 93]. Для глюкозофосфатизомеразы и алкогольдегидрогеназы дрозофилы с возрастом также наблюдается постепенное изменение изоферментных спектров (гл. 3). Полученные результаты указывают на то, что последовательная активация и репрессия генов происходит не только в период развития, но и на протяжении всей жизни.
2. В ряде работ было показано, что возрастные изменения ферментов обратимы, с возрастом активность одних ферментов снижается, других — повышается. Некоторые ферменты не подвержены возрастным изменениям (гл. 3). Уровни определенных ферментов, которые снижаются в пожилом возрасте, можно повысить введением стероидных гормонов, например холин-ацетилтрансферазы и ацетилхолинэстеразы головного мозга [54], пируваткиназы ткани сердца [15], тирозинаминотрансферазы [97] и аланинаминотрансферазы печени [92] крыс. Лаг-фаза индукции некоторых ферментов гормонами с возрастом увеличивается [1]. Это отражает уменьшение числа рецепторов или их сродства к гормонам [61]. Вместе с тем изменения в хроматине могут привести к ослаблению его связывания с комплексом гормон — рецептор, следствием чего будет ухудшение ответа на гормоны. В общем, однако, содержание некоторых ферментов можно изменить введением стероидных гормонов in vivo. Поскольку действие этих гормонов опосредовано экспрессией генов, результаты этих работ показывают, что те изменения, которые связаны с перестройкой функции генома, являются обратимыми.
3. а) Для того чтобы выяснить, изменяется ли с возрастом первичная структура белков, были изучены некоторые ферменты у молодых и старых животных. Замещение любой аминокислоты в белке указывало бы на изменение кодона соответствующего гена или на появление ошибок во время транскрипции/трансляции. Кинетические и иммунологические исследования малатдегидрогеназы [59], аргиназы [96], ацетилхолинэстеразы [84] и цитоплазматической аланинаминотрансферазы [93], выполненные Канунго и сотр., показали, что первичная структура этих ферментов у старых крыс, по-видимому, такая же, как у молодых. Сривастава [117] провел триптическое картирование актина и миозина скелетных мышц молодых, взрослых и старых крыс и никаких различий не обнаружил.
б) Работы Гершона и его сотрудников [30, 98, 99, 133] и Ротстайна и его сотрудников [106, 111] показали, что величины Км, Ki, электрофоретическая подвижность и положение при изоэлектрофокусировании различных ферментов нематоды Turbatrix aceti и крыс с возрастом не меняются. Снижение удельной активности и увеличение термолабильности ферментов в старом возрасте, по-видимому, обусловлено незначительными посттрансляционными изменениями боковых групп аминокислот, но не замещениями аминокислот. Хотя определение первичной структуры белков молодых и старых животных является лучшим способом для выяснения, остаются ли последовательности аминокислот специфических белков одинаковыми в течение всей жизни, этот способ вызывает некоторые возражения. Поскольку очистка любого фермента включает этапы, на которых происходит разделение молекул белка по ряду свойств, может происходить элиминация любого измененного белка. Поэтому обычно выделяют только те белки, которые имеют одинаковую первичную структуру. Однако современный уровень знаний позволяет утверждать, что первичная структура белков и, следовательно, последовательность нуклеотидов в соответствующих генах с возрастом не меняются.
Почему же тогда изменяется с возрастом содержание ферментов, кодируемых специфическими генами? Эти изменения, ответственные за перестройку различных функций, отмечаются на протяжении всей жизни. Если структура генов не зависит от возраста, то содержание ферментов может изменяться в результате функционирования или экспрессии генов, трансляции или обмена ферментов. Транскрипция и период экспрессии генов — наиболее ранние стадии синтеза белка, нарушение которых может быть причиной изменения уровня ферментов. Гены образуют комплексы с белками двух видов, гистонами и негистоновыми хромосомными белками (НГБ), которые могут влиять на их экспрессию. Гистоны — это основные, неспецифические белки, обладающие общим репрессивным действием на функцию гена. Они подвержены различным модификациям типа фосфорилирования, ацетилирования, метилирования и ADPрибозилирования которые в разной степени влияют на их ассоциацию с ДНК. Кроме того, степень подобных модификаций снижается не только с возрастом, но и после транскрипции [64–66].
НГБ гетерогенны и участвуют в тонкой регуляции экспрессии генов. Они также подвергаются ковалентным изменениями которые модулируются эффекторами типа эстрадиола и кальция [64]. НГБ принимают участие в транскрипции (гл. 2).
Ковалентные изменения хромосомных белков и их модуляция эндогенными эффекторами могут быть главной причиной, изменения экспрессии гена; они индуцируются в различные периоды жизни, вызывая изменения уровней продуктов генов, в. том числе ферментов, и побочных продуктов, таких, как гормоны и метаболиты (гл. 2). Последовательные появления и исчезновения белков во время дифференцировки проста являются показателем подобных изменений экспрессии гена. Как предположили Каплан и Ордал [12], на самой ранней стадий развития экспрессируется большинство генов, а по завершении развития все большее число генов становится необратимо репрессированным, что приводит к появлению клеток различных типов. Полагают, что это происходит под действием внутри- и межклеточных модуляторов. Бенкс и Мехеффи [7] предположили, что за дифференцировку ответственна сходная цикличная репрессия генов. В обоих случаях уровни модуляторов являются критическими для репрессии некоторых генов в одних, но не в других клетках. Так образуются дифференцированные клетку.
Возникает вопрос, каким образом после прохождения стадии дифференцировки и по достижении организмом способности к воспроизведению изменяется функциональное состояние генома, что приводит к снижению репродуктивной активности и началу старения. В 1970 г. Канунго [56] предложил генно-регуляторную теорию и в 1975 г. он [57] разработал ее в виде модели, которая объясняет два характерных признака старения: а) снижение функциональной активности и б) фиксированную продолжительность жизни представителей одного вида.
Нарушение функций после достижения половой зрелости
В соответствии с моделью старение [57, 58] может развиваться в результате изменения экспрессии генов после достижения половой зрелости. Как видно из схемы (рис. 9.6), дифференцировка и рост сопровождаются последовательной активацией и репрессией определенных уникальных генов, функционирующих только в этих фазах. Основные и побочные продукты генов, ответственные за дифференцировку и рост, достигают критического содержания и стимулируют другие уникальные гены, продукты которых, например половые стероидные гормоны, обусловливают переход к репродуктивному периоду. Репродуктивная способность жизненно необходима для сохранения и эволюции вида. Некоторые генные продукты, образующиеся в репродуктивной фазе, в свою очередь подавляют функцию генов роста и дифференцировки, в связи с чем дальнейший рост организма прекращается у большинства животных после короткого периода размножения. Вопрос состоит в том, почему репродуктивный период не продолжается беспредельно.
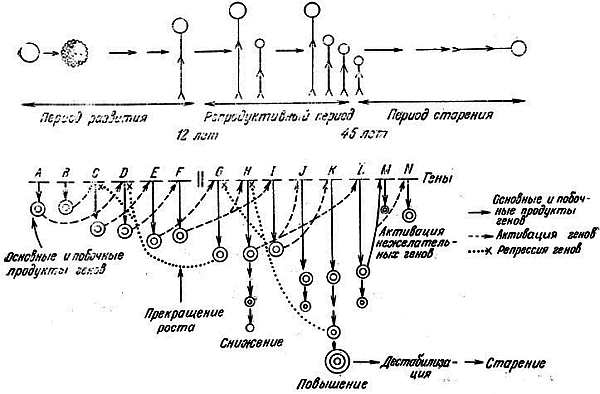
Рис. 9.6. Модель старения с некоторыми изменениями по Канунго [57]. Верхняя часть — условное изображение различных периодов жизни: развития, репродуктивного периода и старения. Нижняя часть — схема последовательной активации и репрессии генов; для большей ясности Число активных генов на рисунке сведено к минимуму, а постоянно репрессированные гены вообще не показаны. Период развития и репродуктивный период зависят от уникальных генов А-F и G-L соответственно. Согласно этой модели, никаких специфических генов старения не существует. Развитие начинается в результате последовательной активации генов А-F, продукт гена. А включает ген В и т. д. Некоторые гены поздней фазы развития Е и F включают уникальные гены G и H, функционирующие в раннем репродуктивном периоде. Эти гены в свою очередь последовательно включают другие гены репродуктивного периода. Организм достигает половой зрелости, когда образуется необходимое количество генных продуктов. При непрерывном размножении может происходить потеря определенных факторов, необходимых для сохранения активности некоторых важных генов. Выключение этих генов может привести к нарушению определенных функций. При непрерывном размножении могут также накапливаться выше критического уровня другие продукты (факторы), в результате чего будут активироваться нежелательные гены М и N, продукты которых могут быть причиной аутоиммунных заболеваний. Таким образом, снижение физиологических функций, наблюдаемое после некоторого периода размножения, может зависеть от дестабилизации работы генов в репродуктивном периоде
Репродуктивная способность организма наиболее высока вскоре после достижения половой зрелости. Однако при репродукции определенные факторы могут утрачиваться и, будучи утраченными, уже не возмещаются. А между тем эти факторы могут быть исключительно важны для поддержания определенных генов в состоянии экспрессии или репрессии, тогда как другие факторы в процессе репродукции могут накапливаться, что не только влияет на экспрессию определенных генов, но может приводить к активации некоторых нежелательных генов, например генов вирусов, которые обычно остаются репрессированными. В результате всех этих событий может произойти дестабилизация тех уникальных генов, от функционирования которых зависит репродуктивная способность. Иными словами, в репродуктивном периоде нарушается гомеостатический контроль. Происходит постепенное снижение плодовитости, что отчетливо регистрируется вскоре после достижения половой зрелости.
В соответствии с этой моделью, если организм обладает механизмом, при помощи которого он способен возместить утрату факторов, вызываемую длительной репродукцией, или предотвратить накопление нежелательных факторов выше критического уровня, его репродуктивный период и продолжительность жизни будут длиннее. И действительно, данные по продолжительности жизни млекопитающих указывают на существование такого механизма, так как у них в процессе эволюции происходило постепенное увеличение продолжительности жизни, особенно репродуктивного периода [23]. Причиной этого явления могли быть мутации генов, ответственных за данный период, которые, вероятно, в процессе эволюции подверглись отбору. Уменьшение репродуктивной способности и других функциональных показателей организма является следствием незавершенности этого процесса. Однако ограниченность репродуктивного периода косвенно благоприятствует видам, так как быстрая смена поколений способствует эволюции. Таким образом, короткий репродуктивный период и ограниченная продолжительность жизни были благотворными для видообразования.
Здесь уместно привести последние данные о влиянии одного гормона на функцию другого. Ниссенсон и др. [85] обнаружили, что 17?-эстрадиол повышает уровень рецепторов окситоцина в матке кролика и, таким образом, усиливает ее сократимость в ответ на окситоцин. Вместе с тем прогестерон снижает уровень окситоциновых рецепторов, а также сократимость матки. В старом возрасте содержание одних стероидных гормонов снижается, а некоторых других — не меняется (гл. 5). Происходящие сдвиги могут быть следствием размножения. Дисбаланс содержания гормонов и других эффекторов, вызванный репродукцией, а также такими факторами, как температура, питание и стресс, может привести к дестабилизации экспрессии генов, необходимых для размножения.
Репродуктивный период уникален в том отношении, что в этом периоде вырабатывается несколько единственных в своем роде факторов, например гормоны. Присутствие какого-либо гормона, необходимого для экспрессии одного или немногих генов, в очень высокой концентрации может оказать обратное действие на экспрессию тех генов, которые зависят от других гормонов. Таким образом, незначительные изменения содержания гормонов и других метаболитов-эффекторов могут дестабилизировать гомеостатический контроль в репродуктивном периоде. Сходные результаты наблюдаются даже в. том случае, если животные по каким-либо причинам не способны к размножению. Обоюдное влияние одного гормона на другой может возникнуть после достижения их максимальных концентраций в период половой зрелости, что приведет к дестабилизации генов. Таким образом, изменения содержания гормонов и других модуляторов, прямо или косвенно влияющих на функцию генома, могут привести к постепенному снижению репродуктивной активности и к старению. Для изменений содержания модуляторов характерен не аддитивный, а скорее синергичный эффект, что может быть причиной экспоненциального снижения функциональных показателей организма при старении. Так, общая скорость нарушения функций у человека между 70 и 80 годами много выше, чем между 60 и 70 годами.
Определение продолжительности жизни
Продолжительность жизни видов можно приблизительно, разделить на три периода: развитие, репродуктивный период (размножение) и старение. Каждый период имеет характерную протяженность, скорость и регуляторные механизмы. Начало, скорость и продолжительность периодов развития и размножения зависят от уникальных наборов генов, которые последовательно активируются и репрессируются. Продолжительность этих периодов изменяется в определенных пределах и на нее влияют как эндогенные, так и экзогенные факторы: питание, стресс и температура. От этого зависит изменчивость продолжительности всей жизни и ее отдельных периодов у особей данного вида.
Вариабельность продолжительности периодов жизни, наблюдаемая, например, у млекопитающих, зависит от времени, требующегося для активации или репрессии необходимых генов. Количество ДНК и число генов, активирующихся в каждом периоде жизни, у различных видов млекопитающих могут различаться очень мало. Продолжительность жизни человека примерно в 50 раз превышает продолжительность жизни землеройки, но по количеству ДНК эти виды отличаются друг от друга незначительно. Время, необходимое для активации и репрессии генов, и содержание эффекторов, участвующих в этих процессах, могут детерминировать не только длительность, но и скорость прохождения каждого периода.
Новые виды, которые эволюционируют из предшествующих, могут обладать более коротким или более длинным по сравнению с последними сроком жизни. Это обусловлено генетическими изменениями: делецией, транслокацией, дупликацией, перестройкой и мутацией одного или нескольких генов в одном или нескольких периодах жизни. В результате меняется реактивность генов по отношению к эффекторам и укорачивается или удлиняется, один или несколько периодов жизни, т. е. изменяется, общая ее продолжительность. Например, если ген D (рис. 9.6) изменится так, что потребуется больше времени для его активации под влиянием продукта предыдущего гена, из-за чего побочный продукт последнего также будет производиться дополнительно, то будет наблюдаться удлинение фазы роста начиная с этого периода. Вместе с тем ген D может измениться таким образом, что содержание его продукта достигнет порогового уровня раньше и раньше активирует следующий ген последовательности. Такая перестройка приведет к сокращению данного периода и общей продолжительней жизни. Аналогичные изменения гена J в репродуктивном периоде могут удлинить этот период и следовательно, повлиять на продолжительность жизни. Такие изменения одного или нескольких генов в периоде репродукции у короткоживущих млекопитающих, которые быстро достигают половой зрелости, могли повлечь за собой постепенное удлинение этого периода и вызвать развитие долгоживущих млекопитающих. Если активация гена J ускорится, то за этим последует сокращение репродуктивного периода. Такие генетические изменения, которые способствуют созреванию организма в подходящее время, создают селективные преимущества. Генетические сдвиги, которые приводят к созреванию в неподходящее время, действуют против отбора. Первые будут способствовать лучшему выживанию и развитию особей, они будут отобраны и помогут сохранению вида. Такие изменения функции генов могли играть большую роль в процессе отбора, что существенно для эволюции.
Ускорение или замедление последовательных процессов активации и репрессии генов может начаться в любой точке данной последовательности функционирования генов для каждого периода и зависит от того, где именно происходит изменение одного или нескольких генов. Поэтому периоды жизни формируются каждый раз, когда возникают новые виды. Это может приводить к укорочению или удлинению жизни новых видов по сравнению с их предками и определять различия в продолжительности жизни родственных видов млекопитающих (табл. 1.1). Другие механизмы, которые изменяют продолжительность и скорость протекания каждого периода, могут быть связаны со временем, необходимым для процессинга гяРНК в мРНК в ядре и для трансляции мРНК.
Подтверждение модели
В соответствии с рассматриваемой моделью (рис. 9.6) изменения в генах, происходящие в определенное время данного периода, могут повлиять не только на длительность и скорость протекания данного периода, но и на общую продолжительность жизни. Основные положения этой модели подтверждаются симптомами наследственных болезней человека — прогерии и синдрома Вернера. Причиной прогерии является мутация аутосомного гена. В этом случае, даже если новорожденный ребенок кажется нормальным и нормально растет, примерно в 6-летнем возрасте у него обнаруживаются признаки старения, а в 8 лет появляются такие старческие симптомы, как атеросклероз, накопление липофусцина, поседение волос и пр., т. е. ребенок выглядит как преждевременно состарившийся человек. Кроме того, фибробласты, полученные от 9-летних больных прогерией, претерпевают меньшее число удвоений популяций, чем фибробласты здорового 9-летнего ребенка. Очевидно, такое состояние вызвано изменениями в одном или нескольких генах, необходимых, согласно модели, для развития организма. Мутация в этих генах, возможно, препятствует синтезу важного фактора (факторов), который необходим для дальнейшего развития и роста ребенка. Отсутствует инициация перехода в репродуктивный период, так как это событие зависит от включения нескольких уникальных генов, осуществляемого факторами, которые продуцируются в относительно поздней стадии развития, а эти факторы у больных прогерией не образуются. Следовательно, рост не завершается, сокращается период развития и полового созревания не происходит. С момента экспрессии мутантных генов продолжительность жизни сокращается. Не исключено, что продукты мутантных генов включают функционирование каких-то нежелательных генов. Было бы важно выяснить, продуцируются ли при этом половые гормоны и в каком количестве. Подобно прогерии, синдром Вернера также является наследственным заболеванием, которое вызывается мутацией аутосомного гена. У больных с синдромом Вернера развитие по длительности и характеру протекает более или менее нормально. По-видимому, мутации происходят в одном или нескольких генах, ответственных за инициацию и поддержание половой функции в репродуктивном периоде. В этом случае сокращается репродуктивный период, а следовательно, и продолжительность жизни. Исследование большого числа мутаций у человека и животных, которые изменяют длительность развития и репродуктивного периода, могло бы внести ясность в этот вопрос.
Другим подходящим примером является феномен "внезапной смерти", наблюдаемый у самки осьминога [130]. Самки осьминога Octopus hummelincki откладывают яйца только один раз; высиживая их, они отказываются от пищи и погибают вскоре после вылупления молодых особей. Если после кладки у животного удаляют обе глазные железы, оно не высиживает яйца, продолжает питаться и расти и долго живет. Очевидно, в глазной железе вырабатываются определенные факторы, ответственные за высиживание и прекращение приема пищи, из-за чего наступает старость и смерть. Удаление железы или этих факторов предохраняет животное от ранней гибели. По-видимому, в процессе кладки яиц может истощиться запас каких-то веществ, способных стимулировать зрительные железы к образованию гормонов, изменяющих поведение. Было бы важно установить, сохранит ли жизнеспособность и будет ли расти самка осьминога, если ее подвергнуть стерилизации. Сходное явление наблюдается у лосося и некоторых насекомых.
| <<< Назад Теория ограничения кодона |
Вперед >>> Резюме |
- Изменения регуляции генов
- Принципы гормональной регуляции
- Единство нервной и гуморальной регуляции
- 6. Тепловой шок — модель для изучения регуляции на многих уровнях
- Глава 3. Общие правила регуляции
- Нарушение законов регуляции
- Надежность механизмов саморегуляции
- Реакции объектов регуляции
- 6.2. Роль различных отделов цнс в регуляции лозно-тонических реакций
- 6.3. Роль различных отделов цнс в регуляции движений
- 3.5. Особенности терморегуляции, обмена веществ и энергии
- 2.5. Особенности терморегуляции, процессов выделения и деятельности желез внутренней секреции
