Книга: Биохимия старения
Теория соматических мутации
| <<< Назад Введение |
Вперед >>> Теория ошибок |
Теория соматических мутации
Росс и Скотт [104] первыми сообщили, что крысы, подвергнутые тотальному облучению, слишком слабому, чтобы вызвать какие-либо острые изменения, погибают раньше, чем необлученные контрольные животные. Затем последовали сообщения о том, что у облученных грызунов [26, 44, 108] и людей [128] симптомы старения, и смертность были такими же, как у интактных особей; было отмечено, однако, что частота опухолей у первых была выше. Поэтому предположили, что облучение вызывает ускорение процесса старения. Основываясь на этих данных, Сцилард [122, 123] предложил для объяснения старения "теорию соматических мутаций", согласна которой мутации, возникающие беспорядочно и самопроизвольно, разрушают гены и хромосомы постмитотических клеток в течение жизни организма, постоянно повышая мутационный груз. При увеличении числа мутаций и потере функциональных генов наблюдается снижение синтеза функциональных белков. Смерть клетки наступает тогда, когда мутационный груз превышает критический уровень. В результате число постмитотических клеток уменьшается, а общая функциональная активность организма снижается.
Эта теория была проверена в опытах с мышами Стивенсоном совместно с Кёртисом [118] и Кёртисом [20, 21]. Мышей облучали дозой 400 рад или им вводили химические мутагены типа азотистых аналогов иприта (0,125 мг) и затем определяли их выживание. В регенерирующей печени молодых и старых мышей исследовали также частоту хромосомных аберраций типа нерасхождения сестринских хроматид в митозе и хромосомных разрывов. У мышей из линий с различной продолжительностью жизни вызывали частичный некроз печени введением четыреххлористого углерода и подсчитывали число хромосомных аберраций после фиксации в метафазе под действием колхицина.
Было показано, что а) сокращение жизни после рентгеновского облучения зависит от дозы, б) в регенерирующих клетках печени облученных мышей повышена частота хромосомных аберраций (рис. 9.1), в) азотистые аналоги иприта не оказывают влияния ни на продолжительность жизни, ни на частоту хромосомных аберраций, г) в клетках печени короткоживущих мышей линии A/HEJ (395 дней) накапливается больше хромосомных аберраций, чем у долгоживущих мышей линии C57BL/6J (600 дней; рис. 9.2) [19]. Кёртис [20] далее предположил, что проникающая радиация повреждает постмитотические клетки больше, чем премитотические. В первых мутационные эффекты аккумулируются и клетка не может устранить их, так как она не делится. Во втором случае поврежденная клетка элиминируется и замещается неповрежденной клеткой. Клетки зародышевого пути более устойчивы к повреждению хромосом, благодаря чему возможно сохранение вида.
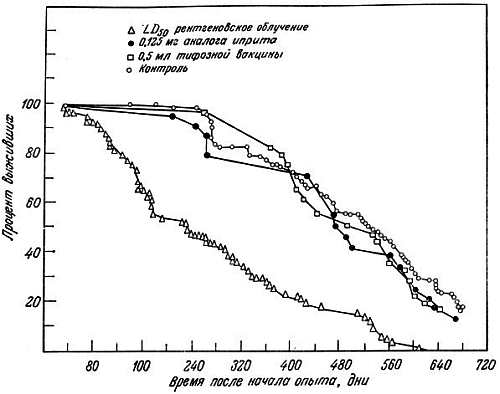
Рис. 9.1. Кривые выживания мышей после различных воздействий, начиная с 2-месячного возраста [20]. Кривые начинаются через 30 дней после воздействия — срока, достаточного для того, чтобы не учитывать внезапную гибель. Они показывают, что однократные массивные, но не смертельные дозы ядовитых химических веществ не уменьшают продолжительности жизни, тогда как единичные массивные, но не смертельные дозы рентгеновского облучения дают заметный эффект
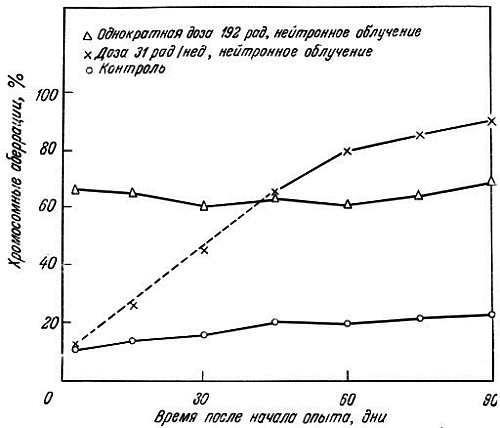
Рис. 9.2. Сравнение эффекта нейтронного облучения на число хромосомных аберраций в клетках печени мышей и их возрастных изменений [22]. При однократном облучении дозой 192 рад аберрации наблюдаются в среднем) в 56 % клеток (треугольники)
Кларк и Рубин [17] изучили действие рентгеновского излучения на продолжительность жизни бабочки Habrobracon, у которой самки диплоидны, а самцы либо диплоидны, либо гаплоидны. Интактные самцы, как диплоидные, так и гаплоидные, имеют одинаковую продолжительность жизни. Однако гаплоидные особи более чувствительны к проникающей радиации, чем диплоидные. Это показывает, что соматическая мутация не может быть причиной старения; если бы это было так, то диплоидные особи имели бы большую продолжительность жизни, а диплоидные самцы и самки имели бы одинаковую продолжительность жизни. Диплоидные самцы более устойчивы к радиации. Это говорит о том, что повреждение, вызываемое облучением, восстанавливается более эффективно, если число хромосом больше, и что процесс восстановления не зависит от пола. Итак, снижение продолжительности жизни, вызванное радиацией, отличается от естественного старения. Здесь уместно процитировать Хендлера [42]: "Представление о том, что облучение приводит к преждевременному старению, верно наполовину и в широком смысле отражает нечеткость исходного параметра — продолжительности жизни".
Аналогичные наблюдения были проведены Томпсоном и Холлидеем [125] на уровне клеток in vitro. Когда фибробласты легких эмбриона человека (штамм MRC-5) обрабатывают колхицином в течение 3–6 ч, выживающая популяция содержит около 60 % тетраплоидных клеток, которые продолжают делиться. Продолжительность их жизни не отличается от продолжительности жизни диплоидных клеток. Сопоставима и скорость их роста. Если бы причиной смерти клеток было накопление мутаций или генетические дефекты, то тетраплоидные клетки должны были бы обладать большей устойчивостью и имели бы большую продолжительность жизни. Но это не так. Хён и др. [46] также наблюдали, что диплоидные фибробласты кожи человека имеют ту же продолжительность жизни, что и тетраплоидные. Если мутации и вносят свой вклад в процессе старения клеток в культуре, они не проявляют себя, в период активного роста (фаза II) и потому должны быть рецессивными. Возможно, что происходит постепенное увеличение генетического груза рецессивных дефектов, что может в итоге привести к инактивации одного или нескольких необходимых генов обеих гомологичных хромосом. Если это так, то тетраплоидные клетки могли бы противостоять большим повреждениям и имели бы большую жизнеспособность. Если мутации вредны, они вызывают гибель клеток и не аккумулируются. Диплоидные и тетраплоидные клетки, имели бы сходную продолжительность жизни только в том случае, если бы вредные мутации возникали в конце жизни.
Здесь уместно обсудить действие ионизирующей радиации на сперматогонии и виды животных с различной продолжительностью жизни. Сайнекс [114] сообщил, что приблизительная доза LD50 для сперматогониев, человека, мыши и дрозофилы составляет соответственно 50, 450, 500 и 6400 Р. Эти данные противоречат теории соматических мутаций, согласно которой клетки зародышевого пути устойчивы к мутациям, вызываемым ионизирующим излучением. Кроме того, в соответствии с этой теорией долгоживущие виды должны быть более устойчивыми к радиации, тем не менее человек, продолжительность жизни которого соответственно в 50 и 1200 раз больше, чем у мыши и дрозофилы, более чувствителен к радиации.
Уменьшение продолжительности жизни под влиянием облучения наблюдали у мыши [13, 14, 72], человека [110] и дрозофилы [3, 28, 69, 83]. Популяция дрозофилы, подвергнутая облучению дозой около 4500 рад, фактически живет дольше, чем контрольная [119]. Такой же результат получен на безмикробных мышах [127]. Симптомы, появляющиеся у облученных особей со сниженной продолжительностью жизни, отличаются от тех, которые возникают во время естественного старения без облучения. Следовательно, проникающая радиация не ускоряет процесс естественного старения, но вызывает раннюю смерть из-за повышения частоты рака или других болезней. Таким образом, укорочение жизни, вызванное ионизирующей радиацией, может представлять собой неспецифический эффект и быть следствием "радиационного синдрома", который не связан с естественным старением.
Главная трудность в оценке теории соматических мутаций состоит в отсутствии объективных способов измерения скорости накопления этих мутаций в постмитотических клетках. Единственный испробованный путь заключается в оценке смертности, которая может быть вызвана многими факторами. Кроме того, непонятно, почему клетки зародышевого пути более устойчивы к проникающей радиации. Увеличение продолжительности жизни у дрозофилы [119] и мыши [127] после воздействия излучения может быть побочным эффектом, хотя при больших дозах влияние излучения на смертность очевидно. Итак, накопление соматических мутаций не может быть причиной старения.
Следует рассмотреть другой тип изменений в хроматине, а именно повреждение структуры ДНК. Прайс и др. [94] изучали in vitro включение 3Н-тимидина в ДНК головного мозга, печени и сердца мышей различных возрастов при помощи радиоавтографии с использованием ДНК-полимеразы тимуса теленка. Более интенсивное включение наблюдали у старых мышей, что указывает на большую матричную активность ДНК. Авторы предположили, что это может быть вызвано появлением одноцепочных разрывов в ДНК, для ликвидации которых требуется дополнительный репаративный синтез. Кроме того, может иметь место утрата ферментов репарации, и тогда разрывы не восстанавливаются. Это согласуется с результатами Семиса и др. [109], которые обнаружили повышенное включение 3Н-тимидина в ДНК старых мышей. Наличие таких разрывов или повреждений ДНК в пожилом возрасте подтверждается сходными данными по чувствительности ДНК к нуклеазе S1, которая расщепляет одноцепочечные области. Четзанга и др. [16] показали, что ДНК печени старых 20-месячных мышей более чувствительна к нуклеазе S1, чем ДНК молодых (1-15 мес) мышей. Кроме того, было обнаружено, что в градиенте щелочной сахарозы ДНК головного мозга старых мышей осаждается полидисперсно в виде 4 зон, тогда как у молодых мышей осаждение монодисперсное — в виде одной зоны. Под действием нуклеазы S1 ДНК старых мышей распадается на большее число фракций с малой молекулярной массой. Предположение о деградации ДНК при старении строится также на основании данных о снижении транскрипции РНК хроматина печени в присутствии РНК-полимеразы [45].
Интенсивность внепланового репаративного синтеза ДНК в фибробластах после ультрафиолетового облучения была изучена Хартом и Сетлоу [43]. В фибробластах долгоживущих млекопитающих повреждения восстанавливались с большей скоростью, чем в фибробластах короткоживущих. Установлена линейная связь между логарифмом продолжительности жизни видов и интенсивностью включения 3Н-тимидина в их ДНК, т. е. большая продолжительность жизни может быть обусловлена более эффективной репарацией ДНК (рис. 9.3) [43]. Литтл [74] также сообщил, что репаративная способность ДНК снижена на поздних пассажах культивируемых фибробластов. Эти исследования, однако, не объясняют, почему репаративная активность ДНК снижается в пожилом возрасте или почему она больше у долгоживущих видов. Если это вызвано снижением уровня ферментов репарации, то необходимо знать причину этого снижения. Итак, имеется достаточно доказательств для утверждения, что старение не вызывается соматическими мутациями, возникающими в результате действия проникающей радиации и других экзогенных факторов.
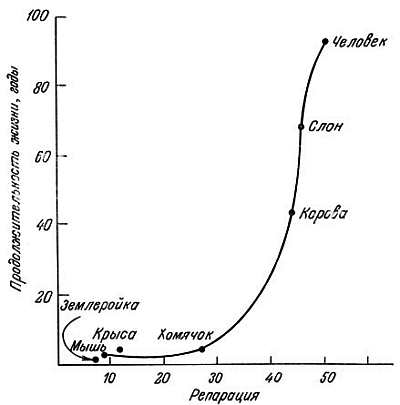
Рис. 9.3. Зависимость между продолжительностью жизни и интенсивностью включения нуклеотида, содержащего изотоп, в ДНК фибробластов в стандартных условиях в ходе репарации после ультрафиолетового облучения [43]
| <<< Назад Введение |
Вперед >>> Теория ошибок |
- «Направленные мутации» и наследование соматических мутаций
- Нейтральные мутации и генетический дрейф — движение без правил
- Мутации вирусов в лаборатории
- ВТМ помогает изучать мутации
- Микробы и мутации
- Полезные мутации переключателей
- Имеющиеся в наличии мутации
- Глава 7. Управляемые мутации
- Парамутации
- 2.7. Клетка – генетическая единица живого. Хромосомы, их строение (форма и размеры) и функции. Число хромосом и их видов...
- 2. Трансплантация ядер и гибриды соматических клеток
- Глава 9. Теории старения
