Книга: Биохимия старения
Старение клеток in vivo и после трансплантации
| <<< Назад Старение клеток in vitro |
Вперед >>> Резюме |
Старение клеток in vivo и после трансплантации
Клетки некоторых типов стареют in vivo после немногочисленных делений, другие — после большого числа делений. Различия зависят от степени дифференцировки клеток, их окружения и питания. Ограниченная жизнеспособность клеток может быть следствием снижения функциональной активности и старения организма в целом. Нельзя ли избежать старения и надолго сохранить клетки живыми путем переноса их молодому хозяину? Вместе с тем, если клетки организма постоянно замещать клетками более молодого индивидуума, не сделает ли это его жизнь более продолжительной или бесконечной? Трансплантация клеток молодому хозяину обеспечивает им естественное физиологическое окружение, которое нельзя создать при культивировании вне организма. Поэтому опыты по трансплантации позволяют отчасти отклонить упреки по поводу неестественного окружения клетки при культивирований in vitro и неприменимости полученных этим способом результатов к процессу старения организма.
Старение клеток in vivo
Ранние работы по старению клеток in vivo были проведены на интактных объектах. Уайтли и Хортом [50] нашли, что число митотических фигур на единицу поверхности клеток эпидермиса уха мыши составило 30, 15 и 2–6 в возрасте 9 дней, 3 дней и 33–36 мес (старые мыши) соответственно. Трашер и Гройлих [49], изучая радиоавтографически пролиферативную активность клеток двенадцатиперстной кишки мышей в возрасте 10, 30–70, 380–390 и 579–638 дней (старые мыши), обнаружили, что продолжительность клеточного цикла с возрастом увеличивается (табл. 8.3). Преимущественно увеличивалась продолжительность G1-фазы, тогда как фаза синтеза ДНК (S-фаза) не изменялась. Эти исследования ясно показывают, что, хотя клетки некоторых типов сохраняют способность к пролиферации вплоть до очень старого возраста, их активность существенно снижается.
Таблица 8.3. Время митотического цикла клеток обкладочного эпителия крипт тонкого кишечника мышей линии BCF1 в различном возрасте [2]
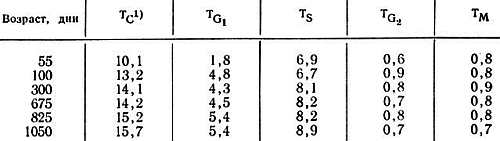
1) TC, TG1, TS, TG2 и ТM — соответственно продолжительность (в часах) клеточного цикла, фаз G1, S, G2 и митоза.
Такое явление, как смерть клетки, встречается не только в старческом возрасте или в фазе III при культивировании, клетки гибнут и в период раннего развития. Жабры и хвост головастика, предпочка и первичная почка высших позвоночных элиминируются в период раннего развития вследствие отмирания клеток этих органов [42]. Образование и формирование пальцев конечностей у позвоночных также сопровождается процессами гибели и резорбции клеток [51]. При метаморфозе, т. е. превращении личинки насекомого во взрослую особь, наблюдается массовое отмирание клеток органов личинки. Следовательно, гибель клеток в период развития необходима для образования совершенных и функционально активных органов взрослых особей, она своевременна и наступает на соответствующих стадиях развития, т. е. и здесь однажды сформированные клетки стареют и умирают.
Старение клеток после трансплантации
У насекомых с полным превращением, например у дрозофилы, на определенных участках эмбриона расположены группы специализированных клеток — имагинальные диски. Клетки каждого диска предназначены для дифференцировки специфического типа, т. е. превращения в определенный орган. Когда имагинальный диск эмбриона пересаживают в полость тела личинки того же вида, эти клетки пролиферируют, но остаются в недифференцированном состоянии до образования куколки. В период окукливания они дифференцируются и превращаются в определенную структуру. После дифференцировки эти клетки не пролиферируют. Если же имагинальный диск пересадить в тело взрослой особи того же вида, то клетки диска делятся, но не дифференцируются до конца жизни хозяина. Если диск извлечь в любом периоде жизни хозяина, разделить на фрагменты и пересадить взрослым особям, то клетки продолжают делиться у реципиента, не дифференцируясь. Используя метод серийных трансплантаций, Хейдорн [20] показал, что клетки имагинального диска сохраняют пролиферативную активность длительное время, во много раз превышающее максимальную продолжительность жизни насекомого. Эти исследования доказали, что, по крайней мере у насекомых, клетки пролиферируют в определенных условиях в течение времени, которое существенно больше продолжительности жизни хозяина. Однако неизвестно, замедляется ли постепенно пролиферативная активность или нет. Имагинальные диски имеются только у насекомых; так как у позвоночных сравнимые эмбриональные структуры отсутствуют, значение этих исследований для старения высших животных остается проблематичным.
С целью изучения процессов старения клеток и тканей производили пересадку тканей мышей одного возраста реципиенту (хозяину) другого возраста. Эти исследования выполнялись на инбредных и сингенных мышах, чтобы по возможности избежать несовместимости тканей. Крои [31, 32] серийно пересаживал кожу тела, уха и хвоста мышей-родителей молодым гибридам F1. Когда хозяин F1 старел, трансплантаты отделяли и пересаживали мышам F2. Такие последовательные переносы лоскутов кожи показали, что ее жизнеспособность и пролиферативный потенциал клеток сохраняются в течение 7–8 лет, что значительно превышает продолжительность жизни мыши. Однако после 5–6 пассажей трансплантат уменьшался в размере, с каждым последующим переносом пролиферация клеток снижалась и в конце концов ткань дегенерировала. Можно сделать вывод, что клетки сохраняют свою жизнеспособность в течение времени, превышающего продолжительность жизни хозяина, а ограничение пролиферативной активности зависит от условий внеклеточного окружения.
Влияние возраста донора на пересаженную ткань было изучено путем трансплантации кожи старой и молодой (возраст 680 и 74 дня) мыши 74-дневному животному [32]. Старая кожа отмирала у молодой мыши через 199–200 дней, но молодая ткань сохранялась дольше, до 300 дней. Хортон [29] пересаживал кожу старых (30–32 мес) мышей молодым (3–4 мес) реципиентам. Трансплантаты переживали более 4 лет, что значительно больше максимальной продолжительности жизни мышей. Следует отметить, что скорость деления клеток трансплантированной ткани была снижена. Это может быть одной из причин ее более длительного выживания.
Клетки кроветворной системы сохраняют высокую пролиферативную способность in vivo, и, по-видимому, это свойство не подвержено возрастным изменениям. Кроветворная ткань содержит стволовые клетки, или клетки-предшественники. Полагают, что каждая стволовая клетка делится, образуя одну стволовую клетку — потомка и дифференцированную клетку. Последняя начинает экспоненциально делиться с образованием клеток, которые имеют малую продолжительность жизни. Стволовые клетки имеют большую продолжительность жизни и сохраняют способность к пролиферации в течение всей жизни животного. Способность этих клеток пролиферировать была исследована посредством серийных пересадок молодым реципиентам, чья кроветворная система была разрушена массивным облучением всего тела (~800 рад). Когда реципиенты старели, трансплантированные кроветворные клетки переносили более молодым облученным реципиентам. Было показано, что защита от последствий облучения, создаваемая пересаженными клетками у реципиента, с каждой пересадкой ослаблялась [1,6]. Это может свидетельствовать об ограниченном пролиферативном потенциале стволовых клеток. В другом исследовании облученным мышам внутривенно вводили живые кроветворные клетки. Через 9-14 дней стволовые клетки образовывали колонии в селезенке хозяина. Каждая колония: развивалась из одной стволовой клетки. Клетки этих колоний были затем серийно пересажены более молодым облученным реципиентам (рис. 8.4). Результаты показали, что число колоний, образующихся в селезенке, снижается с каждой трансплантацией [33, 34]. Даже если согласиться с тем, что пролиферативная активность клеток кроветворной системы снижается после определенного возраста, оставалось необъяснимым влияние больших доз радиации на старение кроветворной системы и организма.
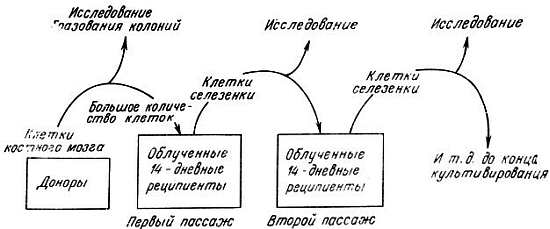
Рис. 8.4. Исследование колониеобразующей активности клеток костного мозга методом серийных трансплантаций облученным реципиентам [44]
Ситуация стала более ясной, когда в качестве реципиентов, кроветворных клеток вместо облученных мышей использовали, животных с генетически детерминированной анемией [21, 22]. Клетки молодых и старых доноров излечивают анемию и одинаково хорошо размножаются в течение 36 мес при четырех последовательных трансплантациях. Однако наблюдается постепенное снижение колониеобразующей активности стволовых клеток, которая регистрируется по числу колоний в селезенке реципиента, причем снижение больше выражено для клеток старых доноров. По-видимому, можно сделать вывод, что кроветворные клетки способны лишь к ограниченному числу делений, хотя они могут делиться в течение времени, превышающего продолжительность жизни мыши.
В другой работе Уильямсон и Асконас [52] иммунизировали мышей-доноров иммуноглобулином G (быка), конъюгированным с динитрофенолом. Иммуноглобулин, вырабатываемый у мышей к этому антигену, очень специфичен, и его можно легко обнаружить. Клетки костного мозга иммунизированных мышей затем трансплантировали реципиентам, иммунная система которых была разрушена интенсивным облучением (рис. 8.4). У реципиентов исследовали продукцию данного иммуноглобулина. Производили серийные пересадки клеток костного мозга от одного поколения мышей другому. После четырех трансплантаций выработка иммуноглобулинов снижалась вследствие постепенного уменьшения скорости деления с каждой последующей пересадкой, хотя кроветворные клетки были функционально активными в течение периода времени, превышающего максимальную продолжительность жизни мышей. В экспериментах Харрисона [21, 22] и Уильям сон а и Асконаса [52] не было установлено, какое влияние на пролиферацию оказывает сама процедура трансплантации и какие факторы в норме способствуют снижению потенциала деления кроветворных клеток.
Опыты по изучению влияния возраста донора на пролиферативную способность кроветворных клеток дали противоречивые результаты. Харрисон и Даблдей [23] иммунизировали молодых и старых мышей эритроцитами барана (SRBC). Клетки костного мозга и селезенки затем серийно пересаживали молодым летально облученным реципиентам и оценивали колониеобразующую активность стволовых клеток в селезенке. Оказалось, что клетки мышей обоих возрастав имеют почти одинаковую способность к образованию колоний. Это противоречит данным Макинодана и др. [36] и Уильямсона и Асконаса [52], которые сообщили об ослаблении иммунной компетентности у мышей с возрастом. Возможно, что эти различия объясняются неодинаковой длительностью интервалов между пересадками.
Дениел и его сотрудники изучили пролиферативную активность эпителия молочной железы при серийных пересадках. Молочную железу реципиента удаляли и на ее место помещали кусочки ткани молочной железы донора размером 0,5 мм. Когда реципиент старился, пересаженную ткань переносили молодым мышам (рис. 8.5). Примерно после семи последовательных пассажей пролиферация эпителиальных клеток уменьшалась, трансплантаты сморщивались и гибли [7-12]. В других опытах было показано, что если промежуток между пересадками равен 3 мес, то трансплантат уменьшается в размерах быстрее и сохраняется только около двух лет. Если, однако, интервал продлить до 1 года, то трансплантат живет в течение шести пассажей (шести лет), хотя и становится меньше.
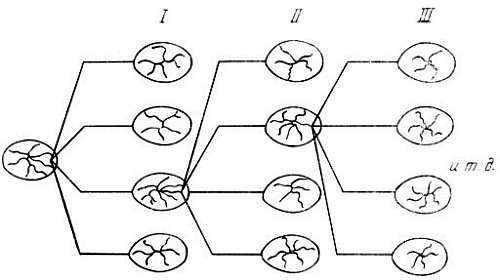
Рис. 8.5. Схема серийных пересадок ткани молочной железы мышей [10]. Первичные имплантаты получают из одной железы донора и пересаживают в 10–14 жировых подушечек реципиента, освобожденных от железистой ткани (генерация I). Материал для последующих пересадок всегда берут из наиболее активно растущего трансплантата предшествующей генерации. Скорость роста выражают в средних процентах прижившихся трансплантатов данной генерации
Для того чтобы выяснить, какое влияние оказывает возраст донора на рост и пролиферацию ткани молочной железы, производили одновременную пересадку донорского материала, полученного от 3- и 26-месячных мышей, на контралатеральные участки трехмесячным реципиентам [54]. В идентичных условиях ткани были серийно пересажены пяти поколениям мышей, после чего они деградировали и погибали. Причиной отсутствия возрастных различий могла быть девственность старых самок-доноров и связанное с этим функционально неактивное состояние клеток их молочных желез. В обратном эксперименте, при пересадке ткани молочной железы 26- и 3-месячных мышей на контралатеральные участки 26-месячных мышей, ни один трансплантат интенсивно не развивался. На результат этого опыта могло повлиять ухудшение эндокринного статуса, которое наблюдается при старении.
| <<< Назад Старение клеток in vitro |
Вперед >>> Резюме |
- Глава 8. Старение клетки
- 4.2. Правовые и биоэтические основы законодательства о трансплантации органов и тканей человека
- Парадоксальная связь между митохондриальными мутациями и старением
- Старение и эволюция
- Глава I Здоровье, старение и долголетие с точки зрения биологии
- Старение и увеличение продолжительности жизни
- Глава 2. Старение и витаукт
- Старение и болезни
- 5.1. Старение, продолжительность жизни, адаптивные реакции и реактивность организма
- XIX.1 Старение мозга, болезнь Альцгеймера и прочие формы деменции
- Генетический аппарат клеток и старение
- Глава V Старение и связанные с ним болезни
