Книга: Биохимия старения
Старение клеток in vitro
| <<< Назад Введение |
Вперед >>> Старение клеток in vivo и после трансплантации |
Старение клеток in vitro
Ранние исследования клеток в культуре были выполнены на фибробластах куриного эмбриона. Эбелинг [14], работавший вместе с Алексисом Каррелем, первый сообщил, что фибробласты непрерывно размножаются в среде, содержащей экстракт клеток цыпленка. Это наводило на мысль, что клетки, освобожденные от физиологического контроля, могут жить неопределенно долго, т. е. стать бессмертными, и что их ограниченная продолжительность жизни зависит от факторов, присущих организму. Однако результаты этой работы не удалось воспроизвести современными методами культивирования. По-видимому, непрерывное размножение фибробластов было вызвано внесением в среду вместе с экстрактом свежих клеток [24]. Позже было установлено, что клетки в культуре иногда приобретают патологические черты — у них меняется число хромосом, и именно такие клетки способны непрерывно делиться. Отсюда следует важный вывод о необходимости периодической проверки культуры для того, чтобы вовремя выявить клетки с измененным кариотипом, которые ведут себя подобно раковым.
Позже Каррель и Эбелинг [4] сообщили, что скорость роста куриных фибробластов обратно пропорциональна возрасту цыпленка, плазму которого использовали для культивирования. Результаты этой работы тоже не подтвердились, но в других исследованиях было показано, что латентный период миграции клеток из эксплантатов длиннее, если использовались ткани старых доноров [5]. Это наблюдали и другие авторы.
Культура клеток in vitro
Методы культуры ткани были значительно усовершенствованы за последние 20 лет, и сейчас можно изучать клетки в условиях, очень близких к физиологическим. Ткань изолируют и обрабатывают трипсином, разрушающим межклеточное вещество и освобождающим клетки, которые затем собирают центрифугированием. Известное число клеток помещают в стеклянные или пластиковые культуральные сосуды, содержащие среду, и инкубируют при 37 °C. При культивировании in vitro фибробластов легкого и кожи человека наблюдаются при четко различимые фазы. Через несколько часов после посева клетки прилипают к стеклянной поверхности и по прошествии 24–48 ч начинают делиться. Поверхность стекла через несколько дней покрывается дочерними клетками. Так образуется первичная культура. Период времени от высева исходных клеток до завершения образования монослоя называется фазой I.
После образования монослоя скорость деления клеток значительно уменьшается. Для получения больших количеств клеточной массы необходимо создать условия для дальнейшего роста клеток; Сначала удаляют среду, а затем добавляют трипсин, после чего клетки отстают от стекла. Часть суспензии клеток помещают в новые культуральные флаконы, на свободной поверхности которых клетки возобновляют деление. Обычно используют флаконы с одинаковой поверхностью. Если в этих условиях количество клеток, выращенных в двух новых флаконах, в 2 раза превышает их число в первичной культуре, т. е. происходит одно удвоение клеточной популяции, то принято обозначать частоту субкультивирования отношением 1:2. Точно неизвестно, делится ли один раз каждая клетка или только некоторые. При частоте субкультивирования 1:4 клеточная масса увеличивается в 4 раза, т. е. популяция удваивается дважды. Обычно, когда субкультивирование проводится с частотой 1:2, удвоение популяции достигается каждые 3–4 дня и за пять недель получают 210 (1024) дочерних клеток.
Фибробласты легких и кожи человека быстро делятся и растут, если материалом для пересева служит суспензия клеток первичной культуры, которая прошла фазу I. Популяция эмбриональных клеток удваивается 40–60 раз. Это соответствует фазе II, которая характеризуется быстрым ростом клеток. Иногда в этой фазе может появиться несколько клеток, которые начинают непрерывно делиться. Поэтому желательно время от времени исследовать кариотип клеток. Любое отклонение кариотипа от исходного указывает на наличие трансформированных или раковых клеток. Однако, как правило, пролиферация клеток постепенно затухает после 40–60 удвоений популяции и полностью прекращается примерно после 50±10 удвоений популяции, после чего клетки разрушаются и погибают. Это фаза III, для которой характерно снижение пролиферации и развитие признаков старения клеток. Клетки этой фазы называются поздними пассажными клетками. Клетки стареют даже в том случае, если регулярно заменяется среда и питательные вещества имеются в достаточном количестве. В фазе III время образования монослоя становится больше, чем в фазе II, постепенно оно увеличивается еще больше, клетки перестают делиться и затем погибают (рис. 8.1).
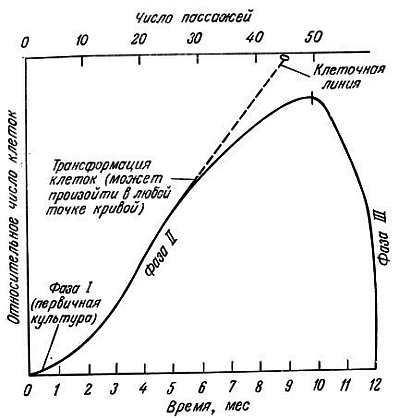
Рис. 8.1. Диаграмма происхождения клеточных штаммов и феномена трансформации клеток в культуре [26]. Фаза I, первичная культура, завершается формированием первого монослоя. Фаза II характеризуется усиленным ростом, требующим частых пересевов. Когда культура достигает этой фазы, ее называют 'клеточным штаммом'. В результате какого-либо изменения может возникнуть клеточная линия с неограниченной продолжительностью жизни или клетки вступают в фазу III и погибают
Кроме снижения пролиферативной активности клеток в фазе III (рис. 8.2) изменяются некоторые метаболические параметры (табл. 8.1). Содержание одних ферментов снижается, других — повышается или остается прежним. Эти изменения сходны с теми, которые наблюдаются в различных органах животного in vivo при старении (гл. 3). Момент снижения пролиферативной активности легко регистрируется и принимается обычно за начальную точку фазы III, правда, некоторые изменения метаболических параметров возникают раньше уменьшения скорости деления. Несомненно, что репликация зависит от интенсивности метаболизма, снижение которой не может не отразиться на способности клеток к пролиферации. Холлидей иТаррент [28], а также Линн и др. [35] сообщили, что на поздних этапах фазы III легочные фибробласты человека MRC-5 содержат измененную ДНК-полимеразу, имеющую аминокислотные замены. По-видимому, именно этим объясняется уменьшение пролиферативной активности клеток. Оргел [39] предположил, что в ДНК-полимеразе старых клеток могут возникать ошибки, которые отрицательно сказываются на скорости деления. В структуре некоторых других ферментов, изученных к настоящему времени (в их числе РНК-полимераза), ошибки не обнаружены; это свидетельствует о том, что аминокислотные последовательности данных ферментов не изменяются при переходе клеток из фазы II в фазу III [13, 15, 30] (другие ссылки см. в гл. 9). Таким образом, наблюдаемое ослабление пролиферации, по-видимому, обусловлено только постепенным снижением синтеза ДНК-полимеразы.
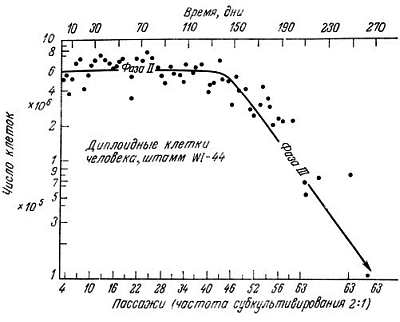
Рис. 8.2. Зависимость количества клеток штамма WI-44 от длительности культивирования [24]. В течение первых 40 пассажей число клеток остается практически постоянным и составляет около 6·106 на каждый пассаж при частоте субкультивирования 2:1. Начиная с 45-го пассажа, число клеток логарифмически падает (фаза III)
Таблица 8.1.Метаболические и клеточные параметры, которые снижаются, повышаются или не изменяются при старении интактных фибробластов человека in vitro [26]



Возрастные изменения клеток в культуре
С целью исследования причин старения организма было предпринято изучение старения клеток в культуре. Как впервые показали Свим и Паркер [48], фибробласты, полученные из различных тканей человека, пролиферируют только в течение ограниченного времени, после чего погибают. Эти авторы, однако, не выяснили, сохраняют ли клетки в культуре свои нормальные свойства, и не осмелились предположить, что их ограниченная пролиферативная активность связана со старением. Позже аналогичные работы были широко развернуты в лаборатории Хейфлика. Хейфлик и Мурхед [27] установили, что легочные фибробласты эмбриона человека проходят в культуре около 50 удвоений популяции и затем погибают. Фибробласты, полученные из легочной ткани взрослого донора, подвергаются только ~20 удвоениям популяции [24]. Хейфлик предположил, что имеется обратная зависимость между возрастом донора и пролиферативным потенциалом фибробластов. Позже другие исследователи [18, 34, 37, 43, 45] также сообщили о наличии такой связи (рис. 8.3). Более того, было показано, что при культивировании фибробластов кожи, полученных от людей в возрасте 10–90 лет, наблюдается снижение потенциала удвоения примерно на 0,20 относительные единицы в расчете на каждый год жизни донора. Коэффициент регрессии составляет -0,20 [37]. Сообщение Голдстейна и др. [19] о том, что не хронологический возраст донора, а скорее его физиологическое состояние ответственно за скорость роста фибробластов, побудило многих авторов проделать скрупулезную работу с клетками разных типов, чтобы установить, действительно ли существует линейная связь между хронологическим возрастом и удвоением популяции. Изучение культур фибробластов, источником которых служили клетки тщательно отобранных здоровых доноров, не предрасположенных к диабету, дало отрицательный результат: обратная зависимость между возрастам донора и числом удвоений популяции не была обнаружена. В то же время эта зависимость была установлена для культур клеток, полученных от больных диабетом или от лиц, генетически предрасположенных к этому заболеванию. Таким образом, именно физиологическое состояние в большей степени, чем хронологический возраст, определяет пролиферативную активность клеток.
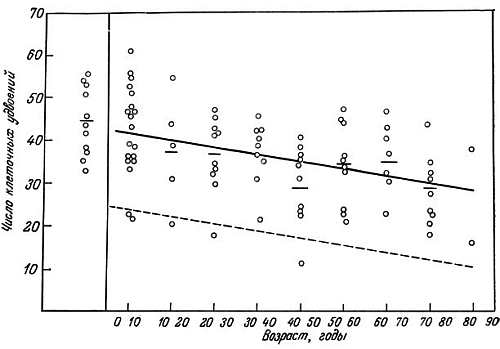
Рис. 8.3. Зависимость максимального числа удвоений популяции фибробластов человека от возраста донора [37]. Средние значения для каждого десятилетия обозначены горизонтальными черточками. Коэффициент линии регрессии составляет -0,20 (±0,5 S.D) клеточных удвоений в год; коэффициент корреляции равен 0,5
Можно ожидать, что фибробласты больных прогерией (синдром Хатчинсона — Гилфорда) и с синдромом Вернера, заболеваниями, для которых характерно ускоренное старение, должны иметь сниженную пролиферативную активность. Прогерия — редкое генетическое заболевание человека, при котором наблюдается замедление роста и атеросклероз всех крупных кровеносных сосудов, включая аорту и коронарную артерию, уже в 9-летнем возрасте [40], а также значительное отложение возрастного пигмента липофусцина в клетках многих органов. Картина преждевременного старения выражена очень ярко, и ребенок в возрасте 9 лет напоминает 70-летнего человека. Больные остаются бесплодными и умирают, не достигнув 20 лет. Синдром Вернера является сходным заболеванием, но его симптомы развиваются позже; больные тоже имеют сниженную продолжительность жизни, в среднем около 47 лет. Заболевание носит генетический характер, оно контролируется аутосомным генам. Основные симптомы: высокая частота злокачественных новообразований, ранняя потеря и поседение волос, малый рост, юношеская катаракта, склонность к диабету, ранний атеросклероз, кальцификация кровеносных сосудов и остеопороз.
Фибробласты, полученные от 9-летних больных прогерией, проходят в культуре только 2–4 удвоения популяции, т. е. существенно меньше, чем клетки, полученные от здоровых детей того же возраста. Снижен синтез ДНК и эффективность клонирования [16, 17]. Антигенные маркеры HLA, имеющиеся на поверхности фибробластов здоровых людей, отсутствуют на фибробластах больных прогерией. Фибробласты больных с синдромом Вернера также обладают сниженным потенциалом удвоения [37]. Эти данные показывают, что скорее физиологическое состояние, а не хронологический возраст определяет способность клеток к пролиферации [19]. Более того, ускоренное старение организма отражается в ускоренном старении клеток in vitro, о чем свидетельствует изменение скорости деления и метаболизма.
Известно, что если клетки заморозить при температуре ниже нуля после того, как они просуществовали в культуре некоторое время, например прошли 20 удвоений популяции, а затем вернуть их к жизни при 37 °C, то они возобновляют деление и "доживают свой век", проходя еще около 30 удвоений популяции. Это указывает на постоянство потенциала деления клеток данного типа, который не зависит от времени, необходимого для завершения полного цикла делений. Фибробласты человека штамма WI-38, замороженные в жидком азоте на 14 лет, после возобновления размножения завершили общий цикл деления, который составил 50±10 удвоений популяции [25].
Был измерен потенциал деления клеток различных типов. Мартин и др. [37] показали, что фибробласты кожи эмбриона человека проходят 45 удвоений популяции, тогда как клетки скелетной мышцы и костного мозга — значительно меньше. Кроме того, выяснили, что клетки почки, сердца, тимуса, щитовидной железы [27] и печени [34] живут в культуре меньше, чем клетки легкого. Следовательно, пролиферативная активность клеток различных типов неодинакова. Зависит ли это от характера и степени их дифференцировки, пока неизвестно. Хотя клетки костного мозга и эпителия продолжают делиться в организме на протяжении всей жизни, их пролиферативная способность in vitro ограничена. В этой связи было бы важно узнать не только то, почему эти клетки имеют пониженный потенциал деления, но также и то, не делились ли они уже до помещения их в культуру. Такие исследования могут дать полезную информацию о том, почему клетки типа нейронов, скелетной и сердечной мышц прекращают деление на ранней стадии развития.
Были предприняты попытки установить взаимосвязь между продолжительностью жизни вида и потенциалом деления фибробластов, и хотя были изучены лишь немногие виды с разной продолжительностью жизни, результаты указывают на наличие положительной корреляции между этими величинами (табл. 8.2). Фибробласты эмбриона галапагосской черепахи, наиболее долгоживущего вида среди изученных, обладают и самым высоким потенциалом деления, тогда как для мыши, чья продолжительность жизни не превышает трех лет, эта величина значительно меньше.
Таблица 8.2.Максимальная продолжительность жизни культивируемых нормальных фибробластов эмбриона человека и животных [26]

Для ответа на вопрос, вызваны ли старение и смерть клеток накоплением какого-либо цитоплазматического фактора, был использован метод гибридизации соматических клеток [53]. Гибридизация старых и молодых клеток была нежелательна, так как она привела бы к образованию гибридов с двойным набором хромосом. Удалением ядра из легочных фибробластов человека, находившихся во II и III фазах роста, получали цитопласты. Затем происходило их слияние с интактными фибробластами раннего и позднего пассажей следующим образом: молодые цитопласты — с молодыми клетками, старые цитопласты — с молодыми клетками, молодые цитопласты — со старыми клетками и старые цитопласты — со старыми клетками. Число удвоений популяции первых двух гибридных линий составило около 20, а двух последних — около 5. Отсюда следует, что цитоплазма, вероятно, не содержит никакого фактора, который влияет на потенциал деления, т. е. пролиферативная активность клеток определяется на уровне ядра или генома. Полученные результаты необходимо подтвердить в дальнейших исследованиях.
Таким образом, клетки стареют как in vivo, так и in vitro. Существует, однако, большая вариабельность продолжительности их жизни и числа делений. Клетки типа нейронов или скелетной и сердечной мышц прекращают деление in vivo на ранних стадиях развития и становятся постмитотическими. Было бы интересно узнать, сколько раз они подвергаются делению, прежде чем достигают постмитотической стадии. Спустя некоторое время эти постмитотические клетки стареют и погибают. Таким образом, эти клетки сначала прекращают деление, а затем подвергаются старению. Клетки костного мозга, эпителия и печени сохраняют пролиферативную активность в течение всей жизни, хотя она постепенно падает в старческом возрасте. Когда эти клетки культивируют iv vitro, они прекращают делиться и через некоторое время стареют. Очевидно, эти клетки обладают способностью к размножению, которая во много раз превышает аналогичную способность нейронов и мышечных клеток. Важно изучить клетки эмбриона тотчас после того, как они прошли дифференцировку и превратились в клетки специфических типов, чтобы увидеть, имеют ли степень и тип дифференцировки какую-либо связь с пролиферативной активностью и природой постмитотического состояния. Такие исследования клеток различных типов, начиная с самых ранних стадий дифференцировки и до прекращения деления, могут дать ключевую информацию о причинах прекращения деления.
Возникает вопрос, действительно ли те клетки, которые сохраняют способность делиться в течение всей жизни, не стареют? Действительно ли они обновляются всякий раз, когда делятся? Можно ли считать две дочерние клетки полностью идентичными не только в отношении содержания ДНК, но и родительских органелл? Известно, что во время созревания сперматиды наблюдается неадекватное деление.
Вернет [3] предположил, что клетки одного типа могут быть более ответственны за старение, чем другие. По его мнению клетки тимуса и тимус-зависимые клетки, которые подвержены ослаблению пролиферации по типу фазы III, определяют темп старения. Вернет — сторонник той точки зрения, что изменения в этих клетках ответственны за аутоиммунные заболевания, которые чаще встречаются в пожилом возрасте. Эта концепция основана на представлении, что причиной старения являются соматические мутации, однако доказательств для нее пока нет.
Если старение — внутреннее свойство клеток, тогда оно должно быть присуще и одноклеточным организмам. Амебы проходят ограниченное число делений и живут ограниченное время, если их содержать на неполноценном рационе. Они продолжают расти и размножаться непрерывно только в том случае, если питание обильно, чего обычно не бывает в естественных условиях [38]. Многие клоны парамеций [46, 47] и аскомицетов [41] имеют ограниченную пролиферативную активность.
| <<< Назад Введение |
Вперед >>> Старение клеток in vivo и после трансплантации |
- Глава 8. Старение клетки
- Парадоксальная связь между митохондриальными мутациями и старением
- Старение и эволюция
- Глава I Здоровье, старение и долголетие с точки зрения биологии
- Старение и увеличение продолжительности жизни
- Глава 2. Старение и витаукт
- Старение и болезни
- 5.1. Старение, продолжительность жизни, адаптивные реакции и реактивность организма
- XIX.1 Старение мозга, болезнь Альцгеймера и прочие формы деменции
- Генетический аппарат клеток и старение
- Глава V Старение и связанные с ним болезни
- Наука побеждает старение
