Книга: Общая химия
231. Марганец (Manganum).
| <<< Назад ПОДГРУППА МАРГАНЦА |
Вперед >>> 232. Рений (Rhenium). |
Разделы на этой странице:
231. Марганец (Manganum).
Марганец принадлежит к довольно распространенным элементам, составляя 0.1% (масс.) земной коры. Из соединений, содержащих марганец, наиболее часто встречается минерал пиролюзит, представляющий собой диоксид марганца MnO2. Большое значение имеют также минералы гаусманит Mn3O4 и браунит Mn2O3.
СССР располагает большими запасами марганца. По запасам руд с высоким содержанием марганца СССР занимает первое место в мире.
Марганец получают либо электролизом раствора MnSO4, либо восстановлением из его оксидов кремнием в электрических печах. Второй (силикотермический) метод более экономичен, но дает менее чистый продукт. При электролитическом методе руду восстанавливают до соединений марганца со степенью окисленности +2, а затем растворяют в смеси серной кислоты с сульфатом аммония. Получающийся раствор подвергают электролизу. Снятые с катодов осадки металла переплавляют в слитки.
Марганец — серебристо-белый твердый хрупкий металл. Его плотность 7,44 г/см3, температура плавления 1245°C. Известны четыре кристаллические модификации марганца, каждая из которых термодинамически устойчива в определенном интервале температур. Ниже 707°C устойчив а-марганец, имеющий сложную структуру — в его элементарную ячейку входят 58 атомов. Сложность структуры марганца при температурах ниже 707°C обусловливает его хрупкость.
В ряду напряжений марганец находится между алюминием и цинком: стандартный электродный потенциал системы Mn2+/Mn равен —1,18 В. На воздухе марганец покрывается тонкой оксидной пленкой, предохраняющей его от дальнейшего окисления даже при нагревании. Но в мелкораздробленном состоянии марганец окисляется довольно легко. Вода при комнатной температуре действует на марганец очень медленно, при нагревании — быстрее. Он растворяется в разбавленных соляной и азотной кислотах, а также в горячей концентрированной серной кислоте (в холодной H2SO4 он практически нерастворим); при этом образуются катионы Mn2+.
Марганец применяется главным образом в производстве легированных сталей. Марганцовистая сталь, содержащая до 15% Mn, обладает высокими твердостью и прочностью. Из нее изготовляют рабочие части дробильных машин, шаровых мельниц, железнодорожные рельсы. Кроме того, марганец входит в состав ряда сплавов на основе магния; он повышает их стойкость против коррозии. Сплав меди с марганцем и никелем — манганин (см. § 200) дает низким температурным коэффициентом электрического сопротивления.
- 643 -
В небольших количествах марганец вводится во многие сплавы алюминия.
Марганец образует четыре простых оксида (MnO, Mn2O3, MnO2 и Mn2O7) и смешанный оксид Mn3O4(или MnO·Mn2O3). Первые два оксида обладают основными свойствами, диоксид марганца MnO2 амфотерен, а высший оксид Mn2O7 является ангидридом марганцовой кислоты HMnO4. Известны также производные марганца (IV), но соответствующий оксид MnO3 не получен.
В практическом отношении наиболее важны соединения марганца (II), диоксид марганца и соли марганцовой кислоты—перманганаты, в которых марганец находится в степени окисленности +7.
Соединения марганца(II).
Соли марганца (II) получаются при растворении марганца в разбавленных кислотах или при действии кислот на различные природные соединения марганца. Так, из раствора, остающегося после получения хлора действием соляной кислоты на диоксид марганца, выкристаллизовывается хлорид марганца(II) MnCl2 в виде бледно-розовых кристаллов. В твердом виде соли марганца (II) обычно розового цвета, растворы же их почти бесцветны.
При действии щелочей на растворы солей марганца(II) выпадает белый осадок — гидроксид марганца(II) Mn(OH)2. Осадок легко растворяется в кислотах. На воздухе он быстро темнеет, окисляясь в бурый гидроксид марганца(IV) Mn(OH)4.
Оксид марганца(II), или закись марганца, MnO получается в виде зеленого порошка при восстановлении других оксидов марганца водородом.
Соединения марганца (IV).
Наиболее стойким соединением марганца является темно-бурый диоксид марганца MnO2; он легко образуется как при окислении низших, так и при восстановлении высших соединений марганца. Как уже указывалось, MnO2 — амфотерный оксид; однако и кислотные, и основные свойства выражены у него очень слабо.
В кислой среде диоксид марганца — довольно энергичный окислитель. В качестве окислителя его применяют при получении хлора из соляной кислоты и в сухих гальванических элементах. Соли марганца (IV), например MnCl4 и Mn(SO4)2, весьма нестойки.
Соединения марганца(VI) и (VII).
При сплавлении диоксида марганца с карбонатом и нитратом калия получается зеленый сплав, растворяющийся в воде с образованием красивого зеленого раствора. Из этого раствора можно выделить темно-зеленые кристаллы манганита калия K2MnO4 - соли марганцовистой кислоты H2MnO4, очень нестойкой даже в растворе.
Реакцию образования манганата калия можно выразить уравнением:
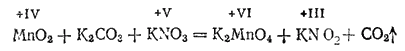
- 644 -
Если раствор манганата оставить стоять на воздухе, то окраска его постепенно изменяется, переходя из зеленой в малиновую, причем образуется темно-бурый осадок. Это объясняется тем, что в водном растворе манганаты самопроизвольно превращаются в соли марганцовой кислоты HMnO4 (перманганаты) с одновременным образованием диоксида марганца. Реакция выражается уравнением
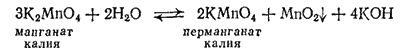
или в ионно-молекулярной форме:
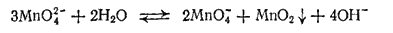
При этой реакции один ион MnO42- окисляет два других таких же иона в ионы MnO4-, а сам восстанавливается, образуя MnO2.
Процесс превращения манганата в перманганат обратим. Поэтому в присутствии избытка гидроксид-ионов зеленый раствор манганата долгое время может сохраняться без изменения. Если же прибавить кислоту, связывающую гидроксид-ионы, зеленая окраска почти мгновенно изменяется на малиновую.
При действии сильных окислителей (например, хлора) на раствор манганата последний полностью превращается в перманганат:
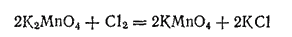
Перманганат калия KMnO4 — наиболее широко применяемая соль марганцовой кислоты. Кристаллизуется он в виде красивых темно-фиолетовых, почти черных призм, умеренно растворимых в воде. Растворы KMnO4 имеют темно-малиновый, а при больших концентрациях — фиолетовый цвет, свойственный ионам MnO4-. Как и все соединения марганца (VII), перманганат калия — сильный окислитель. Он легко окисляет многие органические вещества, превращает соли железа (II) в соли железа (III), сернистую кислоту окисляет в серную, из соляной кислоты выделяет хлор и т. д.
Вступая в окислительно-восстановительные реакции, KMnO4 (ион MnO4-) может восстанавливаться в различной степени. В зависимости от pH среды продукт восстановления может представлять собою ион Mn2+ (в кислой среде), MnO2 (в нейтральной или в слабощелочной среде) или ион MnO42- (в сильнощелочной среде).
Проиллюстрируем эти три случая реакциями взаимодействия KMnO4 с растворимыми сульфитами. Если к подкисленному серной кислотой фиолетовому раствору KMnO4 прибавить сульфит калия K2SO3, то жидкость становится почти бесцветной, так как образующаяся соль марганца (II) имеет бледно-розовую окраску. Реакция выражается уравнением

или в ионно-молекулярной форме:
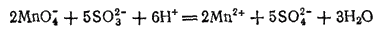
- 645 -
При действии сульфита калия на нейтральный раствор перманганата калия тоже происходит обесцвечивание раствора, но, кроме того, выпадает бурый осадок диоксида марганца и раствор приобретает щелочную реакцию
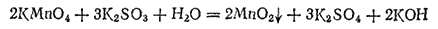
или в ионно-молекулярной форме:
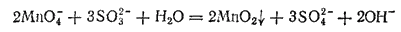
При большой концентрации щелочи и малом количестве восстановителя образуются ионы манганата согласно уравнению:
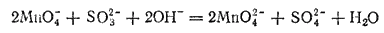
Как энергичный окислитель перманганат калия широко применяют в химических лабораториях и производствах; он служит также прекрасным дезинфицирующим средством.
При нагревании в сухом виде перманганат калия уже при температуре около 200°C разлагается согласно уравнению:
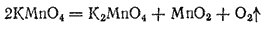
Этой реакцией иногда пользуются в лаборатории для получения кислорода.
Соответствующая перманганатам свободная марганцовая кислота HMnO4 в безводном состоянии не получена и известна только в растворе. Концентрацию ее раствора можно довести до 20%. Это очень сильная кислота, в водном растворе полностью диссоциированная на ионы: ее кажущаяся степень диссоциации в 0,1 н. растворе равна 93%.
Оксид марганца (VII), или марганцовый ангидрид, Mn2O7 может быть получен действием концентрированной серной кислоты на перманганат калия:
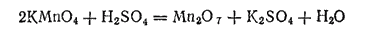
Марганцовый ангидрид — зеленовато-бурая маслянистая жидкость. Он очень неустойчив: при нагревании или при соприкосновении с горючими веществами он со взрывом разлагается на диоксид марганца и кислород.
| <<< Назад ПОДГРУППА МАРГАНЦА |
Вперед >>> 232. Рений (Rhenium). |
