Книга: Общая химия
ПОДГРУППА ТИТАНА
| <<< Назад Глава XXI. ПОБОЧНЫЕ ПОДГРУППЫ ЧЕТВЕРТОЙ, ПЯТОЙ, ШЕСТОЙ И СЕДЬМОЙ ГРУПП |
Вперед >>> 225. Цирконий (Zirconium). Гафний (Hafnium). |
ПОДГРУППА ТИТАНА
В подгруппу титана входят элементы побочной подгруппы IV группы — титан, цирконий, гафний и искусственно полученный (см. стр. 107) курчатовий. Металлические свойства выражены у этих элементов сильнее, чем у металлов главной подгруппы четвертой группы — олова и свинца.
Атомы элементов подгруппы титана имеют в наружном слое по два электрона, а во втором снаружи слое — по 10 электронов, из которых два — на d-подуровне. Поэтому наиболее характерная степень окисленности металлов подгруппы титана равна +4.
В свободном состоянии титан и его аналоги — типичные металлы, по внешнему виду похожие на сталь. Все они тугоплавки, устойчивы по отношению к воздуху и к воде. 224. Титан (Titanium).
Титан очень распространен в природе; его содержание в земной коре составляет 0,6% (масс.), т. е. выше, чем содержание таких широко используемых в технике металлов, как медь, свинец и цинк.
Минералы, содержащие титан, находятся в природе повсеместно. Важнейшими из них являются: титаномагнетиты FeTiO3·Fe3O4, ильменит FeTiO3, сфен CaTiSiO5 и рутил TiO2. В СССР месторождения титановых руд находятся на Урале.
При промышленном получении титана руду или концентрат переводят в диоксид титана TiO2, который затем подвергают хлорированию. Однако даже при 800-1000°C хлорирование протекает медленно. С достаточной для практических целей скоростью оно происходит в присутствии углерода, связывающего кислород в основном в СО:
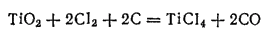
Получающийся хлорид титана(IV) восстанавливают магнием
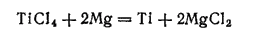
а образующуюся смесь подвергают нагреванию в вакууме. При этом магний и его хлорид испаряются и осаждаются в конденсаторе. Остаток — губчатый титан — переплавляют, получая компактный ковкий металл.
Примеси кислорода, азота, углерода резко ухудшают механические свойства титана, а при большом содержании превращают его в хрупкий материал, непригодный для практического использования. Поскольку при высоких температурах титан реагирует с названными неметаллами, его восстановление проводят в герметичной аппаратуре в атмосфере аргона, а очистку и переплавку — в высоком вакууме.
Для получения небольших количеств титана высокой чистоты применяют иодидный метод (см. § 193).
Металлический титан плавится при 1665°C плотность его равна 4,505 г/см3. Титан — довольно активный металл; стандартный электродный потенциал системы Ti/Ti2+ равен —1,63 В. Однако благодаря образованию на поверхности металла плотной защитной пленки титан обладает исключительно высокой стойкостью против коррозии, превышающей стойкость нержавеющей стали.
- 629 -
Он не окисляется на воздухе, в морской воде и не изменяется в ряде агрессивных химических сред, в частности в разбавленной и концентрированной азотной кислоте и даже в царской водке.
Благодаря исключительно высокому сопротивлению коррозии титан — прекрасный материал для изготовления химической аппаратуры. По главное свойство титана, способствующее все большему его применению в современной технике, — высокая жаростойкость как самого титана, так и его сплавов с алюминием и другими металлами. Кроме того, эти сплавы обладают жаропрочностью — способностью сохранять высокие механические свойства при повышенных температурах. Все это делает сплавы титана весьма ценными материалами для самолето- и ракетостроения.
Титан лишь немного тяжелее алюминия, но в 3 раза прочнее его. Это открывает перспективы применения титана в различных областях машиностроения. Достаточно указать, что использование деталей из титана и его сплавов в двигателях внутреннего сгорания позволяет снизить массу этих двигателей примерно на 30%.
Широкие возможности применения титана в технике вызвали бурное развитие его производства. В 1948 г. был получен первый промышленный титан в количестве 2,5 т, в 1954 г. мировое производство этого металла составило 7000 т, а в 1957 г. достигло 30 000 т. Таких темпов роста не наблюдалось в производстве ни одного из других металлов.
При высокой температуре титан соединяется с галогенами, кислородом, серой, азотом и другими элементами. На этом основано применение сплавов титана с железом (ферротитана) в качестве добавки к стали. Титан соединяется с находящимися в расплавленной стали азотом и кислородом и этим предотвращает выделение последних при затвердевании стали—литье получается однородным и не содержит пустот.
Соединяясь с углеродом, титан образует карбид. Из карбидов титана и вольфрама с добавкой кобальта получают сплавы, по твердости приближающиеся к алмазу.
Диоксид титана TiO2 — белое тугоплавкое вещество, нерастворимое в воде и разбавленных кислотах. Это — амфотерный оксид, но как основные, так и кислотные свойства выражены у него слабо.
Применяется TiO2 при изготовлении тугоплавких стекол, глазури, эмали, жароупорной лабораторной посуды, а также для приготовления белой масляной краски, обладающей высокой кроющей способностью (титановые белила).
Сплавлением TiO2 с BaCO3 получают титанат бария BaTiO3. Эта соль имеет очень высокую диэлектрическую проницаемость и, кроме того, обладает способностью деформироваться под действием электрического поля. Кристаллы титаната бария применяются в электрических конденсаторах высокой емкости и малых размеров, в ультразвуковой аппаратуре, в звукоснимателях, в гидроакустических устройствах.
| <<< Назад Глава XXI. ПОБОЧНЫЕ ПОДГРУППЫ ЧЕТВЕРТОЙ, ПЯТОЙ, ШЕСТОЙ И СЕДЬМОЙ ГРУПП |
Вперед >>> 225. Цирконий (Zirconium). Гафний (Hafnium). |
- Глава XV. ГЛАВНАЯ ПОДГРУППА ЧЕТВЕРТОЙ ГРУППЫ
- Глава XIV. ГЛАВНАЯ ПОДГРУППА ПЯТОЙ ГРУППЫ
- ПОБОЧНАЯ ПОДГРУППА ВОСЬМОЙ ГРУППЫ
- ПОДГРУППА МАРГАНЦА
- Глава XIII. ГЛАВНАЯ ПОДГРУППА ШЕСТОЙ ГРУППЫ
- ПОБОЧНАЯ ПОДГРУППА ТРЕТЬЕЙ ГРУППЫ. ЛАНТАНОИДЫ. АКТИНОИДЫ
- ПОДГРУППА ВАНАДИЯ
- ПОДГРУППА ХРОМА
- 220. Подгруппа скандия.
- Колонки нейронов и сознание
- Современная классификация бактерий
