Книга: Общая химия
110. Ионообменная адсорбция.
| <<< Назад 109. Сорбция и сорбционные процессы. |
Вперед >>> 111. Хроматография. |
110. Ионообменная адсорбция.
При адсорбции электролитов преимущественно адсорбируются или катионы, или анионы, которые заменяются на эквивалентное количество ионов того же знака из адсорбента. Раствор остается при этом электронейтральным. Таким образом, адсорбция электролитов происходит путем эквивалентного обмена ионов одинакового знака, а потому получила название ионообменной адсорбции. Ионообменный механизм адсорбции электролитов первоначально был подмечен агрономами и почвоведами при вытеснении одних ионов почвенных электролитов другими. К. К. Гедройц доказал (1918 г.) эквивалентность обмена катионов в почвах и создал учение о почвенном поглощающем комплексе (высокодисперсной органоминеральной части почвы), обусловливающем способность почв удерживать необходимые растениям растворимые соли в доступной для корневого питания форме.
Неорганические и органические материалы, способные к обмену ионов, получили название ионитов. Их делят на катиониты (для обмена катионов) и аниониты (для обмена анионов). Разнообразные синтетические ионообменные материалы химической промышленностью выпускаются в виде зернистых порошков, волокон и мембран.
- 314 -
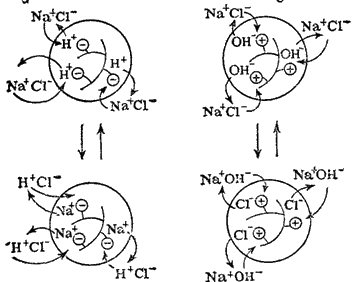
Рис. 97. Схема ионного обмена в зернах катионита (а) и анионита (б). Потенциал-определяющие — ионогенные группы, химически связанные с каркасом ионита: соответственно ? и ?. Катионит в H+ -форме, анионит в OH--форме; H+ и OH- — ионы, которые в растворе NaCl обмениваются, соответственно, на ионы Na+ и Cl-.
Органические и неорганические иониты нерастворимы в воде. Они представляют собой трехмерный каркас, в который включены несущие заряд группы атомов, называемые потенциалопределяю-щими ионами. Ионы противоположного знака называют противо-ионами. Они связаны с потенциалопределяющими ионами каркаса электростатическими силами, а потому способны к обмену на другие ионы. Так, структуру стекла составляет трехмерная сетка кремнекислородных (силикатных) ионов. В пустотах этой трехмерной кремнекислородной решетки находятся катионы щелочных или щелочноземельных металлов, удерживаемые электростатическими силами и способные к обмену на другие катионы (в частности, на ионы водорода).
В органических ионитах трехмерный каркас образован сеткой из углеродных атомов, с которыми ковалентно связаны, например, сульфо-, карбокси- или триметиламмоний-группы:
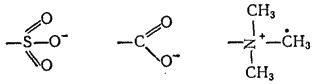
Рис. 97 иллюстрирует обмен катионов на H+ -форме катионита и обмен анионов на OH- -форме анионита.
Ионный обмен является обратимым процессом. Катионит как поливалентный электролит с валентностью x запишем схематично как Rx-. Тогда после внесения H+-формы катионита в раствор электролита, например, NaCl, установится равновесие:
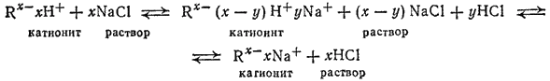
Максимальное количество ионов, которое поглощается обменным путем 1 г ионита, называют емкостью поглощения, или обменной емкостью.
- 315 -
Она достигает 6—10 мэкв/г. Ионообменное равновесие определяется природой ионита, гидратацией обменивающихся ионов, их концентрацией в фазе ионита и в растворе. Обмен разновалентных ионов зависит также от величины их заряда. Большой вклад в разработку теории и практики ионного обмена внес Б. П. Никольский.
Иониты широко используют для уменьшения жесткости воды и ее обессоливания (см. § 212), для выделения и разделения разнообразных неорганических и органических ионов. Ионный обмен используют в кожевенной, гидролизной, фармацевтической промышленности для очистки растворов, а также для удаления солей из сахарных сиропов, молока, вин. С помощью ионитов улавливают ионы ценных элементов из природных растворов и отработанных вод различных производств. Промышленное производство многих продуктов жизнедеятельности микроорганизмов (антибиотиков, аминокислот) оказалось возможным или было значительно удешевлено благодаря использованию ионитов. Применение ионного обмена позволило усовершенствовать методы качественного и количественного анализа многих неорганических и органических веществ.
К веществам, обладающим ионообменными свойствами, принадлежат некоторые марки стекол. Их структуру составляет силикатный каркас и электростатически связанные с ним катионы, способные к обмену на ионы водорода раствора. Из таких стекол изготовляют стеклянные электроды, обладающие свойствами водородного электрода (см. стр. 272). Стеклянные электроды применяют для определения pH растворов в условиях, когда пользование водородным электродом затруднительно или невозможно (например, в присутствии сильных окислителей). Разработаны также стекла, электродный потенциал которых определяется концентрацией ионов металлов, — например, иона натрия.
| <<< Назад 109. Сорбция и сорбционные процессы. |
Вперед >>> 111. Хроматография. |
- 105. Дисперсное состояние вещества.
- 106. Состояние вещества на границе раздела фаз.
- 107. Коллоиды и коллоидные растворы.
- 108. Дисперсионный анализ.
- 109. Сорбция и сорбционные процессы.
- 110. Ионообменная адсорбция.
- 111. Хроматография.
- 112. Электрокинетические явления.
- 113. Устойчивость и коагуляция дисперсных систем.
- 114. Структурообразование в дисперсных системах.
