Книга: От атомов к древу. Введение в современную науку о жизни
«Кирпичики», из которых состоит жизнь
| <<< Назад Разнообразие и единство |
Вперед >>> Аминокислоты и связи |
«Кирпичики», из которых состоит жизнь
Итак, мы видим, что аминокислоты, входящие в состав белков, построены по одной схеме. В любой из этих аминокислот есть карбоксильная группа и аминогруппа, присоединенные к центральному атому углерода (тому, который мы назвали альфа-атомом). Кроме того, к центральному атому углерода всегда присоединен атом водорода. Таким образом, из четырех валентностей альфа-углеродного атома три всегда заняты одними и теми же группами — карбоксильной, аминогруппой и атомом водорода. В этих частях молекул никакого разнообразия нет.
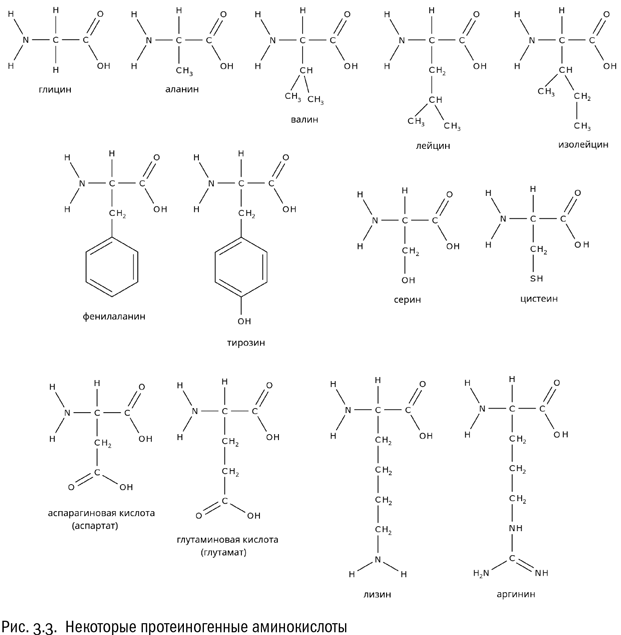
А вот четвертая валентность альфа-атома углерода занята изменчивой группой, которую мы для удобства назвали радикалом (?R). По ней-то аминокислоты и различаются (см. рис. 3.3).
Есть несколько аминокислот, у которых радикалы чисто углеводородные: аланин, валин, лейцин, изолейцин, фенилаланин. Две из них — лейцин и изолейцин — являются изомерами друг друга, потому так и названы. Они отличаются всего лишь положением одной метильной группы (?CH3). Чисто углеводородные радикалы плохо взаимодействуют с водой, но хорошо друг с другом. Иначе говоря, эти радикалы — гидрофобные.
Есть аминокислоты, у которых в состав радикала входит гидроксильная группа ?OH (серин, тирозин) или аналогичная ей, но содержащая вместо атома кислорода атом серы тиольная группа ?SH (цистеин). В таких радикалах есть полярные связи, а потому они взаимодействуют с водой гораздо лучше. Эти радикалы — гидрофильные.
Все аминокислоты, перечисленные нами до сих пор, называются нейтральными. Это означает, что в водном растворе их молекулы электрически не заряжены. Мы уже видели, что в любой аминокислоте есть карбоксильная группа, свойства которой кислотные, и аминогруппа, свойства которой, наоборот, основные (см. главу 1). Попадая в воду, карбоксильная группа отдает протон и становится заряжена отрицательно (?COO?), а аминогруппа присоединяет протон и становится заряжена положительно (?NH3+). Суммарный заряд молекулы аминокислоты в результате остается равным нулю. Это — нейтральная молекула.
А что, если карбоксильных групп две? Тогда эта аминокислота будет в растворе заряжена отрицательно. И действительно, в состав белков входит пара таких аминокислот — это аспарагиновая и глутаминовая кислоты. У них обеих есть карбоксильная группа не только при альфа-атоме, но еще и в радикале. И, соответственно, этот радикал несет дополнительный отрицательный заряд.
Для краткости аспарагиновую и глутаминовую кислоты часто называют, соответственно, аспартатом и глутаматом. Тут надо пояснить одну тонкость, связанную с названиями веществ. Аспартат и глутамат — на самом деле названия не кислот, а их анионов или (что то же самое) их солей. Например, глутамат — это соль глутаминовой кислоты. В биохимии этим сплошь и рядом пренебрегают, используя названия кислот и солей как синонимы. Ведь что такое соль? Это кислота, у которой на месте протона оказался любой другой катион. Если же она диссоциирована и не имеет никаких катионов вообще (а это бывает в растворах очень часто), то за ней обычно ради удобства оставляют название соответствующей соли. Именно это мы на примере аспартата с глутаматом и видим. Название соли — это название аниона, в виде которого молекула реально существует в воде.
Глутамат (будем отныне называть его так) интересен не только тем, что участвует в образовании белков. В организмах подавляющего большинства животных он служит еще и нейротрансмиттером, причем одним из важнейших. В нервной системе человека глутамат используют для передачи возбуждения примерно 40 % нейронов — это очень много! Почти все основные информационные потоки в нашем мозге идут посредством выделения глутамата, служащего для нервных клеток возбуждающим сигналом. Выше мы упоминали, что нейротрансмиттером является и еще одна протеиногенная аминокислота, а именно глицин (см. главу 1). Но действие глицина тормозящее (то есть успокаивающее), а глутамата — именно возбуждающее. Поскольку глутамат входит в состав каких угодно белков, то его очень много в пище, но пищевой глутамат в мозг почти не попадает — нервные клетки синтезируют его сами.
Кроме того, к глутамату очень чувствительна наша вкусовая система. Обычно считается, что есть пять основных вкусов, для которых на языке существуют отдельные типы рецепторов: соленый, кислый, сладкий, горький и выделенный в начале XX века вкус умами. Соленый — это вкус поваренной соли, кислый — протонов (H+), сладкий — сахаров. Горький вкус — самый сложный, он не привязан к какому-то одному классу молекул и возникает как реакция на любое вещество из большой и разнообразной группы зачисленных мозгом в «ядовитые», это эволюционно выработанный механизм защиты от токсичной пищи. Ну а умами — это не что иное, как вкус глутамата. Судя по всему, в ходе эволюции органов чувств позвоночных животных именно глутамат был выделен как индикатор вкуса белков (важнейших питательных веществ как-никак). Вот почему на языке для него есть особые рецепторы. Ощущение вкуса глутамата — это эволюционно выработанный сигнал о том, что в рот попало нечто белковое.
Глутамат часто добавляют в пищу, причем как в виде кислоты (пищевая добавка E620), так и в виде натриевой соли (пищевая добавка Е621). И раз уж мы заговорили об этом веществе, воспользуемся случаем, чтобы развеять несколько связанных с ним заблуждений. Может быть, кому-то пригодится.
Итак, во-первых, утверждение, что глутамат — усилитель вкуса, неточно. Выражение «усилитель вкуса» могло бы относиться к некоему (вымышленному) веществу без собственного вкуса и запаха, обладающему свойством обострять вкус любой еды. Глутамат этого не делает: у него просто есть свой вкус, точно так же, как у сахара или у соли. Механизмы восприятия вкуса глутамата и вкуса, допустим, того же сахара принципиально не отличаются друг от друга. Просто сахар воспринимается одними рецепторами, а глутамат — другими.
Во-вторых, неверно часто встречающееся мнение, будто «натуральный» глутамат (предположительно безобидный) — это совсем не то, что глутамат «искусственный» (предположительно вредный и опасный). Люди, которые так думают, просто не знают, о каком веществе идет речь. А мы с вами теперь знаем. Глутамат — это не какая-нибудь загадочная сложная смесь (состав которой действительно мог бы варьироваться), а одно-единственное химическое соединение, описываемое незатейливой формулой. Вот она, эта формула: HOOC–CH2?CH2?CH(NH2)?COOH. Только и всего. Глутамат, полученный искусственно, не отличается от полученного готовым из природных продуктов, потому что отличаться там нечему.
В-третьих, глутамат, получаемый с пищей, едва ли опасен для нервной системы прежде всего потому, что он в нее почти не проникает — это обеспечивается специальным физиологическим барьером. Нервные клетки синтезируют глутамат самостоятельно. К тому же в белковых продуктах (таких, как творог, мясо или соя) глутамата наверняка больше, чем попадает его в еду в качестве пищевой добавки, — просто потому, что это составная часть любых белков.
В-четвертых, на глутамат нет аллергии[28]. Аллергию вызывают чужеродные вещества, а не такие, которые жизненно необходимы и всегда присутствуют в организме в высоких концентрациях, — а глутамат как раз относится к последним.
Так что опасность глутамата — это, судя по всему, типичный современный миф.
Однако вернемся к другим аминокислотам. Если есть отрицательно заряженные аминокислоты, логично ожидать, что существуют и положительно заряженные. Это действительно так. Пример положительно заряженной аминокислоты — лизин, имеющий формулу NH2?CH2?CH2?CH2?CH2?CH(NH2)?COOH. Как видим, у лизина в радикале есть дополнительная аминогруппа, которая ведет себя так, как аминогруппе и положено: приобретает протон. Еще одна положительно заряженная аминокислота — аргинин, радикал которого включает довольно редкую (больше она нам нигде не встретится) гуанидиновую группу ?NH?C(NH) ?NH2, тоже охотно присоединяющую протон.
Таким образом, аминокислоты, из которых состоят белки, можно поделить на четыре категории: гидрофобные, гидрофильные нейтральные, положительно заряженные и отрицательно заряженные. Разумеется, все эти различия касаются только той части молекулы аминокислоты, которую мы назвали радикалом (R). «Базовая» часть (включающая атом углерода, атом водорода, карбоксильную группу и аминогруппу) во всех рассмотренных нами протеиногенных аминокислотах одна и та же. Особое положение занимает разве что самая простая из всех возможных аминокислот — глицин, у которого вместо радикала атом водорода.
| <<< Назад Разнообразие и единство |
Вперед >>> Аминокислоты и связи |
- § 67. Воздействие на организмы некоторых экологических факторов
- Глава 2.2. Формирование хищнического и охотничьего поведения у выращенных в неволе волков и некоторых других хищных живо...
- Беглый обзор некоторых жуков
- О некоторых отношениях живых существ к окружающему
- § 37 Миры, о которых мы знаем
- Миф № 1 Антропологами найдено очень мало (крайне фрагментарных) ископаемых находок, на базе которых дарвинисты строят св...
- Миф № 22 Синантропы – это просто обезьяны, которых съели люди
- Миф № 42 В древности, в верхнем палеолите, в Европе жили негроиды, которых потом сменили кроманьонцы-европеоиды
- 292. Существуют ли районы, в которых не бывает приливов?
- 567. Существуют ли рыбы, которых опасно употреблять в пищу?
- 970. Существуют ли в океане районы «мертвой воды», в которых застревают корабли?
- Смена мест зимовки у некоторых перелетных птиц
