Книга: От атомов к древу. Введение в современную науку о жизни
Ферменты
| <<< Назад Функции белков |
Вперед >>> «Белковая Вселенная» |
Ферменты
Начнем с простых определений. Вещество, ускоряющее химическую реакцию, но само не претерпевающее в ней стойких изменений, называется катализатором. А катализатор, являющийся белком, называется ферментом. Ускорять он может все что угодно. Все биохимические реакции идут не сами по себе, а с помощью ферментов. Например, даже такой предельно простой процесс, как слияние углекислоты (CO2) и воды (H2O) в молекулу угольной кислоты (H2CO3), все равно катализируется специальным ферментом — карбоангидразой, которая ускоряет его примерно в миллион раз. А для более сложных реакций ферменты тем более необходимы. Можно без особого преувеличения сказать, что ферменты контролируют в живом организме вообще все.
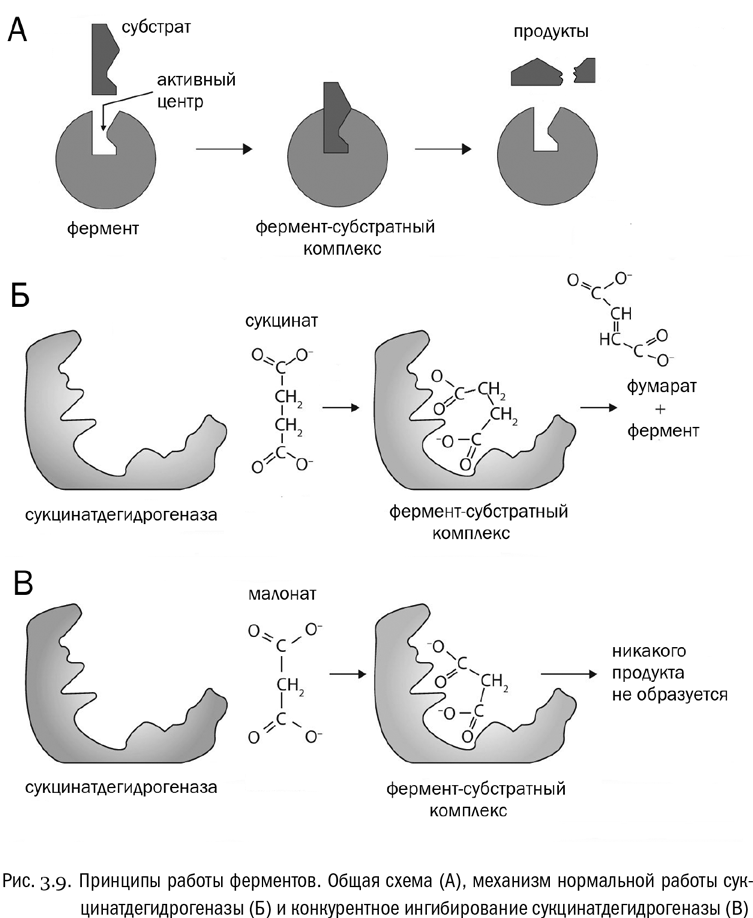
Вещество, являющееся исходным для той реакции, которую катализирует данный фермент, называется его субстратом. Молекула фермента должна войти в контакт с молекулой субстрата и подвергнуть ее некоему действию — например, расщепить надвое, или поменять в ней местами функциональные группы, или сшить что-нибудь ковалентной связью, или разорвать эту связь, — вариантов тут множество. Но в любом случае молекула фермента должна сначала захватить молекулу субстрата, а потом преобразовать ее и высвободить. Часть молекулы фермента, непосредственно контактирующая с молекулой субстрата, называется активным центром. Ферменты — это обычно довольно крупные белки, а в активном центре может быть всего-навсего несколько аминокислот. Поэтому, как правило, активный центр занимает только небольшую часть молекулы фермента (см. рис. 3.9А).
Если говорить совсем примитивно, активный центр — это такое гнездо в молекуле фермента, куда молекула субстрата должна войти, как ключ в замок. Как только она туда попадет, молекула фермента ее захватит и преобразует. Очевидно, что для этого конформация активного центра должна очень точно совпадать с очертаниями молекулы субстрата — в самом деле как замочная скважина с ключом. Это прямо так и называют «моделью ключа и замка». Правда, на самом деле активный центр фермента, в отличие от механизма замочной скважины, является скорее гибким, чем жестким. При взаимодействии с субстратом его конформация всегда меняется — примерно так, как меняется форма перчатки, когда ее надевают на руку. Модель работы ферментов, учитывающая это, называется «моделью индуцированного соответствия». Когда реакция завершается, конформация фермента возвращается к прежней.
Биофизики уверены, что во всех этих процессах молекула фермента действует как сложная механическая машина, имеющая множество шарниров, сочленений, поворачивающихся частей и т. п.[33] И это, конечно, впечатляет. «Самонадеянно скажет иной: „Сколочу-ка телегу!“ // Но ведь в телеге-то сотня частей! Иль не знает он, дурень?» — писал в поэме «Труды и дни» великий древнегреческий поэт Гесиод[34]. А ведь молекула любого фермента (пусть даже и небольшого) устроена намного сложнее гесиодовой телеги. Причем это будет верно, даже если мы станем рассматривать ее исключительно как механическую машину, игнорируя всю тонкую структуру атомного уровня.
Номенклатура ферментов довольно сложна, потому что их очень много. Но в большинстве случаев название фермента включает, во-первых, название его субстрата и, во-вторых, характерное окончание «-аза». Если мы видим где-то слово с таким окончанием, это наверняка название какого-нибудь фермента.
У термина «фермент» есть синоним. Это слово «энзим». Например, в английском языке ферменты называют почти исключительно энзимами (enzyme), и в русские переводы с английского это тоже иногда проникает. Но все-таки по-русски гораздо чаще говорят именно «фермент». На всякий случай запомним, что «фермент» и «энзим» — синонимы, и употребление одного из этих слов вместо другого большой ошибкой не будет.
Очень важное свойство ферментов — специфичность. Это значит, что каждый фермент приспособлен к одной строго определенной химической реакции. Субстрат должен точно подойти к его активному центру, иначе реакция не пойдет.
Например, фермент сукцинатдегидрогеназа захватывает молекулу янтарной кислоты (HOOC–CH2?CH2?COOH) и превращает ее в молекулу фумаровой кислоты (HOOC–CH=CH?COOH). Янтарная кислота при этом, как видим, теряет два атома водорода. Водород по-латыни «гидроген», а «дегидрогеназа» — фермент, его отнимающий. Субстратом же этого фермента является янтарная кислота. В растворе она диссоциирует, и от нее остается анион, который называется сукцинатом. Таким образом, сукцинатдегидрогеназа — это фермент, отнимающий водород у сукцината (см. рис. 3.9Б).
Однако возможна ситуация, когда на месте сукцината окажется малонат — анион малоновой кислоты, отличающейся от янтарной на один атом углерода (HOOC–CH2?COOH). Молекула малоната приблизительно подходит по форме к активному центру сукцинатдегидрогеназы и может его занять. Но поскольку соответствие все-таки неточное, никакой реакции в этом случае не произойдет (см. рис. 3.9В). Активный центр сукцинатдегидрогеназы будет просто заблокирован. Это называется конкурентным ингибированием. Конкурентное ингибирование — очень эффективный механизм «выключения» ферментов, на нем основано действие многих лекарств и ядов.
В активных центрах ферментов бывает очень полезным уже знакомое нам разнообразие аминокислот. Чтобы молекула субстрата встала на свое место и повела себя как надо, очертания активного центра должны быть под этот субстрат идеально подогнаны. Для этого где-то можно разместить гидрофобные карманы, образованные боковыми цепями аланина или валина, где-то — отрицательные заряды аспартата или глутамата, где-то — нейтральные гидрофильные аминокислоты, которые образуют с субстратом водородные связи, и так далее. Если, например, в субстрате есть положительный заряд, то в этом-то месте как раз и можно выставить отрицательно заряженный радикал какого-нибудь аспартата, чтобы электростатическим притяжением удержать молекулу субстрата в нужном положении. Таких примеров можно привести множество.
Интересно, что аминокислоты, оказывающиеся рядом в активном центре, запросто могут в первичной последовательности находиться очень далеко — например, за 300 остатков друг от друга. Их «правильное» взаимное расположение достигается за счет очень точного объемного сворачивания полипептидной цепи, то есть за счет третичной структуры. Можно представить, насколько сложной биохимической машиной является такой фермент! А между тем в типичной живой клетке ферментов несколько тысяч.
Любой фермент работает только в достаточно строго определенном диапазоне внешних условий — например, таких, как температура и кислотность. Если температура слишком высока, фермент может просто денатурировать, то есть потерять вторичную и третичную структуру. Понятное дело, что его активный центр при этом развалится. Если же слишком высока кислотность, это может повлиять на поведение радикалов некоторых аминокислот. Мы знаем, что кислотность — это концентрация протонов (H+). Если в растворе будет слишком много протонов, боковые цепи отрицательно заряженных аминокислот (аспартата и глутамата) волей-неволей присоединят их. Например, радикал глутамата, обычно имеющий вид ?CH2?CH2?COO?, в этом случае перейдет в состояние ?CH2?CH2?COOH. Отрицательный заряд в нем исчезнет, и он больше не сможет выполнять свою функцию в активном центре. Поэтому слишком высокая кислотность вредна. Живым организмам очень важно поддерживать постоянство своей внутренней среды не в последнюю очередь потому, что иначе работа ферментов разладится.
| <<< Назад Функции белков |
Вперед >>> «Белковая Вселенная» |
- Ферменты служат клетке
- Глава 21 Микробы и ферменты
- 2.5. Метаболизм: энергетический и пластический обмен, их взаимосвязь. Ферменты, их химическая природа, роль в метаболизм...
- Зачем нам нужны ферменты и как головастики теряют свои хвосты
- Ферменты: выбор между быстрым или мертвым
- Переварим гвозди (ферменты)
- 7. Виды метаболизма бактерий
- Рак и вирусы
- 2. Синегнойная палочка
- 3. Возбудители инфекций и их свойства
