Книга: О времени, пространстве и других вещах
Глава 15 Приветствую тебя, незнакомец
| <<< Назад Глава 14 Единица воздействия |
Вперед >>> Двадцать газов |
Глава 15
Приветствую тебя, незнакомец
В науке, как и везде, существует мода. Проведите необыкновенно успешный эксперимент, и у вас появится дюжина подражателей раньше, чем вы успеете об этом подумать.
Взять хотя бы химический элемент ксенон, открытый в 1898 году Уильямом Рамзаем и Моррисом Уильямом Траверсом. Как и другие элементы этой группы, он был изолирован от жидкого воздуха. О присутствии этих элементов в воздухе никто не подозревал на протяжении века, в течение которого велось активное исследование химического состава воздуха. Исследователи были немало удивлены, обнаружив странного незнакомца. Кстати, название ксенон произошло от греческого слова странный, не знакомый.
Ксенон принадлежит к группе элементов, называемых инертными газами (по причине их химической инертности). Их также называют редкими газами (они редко встречаются) или благородными газами (обособленное положение, которое они занимают по причине своей химической инертности, может показаться признаком особой значительности).
Ксенон — самый редкий из стабильных инертных газов и самый редкий из всех устойчивых химических элементов на Земле. Ксенон встречается только в атмосфере, где составляет 5,3 весовых единиц на миллион. Наша атмосфера весит 5 500 000 000 000 000 (5,5 квадриллионов) тонн, — это означает, что запас ксенона на планете 30 000 000 000 (30 миллиардов) тонн. На первый взгляд это много, но выделить атомы ксенона из огромного количества остальных составляющих частей атмосферы — весьма сложная задача. Поэтому ксенон не является обычным элементом и никогда таким не станет.
Да и в химических лабораториях ксенон вовсе не популярен. Его химические и физические свойства были определены, но что с ними делать дальше? Уже будучи открытым, ксенон долгое время оставался чужаком в семье химических элементов.
Но затем в 1962 году было объявлено о проведении необычного эксперимента с участием ксенона. И с тех пор ни один из номеров специальных химических журналов не обходится без статей о ксеноне.
Что же произошло?
Вы ждете быстрого и краткого ответа? Тогда вы плохо меня знаете. Я, как всегда, выберу свой любимый кружной путь и начну с того, что ксенон является газом.
Стать газом — это дело случая. Ни одно вещество не является газом от природы, просто иногда это диктуется температурными условиями. На Венере вода и аммиак — газы. На Земле аммиак — газ, а вода — жидкость. На Титане ни одно из этих веществ газом не является.
Далее мне потребуется некий критерий, который поможет в дальнейших рассуждениях. Пусть, например, любое вещество, остающееся в газообразном состоянии при -100 °C (-148° F), является Газом (с прописной буквы). Такая температура никогда не достигается на Земле даже в Антарктике, славящейся своими зверскими зимами, поэтому Газов на Земле нет, только газообразное состояния отдельных веществ (или полученных в химических лабораториях).
Тогда почему Газ — это Газ?
Для начала скажу, что любое вещество состоит из атомов или групп атомов, называемых молекулами. Между атомами или молекулами действуют силы притяжения, удерживающие их рядом. Тепло сообщает этим атомам или молекулам определенную кинетическую энергию, которая стремится оторвать их друг от друга, потому что каждый атом и молекула знают, куда им хотелось бы отправиться. (Поймите меня правильно, я вовсе не хочу сказать, что атомы знают, что делают, то есть обладают сознанием. Просто это мой телеологический[9] способ ведения беседы. И пусть телеология запрещена для использования в научных статьях, но… сладок именно запретный плод.)
Силы притяжения между определенными атомами или молекулами обычно постоянны, однако кинетическая энергия изменяется с изменением температуры. Поэтому, если температура поднимется достаточно высоко, любая группа атомов или молекул разлетится по сторонам и вещество станет газом. При температуре выше 6000 °C все известные вещества становятся газами.
Конечно, существует очень немного веществ, межатомные или межмолекулярные силы в которых настолько велики, что для их преодоления необходим нагрев до 6000 °C. У многих веществ они, напротив, настолько слабы, что тепло обычного солнечного дня сообщает достаточно энергии для перехода в газообразное состояние. Пример — обычный медицинский анестетик.
У других веществ силы межмолекулярного притяжения еще слабее, и для их поддержания в газообразном состоянии вполне достаточно тепла при температуре -100 °C. Они являются Газами, о которых я веду речь.
Межмолекулярные или межатомные силы возникают из-за распределения электронов в атомах или молекулах. Электроны распределены среди различных электронных оболочек, согласно системе, в подробности которой я вдаваться не буду. Например, атом алюминия содержит 13 электронов, распределенных следующим образом: 2 — во внутренней оболочке, 8 — в следующей, 3 — в наружной. Таким образом, распределение электронов в атоме алюминия можно обозначить следующим образом: 2,8,3. Внутренняя оболочка может содержать только 2 электрона, следующая — 8 электронов, а каждая из последующих может содержать больше 8 электронов. Если не считать ситуации, когда только внутренняя оболочка содержит электроны, у атомов в стабильном состоянии в наружной оболочке 8 электронов.
Известно шесть элементов, находящихся в состоянии максимальной стабильности.
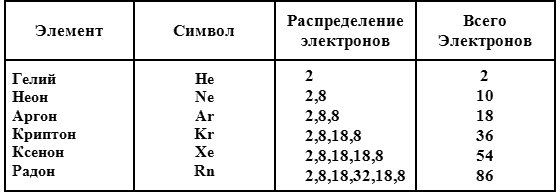
Другие атомы, где электроны распределены не так удачно, вынуждены пытаться достичь этого, захватывая дополнительные электроны или освобождаясь от имеющихся. В процессе этого они подвергаются химическим превращениям. Однако атомы шести перечисленных выше химических элементов не нуждаются в подобных ухищрениях. Они вполне самодостаточны. У них нет необходимости в перемещении электронов, поэтому они не принимают участия в химических реакциях и являются инертными. (По крайней мере, именно это я заявил бы до 1962 года.)
Атомы семейства инертных газов являются настолько самодостаточными, что эти атомы даже игнорируют друг друга. Между ними существует очень слабое притяжение, и эти вещества остаются газами при комнатной температуре. Все, кроме радона, являются Газами.
Какое-то притяжение между атомами, конечно, существует (в природе нет атомов или молекул, между которыми притяжение отсутствует вообще). Если некоторое время понижать температуру, наступит момент, когда силы притяжения возобладают над разрушительным действием кинетической энергии, и инертные газы станут инертными жидкостями.
А как обстоят дела с другими элементами? Как я уже говорил, в их атомах электроны распределены так, что обеспечивают устойчивость ниже максимальной. Каждый обладает тенденцией к перераспределению электронов в сторону увеличения устойчивости. Например, в атоме натрия Na электроны распределены следующим образом: 2,8,1. Избавившись от электрона во внешней оболочке, он приобрел бы устойчивое распределение 2,8, как у атома неона Ne. Атом хлора Cl имеет распределение 2,8,7. Если бы он смог приобрести один электрон во внешнюю оболочку, получился бы вполне устойчивый атом 2,8,8 — такое распределение электронов у инертного аргона.
Следовательно, если атом натрия встретится с атомом хлора, перенос электрона из одного атома в другой устроит обоих. Однако потеря отрицательно заряженного электрона оставляет атом натрия с дефицитом отрицательного заряда, что создает избыток положительного заряда. Атом превращается в положительно заряженный ион (Na+). Атом хлора, получивший дополнительный электрон, приобрел избыточный отрицательный заряд и стал отрицательно заряженным ионом (Cl-).
Разноименные заряды притягиваются, поэтому ионы с разными зарядами окажутся притянутыми друг к другу. Сильное притяжение не может быть преодолено кинетической энергией, которой обладают атомы при комнатной температуре, поэтому ионы держатся друг за друга достаточно крепко, чтобы образовавшееся вещество NaCl — обычная поваренная соль — было твердым. Оно не переходит в газообразное состояние до достижения температуры 1413 °C.
Теперь рассмотрим атом углерода. Распределение электронов — 2,4. При потере 4 электронов он мог бы приобрести устойчивую конфигурацию 2, как в атоме гелия. При приобретении 4 электронов конфигурация стала бы 2,8, как в атоме неона, тоже устойчивая. Приобрести или избавиться от такого количества электронов сразу весьма непросто, поэтому атом углерода предпочитает понемногу делиться своими электронами. Он может выделить один электрон в совместное пользование своему соседу, который также отдаст для этой цели один электрон. В результате у двух соседних атомов углерода два электрона будут общими. Другой электрон можно выделить для совместного владения с другим соседом и т. д. Поэтому каждый атом углерода обычно окружен четырьмя другими.
Эти электроны совместного пользования помещаются во внешней оболочке каждого атома углерода, внесшего свою долю. Каждый атом углерода имеет во внешней оболочке четыре собственных электрона и четыре заимствованных от соседей (по одному от каждого). Таким образом, каждый атом углерода имеет конфигурацию неона 2,8, являющуюся устойчивой, но только оставаясь очень близко к соседям. Результатом является сильное межатомное притяжение даже без участия разноименных электрических зарядов. Углерод — твердое вещество и переходит в газообразное состояние только при нагревании выше 4200 °C.
Атомы металлов также очень плотно прилегают друг к другу (по аналогичным причинам), и, к примеру, вольфрам переходит в газообразное состояние только при достижении температуры 5900 °C.
Таким образом, мы вряд ли можем ожидать появление Газа, если атомы достигают устойчивости, передавая друг другу электроны и получая электрический заряд или делясь электронами с соседями, в результате чего атомы «склеиваются» друг с другом.
Нам необходимо нечто среднее — ситуация, когда атомы приобретают устойчивость, делясь электронами (чтобы не возникало электрических зарядов), но при этом общее количество атомов, вовлеченных в этот процесс, было бы небольшим, чтобы в результате образовывались только очень маленькие молекулы. Внутри молекул силы притяжения могут быть весьма значительными, в результате чего молекулы будут распадаться только при очень высоких температурах. А вот силы притяжения между молекулами будут слабыми.
Давайте рассмотрим атом водорода. Он имеет только один электрон. Два атома водорода объединяются вместе и пользуются ими совместно. Пока они остаются вместе, каждый может считать два электрона находящимися в своей внешней оболочке и будет иметь стабильную конфигурацию атома гелия. У них больше нет в запасе электронов, чтобы отдавать в совместное пользование с другими соседями. Поэтому образование молекулы на этом завершится. Молекула водорода состоит только из двух атомов (H2).
Сила притяжения между атомами в молекуле велика, поэтому, чтобы разбить ее на атомы, понадобится температура более 2000 °C. Но между отдельными молекулами, каждая из которых после объединения двух атомов стала вполне самодостаточной, существует лишь слабое притяжение. Поэтому водород — Газ, но состоящий не из отдельных атомов (как в случае с инертными газами), а из двухатомных молекул.
Подобное происходит и с фтором (распределение электронов 2,7), кислородом (2,6), азотом (2,5). Атом фтора может отдать электрон и образовать фонд совместного пользования из двух электронов с соседним атомом фтора, который также поделится электроном. Два атома кислорода могут внести вклад из двух электронов каждый и образовать совместный фонд из четырех электронов, а два атома азота могут отдать каждый по три электрона и совместно пользоваться шестью электронами.
Во всех случаях атомы достигнут распределения электронов 2,8 (как у атома неона) ценой образования молекул. В итоге достигается достаточная устойчивость; F2, O2, и N2 являются Газами.
Атом кислорода может также образовывать совместный фонд из двух электронов с двумя соседями, которые также могут образовать такой же фонд из двух электронов между собой. Результатом явится комбинация трех атомов кислорода (O3), каждый из которых имеет устойчивую конфигурацию неона. Комбинация O3 называется озоном. Это тоже Газ.
Кислород, азот и фтор могут образовывать также смешанные молекулы. К примеру, комбинация атомов азота и кислорода даст необходимую стабильность для каждого из них. Атом азота также может делиться электронами с каждым из трех атомов фтора, а атом кислорода — с двумя. В результате получается NO, NF3 и OF2. Все они являются Газами.
Атомы, сами по себе не образующие Газы, могут сделать это в комбинации с водородом, кислородом, фтором или азотом. К примеру, два атома хлора (распределение электронов 2,8,7), объединяясь в молекулу, пользуются двумя электронами совместно, и оба приобретают конфигурацию аргона 2,8,8. Cl2, — это газ даже при комнатной температуре, однако межмолекулярное притяжение в нем достаточно велико и не дает ему стать Газом. Однако, если атом хлора поделится электроном с атомом фтора, получится фторид хлора (ClF), являющийся Газом.
Атом бора (2,3) может образовывать совместный фонд из двух электронов с каждым из трех атомов фтора, а атом углерода — с каждым из четырех атомов фтора. Получившиеся в результате соединения — BF3 и CF4 — Газы.
Атом углерода может вступить в совместное пользование двумя электронами с каждым из четырех атомов водорода или четырьмя электронами с атомом кислорода. Получившиеся в результате метан CH4 и окись углерода CO — газы. Комбинация из двух атомов углерода (четырьмя электронами они владеют совместно) могут начать совместное пользование двумя электронами с каждым из четырех атомов водорода, атом кремния — соответственно двумя электронами с каждым из четырех атомов водорода. Получившиеся в результате этилен (C2H2) и силан (SiH4) — Газы.
Всего я могу назвать 20 Газов, которые можно разделить следующим образом.
1) Пять элементов, состоящих из одиночных атомов: гелий, неон, аргон, криптон и ксенон.
2) Четыре элемента, состоящие из двухатомных молекул: кислород, азот, водород, фтор.
3) Один элемент, имеющий трехатомную молекулу, — озон.
4) Десять веществ, молекулы которых состоят из различных элементов, по крайней мере один из них входит в категорию 2.
В приведенной далее таблице перечислены 20 газов в порядке повышения точки кипения, а температура кипения дана как по шкале Цельсия, так и по шкале Кельвина.
Пять инертных газов разбросаны среди других Газов. Кстати, два из трех Газов, имеющих самую низкую точку кипения, — это гелий и неон. Аргон в списке идет седьмым, криптон — десятым, а ксенон — семнадцатым. Поэтому, наверное, не стоило бы удивляться, если бы все Газы были также инертными.
| <<< Назад Глава 14 Единица воздействия |
Вперед >>> Двадцать газов |
