Книга: Логика случая. О природе и происхождении биологической эволюции
Изучение эволюции белковых доменов дает аргументы в пользу сложного мира РНК: взгляд сверху вниз
| <<< Назад Цикл Дарвина – Эйгена |
Вперед >>> Рибозимы и мир РНК |
Изучение эволюции белковых доменов дает аргументы в пользу сложного мира РНК: взгляд сверху вниз
Как уже упоминалось выше, система трансляции – единственный сложный ансамбль генов, сохранившийся во всех современных клеточных формах жизни. Современная трансляционная система, содержащая около 60 универсальных белок-кодирующих генов и 40 генов структурной РНК, представляет собой наилучшим образом сохранившийся остаток LUCA(S) и лучшее свидетельство того, что в какой-то форме LUCA(S) действительно существовал (см. гл. 11). В силу исключительной консервативности системы трансляции анализ ортологических последовательностей дает крайне мало для понимания ее происхождения, которое находится за горизонтом сравнения современных форм. Реконструкция генного состава LUCA(S) указывает на сложную трансляционную систему, включающую по меньшей мере 18 из 20 аминоацил-тРНК-синтетаз (АРСаз), несколько факторов трансляции, не менее 40 рибосомных белков и некоторое число ферментов, модифицирующих рРНК и тРНК. По-видимому, у LUCA(S) ядро системы трансляции было уже полностью сформировано (Anantharaman et al., 2002).
Однако сравнение последовательностей и структур белковых компонентов и РНК внутри самой системы трансляции оказывается информативным благодаря большому числу паралогов среди соответствующих генов. Когда в реконструированном генном наборе LUCA(S) обнаруживается пара паралогичных генов, давшая ей начало дупликация, естественно, относится к более ранней стадии эволюции, и, таким образом, реконструкция последовательности древнейших дупликаций позволяет взглянуть на очень ранние этапы эволюции. История паралогичных АРСаз особенно показательна. АРСазы образуют два класса по 10 специфичностей каждый (то есть каждый класс отвечает за распознавание и активацию 10 аминокислот), с неродственными каталитическими доменами и различными наборами вспомогательных доменов. Каталитические домены АРСаз классов I и II принадлежат, соответственно, к укладкам Россмана и биотин-синтазы[126]. Анализ эволюционной истории этих белковых укладок приводит к существенным выводам o ранней эволюции трансляционных систем, и не только об этом (Aravind et al., 2002). Каталитические домены АРСаз класса I образуют лишь небольшую ветвь эволюционного древа доменов укладки Россмана. Таким образом, появлению общего предка АРСаз предшествовало множество ветвлений эволюционного пути от примитивного древнего домена к состоянию с высоким разнообразием, соответствующему LUCA(S). Существенное разнообразие доменов укладки Россмана возникло еще до серии дупликаций, приведших к возникновению, еще до эпохи LUCA(S), АРСаз различных специфичностей (см. рис. 12-2а). Подобная эволюционная картина обнаруживается и при анализе домена биотин-синтазы, давшего начало АРСазам класса II. Даже при рассмотрении только этих двух укладок становится очевидно, что огромное структурное и функциональное разнообразие белковых доменов возникло еще до того, как появилась полноценная, состоящая из РНК и белков система трансляции современного типа.

Рис. 12-2а. Разнообразие белковых доменов, кристаллизация системы трансляции и LUCA(S): эволюция нуклеотид-связывающих доменов укладки Россмана. Указаны только достаточно хорошо изученные белки. USPA – универсальный фактор стресса А; ETFP – электронтранспортный флавопротеин; vWA – фактор фон Виллебранда А; Toprim – каталитический домен топоизомераз, праймаз и некоторых нуклеаз; ДГК – дегалогеназа галоидных кислот; Receiver – компонент двухкомпонентной сигнальной системы прокариот; TIR – широко распространенный домен белок-белкового взаимодействия в сигнальных системах прокариот и эукариот; Sir2—деацетилаза белков (в частности, гистонов). Подробное описание см. Aravind et al., 2002 и ссылки в этой статье.
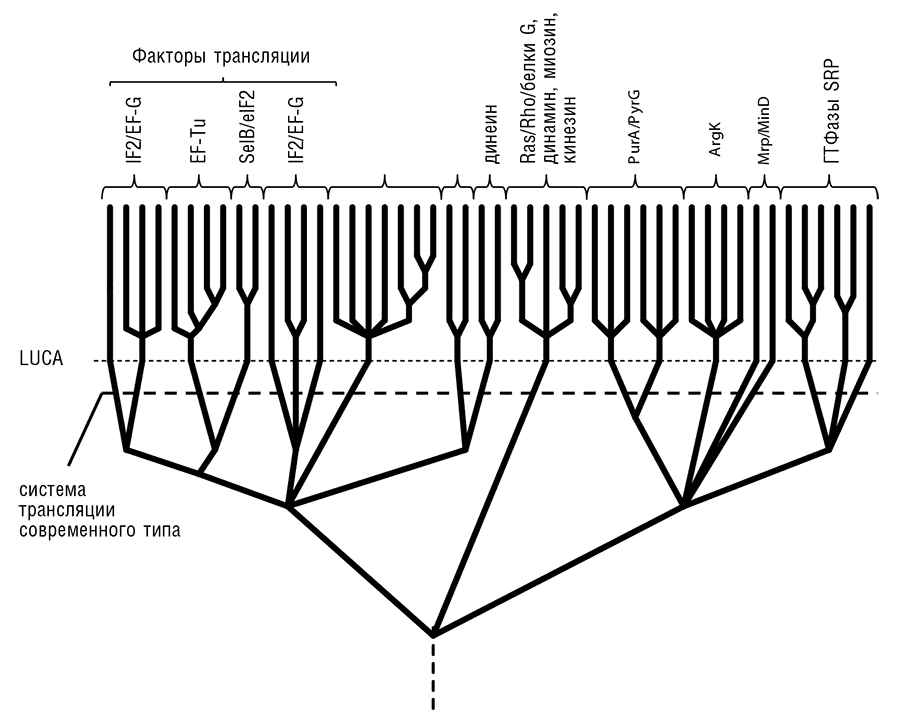
Рис. 12-2б. Эволюция нуклеотид-связывающих доменов ГТФаз и родственных им АТФаз, по данным из Leipe et al., 2002. Указаны только хорошо изученные белки. Динеин, динамин, кинезин и миозин – моторные ГТФазы и АТФазы, ассоциированные с цитоскелетом; Ras/Rho – сигнальные ГТФа-зы, ассоциированные, в частности, с эндомембранной системой эукариот; G-белки – ассоциированные с мембраной ГТФазы, функционирующие совместно с G-белок-сопряженными рецепторами; PurA и PyrG – ферменты метаболизма нуклеотидов; ArgK, аргинин-киназа, – фермент метаболизма аминокислот; Mrp и MinD – АТФазы, участвующие в клеточном делении прокариот; SRP – частица узнавания сигналов.
Эволюционный анализ обширнейшего класса фосфат-связывающих доменов (известных также как P-петли) ГТФаз, в котором множество трансляционных факторов образует компактные семейства, приводит, в сущности, к тому же результату: в последовательности эволюционных бифуркаций (ветвлений эволюционного древа), представляющей историю ГТФазного домена, трансляционные факторы также возникли сравнительно поздно (см. рис. 12-2а; Leipe et al., 2002). ГТФазы образуют лишь одну из многих больших ветвей эволюционного древа укладки, содержащей Р-петлю, которая включает огромное разнообразие белковых доменов, связывающих НТФ (нуклеозидтрифосфаты – чаще всего субстратом является АТФ, гораздо реже ГТФ и изредка – другие НТФ) и расщепляющих ?-?-фосфодиэфирную связь (см. рис. 12-2б). Эта укладка является самым распространенным доменом во всех прокариотах (Wolf et al., 1999b), и во всех реконструкциях генетического разнообразия LUCA(S) выявляется несколько десятков содержащих Р-петлю белков. Таким образом, интенсивная эволюция домена, содержащего Р-петлю, предшествовала не только LUCA(S), но и, что еще более удивительно, современной системе трансляции. Сама Р-петля (известная также под названием мотива Уолкера A[127], рис. 12-3), богатая глицином петля, оборачивающая фосфатный конец НТФ-субстрата, является наиболее консервативным мотивом среди всех белковых последовательностей, несомненно зафиксированным на самых ранних стадиях белковой эволюции (Gorbalenya and Koonin, 1989; Trifonov et al., 2006).
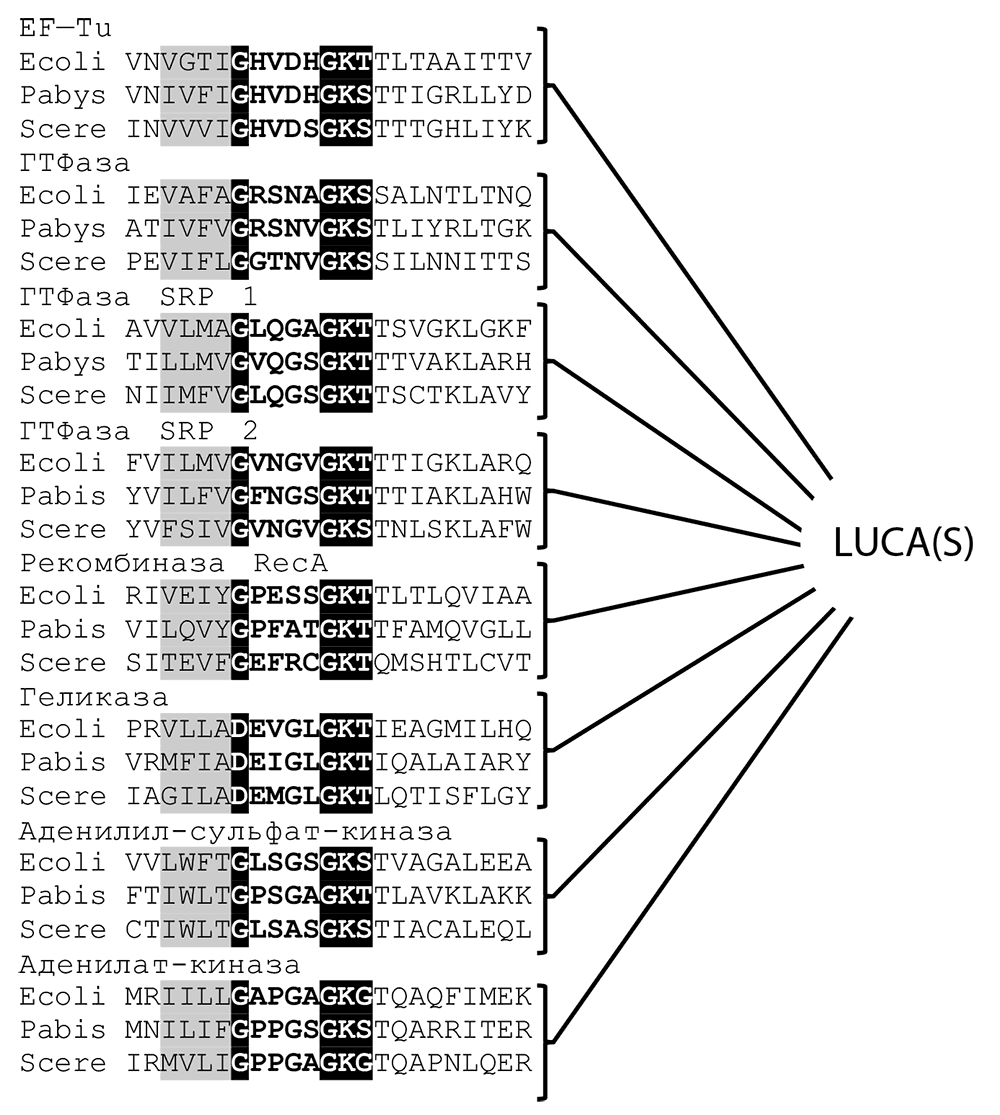
Рис. 12-3. Р-петля, древнейший и самый распространенный в белковых последовательностях мотив. На рисунке изображено выравнивание Р-петель восьми древних НТФаз, каждая из которых, по данным эволюционных реконструкций, была представлена в LUCA(S) (Mirkin et al., 2003). Для каждой линии представлены три последовательности: бактерии (Escherichia coli, Ecoli), археи (Pyrococcus abyssi, Pabys) и эукариота (дрожжи Saccharomyces cerevisiae, Scere). Белыми буквами на черном фоне обозначены аминокислотные остатки, напрямую взаимодействующие с фосфатным концом НТФ, а серым фоном – характерная гидрофобная ?-последовательность, предшествующая ФСП. SRP – частица узнавания сигналов.
Таким образом, из сравнительного анализа древних паралогических отношений между белковыми компонентами системы трансляции следует бесспорный, хоть и парадоксальный, вывод: за интересным исключением основных рибосомных белков, все белки, играющие главную роль в современной трансляции, возникли в результате долгой и сложной эволюции различных белковых доменов. Возникает замкнутый круг: для возникновения этих белков требуется точная и эффективная система трансляции. Древняя система трансляции могла быть и не столь совершенной, как современная, но несомненно, что она отличалась от нее не более чем на порядок по точности и скорости, иначе белковая эволюция не стала бы возможной. Однако из всего, что нам известно о современной системе трансляции, такой уровень точности невообразим без сложного и специализированного белкового аппарата.
Итак, система трансляции ярко высвечивает парадокс Дарвина – Эйгена, присущий любому анализу возникновения сложных биологических систем: для работы эффективной и точной системы трансляции современного типа требуется множество различных белков, но для того, чтобы эти белки могли возникнуть, нужна система трансляции почти столь же совершенная, как современная. По-видимому, существует только одно возможное разрешение этого парадокса, а именно через отказ от первой части противопоставления: следует заключить, что трансляционная система, сравнимая с современной по точности и скорости, работала в отсутствие значительного разнообразия белков и, возможно, вообще без белков. Таким образом, основываясь на сравнительном анализе составных частей системы трансляции, мы должны сделать предположение о существовании сложного и разнообразного мира РНК, в котором уже действовала некая разновидность цикла Дарвина – Эйгена.
Это не все, что может нам дать сравнительный анализ: сравнение самих РНК также вскрывает важные явления и загадывает поразительные загадки. Так, анализ большой рибосомной субъединицы РНК 23S выявил иерархический сценарий последовательности дупликаций, способной привести от простой древней шпильки РНК к современной, сложной, универсально консервативной структуре рРНК (Bokov and Steinberg, 2009).
Консерватизм структуры определенных элементов последовательностей (таких как псевдоуридиновая петля) и даже сайтов модификации тРНК всех специфичностей (и, разумеется, всех видов) не оставляет сомнений в том, что все они эволюционировали от общего предка (Eigen et al., 1989). Отсюда, при сравнении современных последовательностей и структур, возникает второй парадокс эволюции трансляции. Если на некоторой стадии эволюции существовал единственный предок тРНК всех специфичностей, то как могла подобная трансляционная система действовать, точнее, как она могла обеспечивать специфичность кодирования аминокислотных последовательностей нуклеотидными? Если же на этом этапе трансляционной системы еще не существовало, то что привело к эволюции специфичной к аминокислотам тРНК?
Мы обратимся к этим и смежным вопросам ниже, но сначала следует хотя бы кратко рассмотреть центральное понятие в области исследования происхождения жизни: мир РНК.
| <<< Назад Цикл Дарвина – Эйгена |
Вперед >>> Рибозимы и мир РНК |
- Глава 5 Человек – эволюция: в чью пользу счет?
- Глава 1. Теории прогрессивной эволюции
- ГЛАВА 6. ЖЕРТВЫ ЭВОЛЮЦИИ
- Семейные отношения — ключ к пониманию нашей эволюции
- Глава V ПОНЯТИЕ ОБ ЭВОЛЮЦИИ. ПАЛЕОНТОЛОГИЧЕСКАЯ ЛЕТОПИСЬ
- Глава 3. Факторы микроэволюции
- Поиск и изучение нуклеиновых кислот
- Изучение физиологии мозолистого тела
- Y-хромосома – двигатель эволюции
- Изучение ритмов у живых организмов (кроме человека)
- Глава 6. Направленность эволюции
- Пути эволюции предопределены на молекулярном уровне
