Книга: Химия - просто
Глава 4. Флогистон пал. Что дальше?
| <<< Назад Глава 3. Флогистон и фанат Ломоносова |
Вперед >>> Глава 5. Либих. Изгой один |
Глава 4. Флогистон пал. Что дальше?
Теория флогистона пала, Лавуазье заложил фундамент новой химии, но сам при этом был повержен и обезглавлен. Что же дальше?! Приняли ли современники Лавуазье его теории как руководство к действию? Вняли ли его умозаключениям, чтобы продолжить развивать науку? Нашлись ли среди них последователи его учения?
Увы, учение Лавуазье было принято не сразу. Выдающиеся учёные того времени не смогли быстро отказаться от флогистона, новая теория их пугала.
Ещё при жизни Антуану Лавуазье удалось издать учебник по химии, основанный на новой теории, а после его смерти дело учёного продолжила его жена (точнее, вдова). Задавшись целью ознакомить мировое сообщество с научными трудами покойного мужа, женщина обратилась к выдающимся деятелям того времени с просьбой помочь ей издать его сочинения посмертно, но они, опасаясь гнева стоявших у власти республиканцев, отказались. Тогда она сама опубликовала дневник Лавуазье, хотя делом это оказалось непростым (а Интернета, как ты понимаешь, ещё не изобрели). Спустя несколько лет женщина вышла замуж за английского физика графа Румфорда (впервые экспериментально доказавшего превращение работы в теплоту), но после 4 лет супружества развелась с ним и полностью погрузилась в общественную жизнь.
Основные принципы бессмертного учения Лавуазье:
общий вес вещества всегда больше веса любой составной его части;
суммарный вес всех веществ, участвующих в какой-либо химической реакции, в ходе этой реакции не меняется.
Это для нас с тобой данные тезисы кажутся сейчас понятными и само собой разумеющимися, а каких-то 250 лет назад многие считали их неубедительными и не спешили соглашаться с ними.
Тем не менее вскоре в науке прочно укоренится понятие элемента как тела, вес которого при каком-либо химическом превращении остаётся неизменным.
Среди известных тогда элементов особое место занимал кислород, способный поддерживать горение и соединяться со всеми элементами. Все же остальные элементы были поделены на два класса: металлы и неметаллы. Число известных металлов увеличилось. Так, к благородным добавилась платина.
Название «платина» происходит от испанского слова «плата», что переводится как «серебро». Впервые платина была обнаружена в Америке, в золотом песке реки Пинто. В 1741 году её впервые доставили в Европу, но поскольку сразу все свойства распознать не смогли, интерес к ней на время угас. Когда же учёные всё-таки изучили уникальные свойства платины — устойчивость к высоким температурам (не окисляется при нагревании) и химическим реагентам, — она нашла широкое применение в химической промышленности.
Использование платины при работе с серной кислотой

Платина
Увеличилось число и неблагородных металлов: к известным с начала XIX века цинку, олову, меди, свинцу, мышьяку, сурьме и висмуту добавились хром, молибден, марганец, кобальт и никель. Хром был открыт на Среднем Урале, в Березовском золоторудном месторождении. Впервые М В. Ломоносов упоминал о нём в своём труде «Первые основания металлургии» (1763 г.) как о «красной свинцовой руде» (PbCrO4). Кстати, если покопаться в инструментах отца или деда, наверняка удастся найти среди них гаечный ключ из хром — ванадиевого сплава.
Из неметаллов уже были известны газы водород и азот, а также углерод, сера и фосфор. К ним же отнесли и теллур, так как в природе он сопутствовал сере. Эти элементы назвали металлоидами.


И только кислород, как я уже сообщил выше, не относили ни к металлам, ни к неметаллам. Среди всех известных элементов он стоял особняком.
В 1819 году шведский химик Йёнс Якоб Берцелиус (1779–1848) выдвинул электрохимическую теорию химических соединений, которая господствовала потом в химии на протяжении целых 50 лет. Берцелиус приписал каждому элементу электрический заряд — положительный или отрицательный. Например, в кислороде преобладает отрицательный заряд, а в металлах — положительный. На основании этой его теории (она известна под названием «дуалистическая») была создана система химических тел, при помощи которой удалось описать все факты неорганической химии. Однако когда эта теория столкнулась с несоответствующими фактами органической химии, ей на смену пришла другая теория — «унитарная». Последняя утверждала, что все химические тела являются соединениями выше перечисленных элементов.

Йёнс Якоб Берцелиус
Также следует отметить, что именно в то время в химии появляются такие понятия, как «основания» и «кислоты». Слышал выражение: «Крайности сходятся»? Вот подобно тому, как зарождается любовь между двумя людьми с противоположными характерами, так и тогдашние знатоки химии считали, что для возникновения «взаимной любви» двух элементов необходима противоположность характеров этих элементов. И мы с тобой знаем: при взаимодействии кислоты и основания выделяется тепло, а полученный раствор становится нейтральным.
Не вдаваясь в подробности, которые могут погрузить тебя в сон, скажу лишь, что антифлогистонское учение смогло объединить все известные элементы в простую и относительно целостную систему, а заодно и предсказать появление ещё неизвестных на тот момент элементов. Таких, например, как щелочные и щелочноземельные металлы. Ведь хорошо были известны соединения кислорода, которые назывались окислами. Это были обычные земли из различных месторождений. Учёные прекрасно видели, что они одинаково взаимодействуют с кислотами. Пока их не могли разложить на элементы, поэтому были признаны кислородными соединениями воображаемых металлов, которые получили названия: калий, натрий, кальций, стронций, барий, алюминий и магний.
Их реальному открытию поспособствовали, кстати, физики. В 1791 году учёный мир был потрясён открытием болонского врача по имени Луиджи Гальвани (1737–1798), который описал электрические явления, замеченные им совершенно случайно. Гальвани препарировал в своей лаборатории лягушку, а его ассистент прикасался электродами к её мышцам. Заметив, что мышцы сокращаются, Гальвани пришёл к выводу, что животные состоят из особого рода электрической жидкости. Он назвал это явление «животным электричеством». (К счастью учёного, в те времена не было обществ по защите животных, которые могли бы помешать научным исследованиям. Хотя лягушек, конечно, жалко, ведь для изучения сущности этой «жидкости» их было изведено немерено.)

Луиджи Гальвани

То, что это явление не имеет никакого отношения ни к лягушкам, ни к каким — либо другим животным, заметил позднее Александр Вольт (1745–1827). Он доказал, что электрический ток возникает всякий раз, когда два различных металла приходят в соприкосновение с какой-либо жидкостью. Наглядным подтверждением его вывода служит так называемый «вольтов столб», который можно собрать даже в домашних условиях. Для этого нужно взять медные монеты и цинковые обрезки (например, от оцинкованного ведра), и сделать из них подобие слоёного бутерброда, чередуя медь с цинком. Каждый слой меди и цинка следует отделить от следующего слоя меди и цинка, проложив между ними какую — нибудь тряпочку, смоченную в солёной воде. Если теперь к концам вольтова столба ты прикрепишь медные провода и попробуешь их сблизить, то увидишь искры.

Александр Вольт
Исследования Александра Вольта вызвали сильный интерес в обществе. Наполеон Бонапарт, бывший тогда консулом французской республики, даже поспособствовал учреждению в Париже «Гальванического общества», целью которого было содействовать и поощрять исследователей гальванических явлений.
Гальванизм тут же вошёл в Европе в моду. Любой, у кого были серебряные и медные монеты, не отказывал себе в удовольствии построить вольтов столб. С этим столбом проделывали различные манипуляции и применяли его для различных целей. (Напоминает нынешнюю ситуацию с колой и ментосом.)

«Вольтов столб»
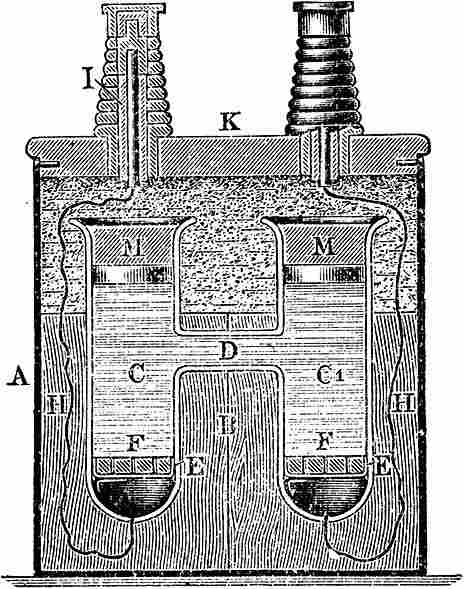
Уэстонская гальваническая ячейка
Гальванизму приписывали всевозможные лечебные свойства: глухонемым он якобы возвращал слух, обычных людей якобы награждал способностью чувствовать металлы… Одним словом, шарлатаны, как всегда, первыми взяли на вооружение очередное научное достижение, чтобы использовать его в своих меркантильных целях.
К счастью, были среди людей того времени и те, кто увлёкся изучением гальванизма всерьёз. И здесь нельзя не вспомнить о сэре Гемфри Дэви (1778–1829), английском физике и электрохимике. Дэви родился в бедной семье (довольно частый фактор в биографиях великих учёных, ты заметил?) в маленьком городке Пензансе. Во всех местных домах пол был посыпан песком, и вряд ли хоть в одном нашлась бы серебряная ложка. После смерти отца Дэви пошёл учиться к хирургу. Латинский и греческий языки он терпеть не мог ещё со школы, зато с большим увлечением занимался фейерверками. Благодаря работе у хирурга Дэви получил доступ к различным химическим реактивам, а попутно и приобрёл опыт работы с ними.

Гемфри Дэви
Со временем Дэви обзавёлся друзьями, которые помогли ему занять высокую должность инспектора в Бристольском Пневматическом институте. Там он продолжил заниматься всевозможными опытами и даже подвергал себя воздействию различных газов, причём один раз чуть не отравился угарным газом. Кстати, именно Дэви открыл так называемый «веселящий газ» (закись азота), который впоследствии стал применяться зубными врачами для анестезии.
Лампа Г. Дэви
Столкнувшись с явлением электричества, Дэви понял, что его можно использовать для разложения сложных тел на простые. Особое внимание он уделил опытам разложения веществ, которые до этого не удавалось разложить на элементы.
Первые опыты Гемфри Дэви были связаны с разложением воды. Затем он принялся за разложение земель, окислов ещё не открытых элементов, о которых я говорил ранее. Опыты прошли успешно: путём электролиза Дэви получил металлические натрий, калий, кальций, стронций, барий и магний. Да-да, в одиночку — столько элементов!
Затем он принялся за электролиз кислот. С борной кислотой дело пошло легко, и Дэви получил бор, который за несколько лет до этого открыли Жозеф Луи Гей-Люссак и Луи Жак Тенар. Далее он взялся за электролиз окиси мурия. Тогда считалось, что из окиси мурия и водорода состоит соляная кислота. Считалось также, что все кислоты содержат кислород. Однако успехом попытки учёного не увенчались: всякий раз вместо мурия он получал хлор. На основании этого Дэви и несколько других химиков того времени пришли к мнению, что хлор — это и есть окись мурия, причём что она является отдельным элементом, то есть неразложимым телом. Это привело их к выводу, что существуют кислоты, не содержащие кислорода. Благодаря такому заключению кислород стал терять господствующее положение, присвоенное ему Антуаном Лавуазье.
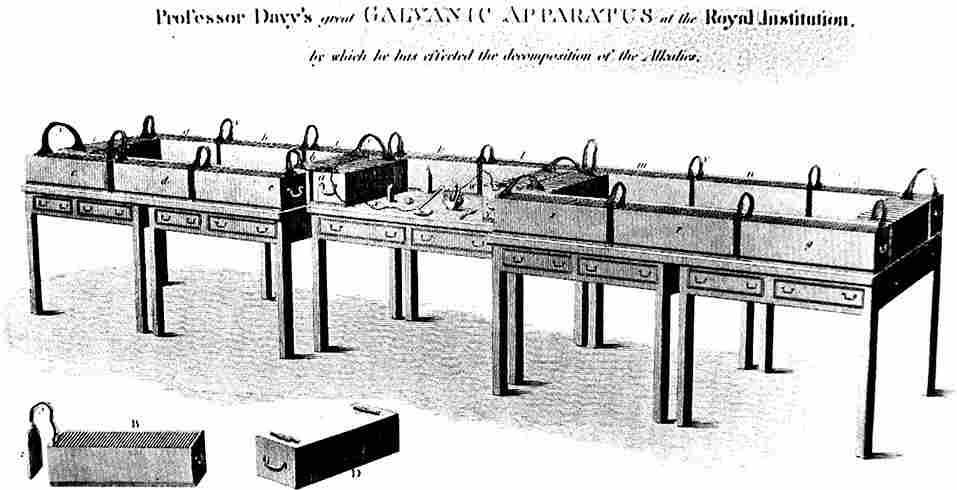
Аппарат Г. Дэви
Работы и открытия Гемфри Дэви усилили интерес широких масс к естественным наукам, благодаря чему в начале XIX века в Лондоне был учреждён Королевский институт, предназначенный для общедоступных лекций по естественным наукам. Лекции в этом институте привлекли огромное множество слушателей, пробудив в них стремление к дальнейшему образованию. И одним из самых усердных слушателей неожиданно стал невзрачный переплётчик по имени Майкл Фарадей (1791–1867).

Майкл Фарадей
Судьба Майкла Фарадея очень похожа на судьбу Гемфри Дэви. Он тоже родился в бедной семье, отец его тоже рано умер, и обязанность содержать семью легла на плечи Майкла. Устроившись работать переплётчиком, он, пользуясь случаем, начал читать книги, которые ему приходилось переплетать. Поначалу читал всё подряд, а затем стал отдавать предпочтение сочинениям по физике и химии.
Однажды Майкл увидел объявление о вечерних лекциях по философии природы. Вход стоил один шиллинг. Испросив нужную сумму у брата, он стал посещать лекции, внимательно слушать их и делать попутно записи. Часть лекций по химии читал уже известный нам Гемфри Дэви. Именно эти лекции оказали огромное влияние на Фарадея. Спустя несколько дней он даже написал Дэви письмо, в котором выразил желание посвятить себя научной деятельности. «Я желаю совершенно оставить ремесло и поступить на службу к науке, которая делает своих поборников настолько же добрыми и благородными, насколько ремесло — злыми и себялюбивыми», — написал он.
Письмо Фарадея заинтересовало Дэви и, придя утром в свою лабораторию в Королевском Институте, он попросил у приятеля совета, как ему поступить. Друг посоветовал взять парня на «чёрную» работу (полоскать бутыли) и понаблюдать: может, и выйдет толк. (Скажу тебе по секрету, мало кто из химиков любит мыть посуду после экспериментов, обычно все стараются спихнуть эту работу на кого — то другого. Чего греха таить, я и сам так поступаю.)
Дэви же решил испытать Фарадея в чём — то более серьёзном. Он взял его к себе ассистентом и назначил жалование в 25 шиллингов в неделю. Правда, Фарадей должен был не только помогать ему в научных работах и подготовке к лекциям, но и еженедельно сметать пыль со всех приборов, а также мыть и чистить все стеклянные сосуды.
Вскоре они вдвоём отправились в двухгодичное путешествие по Европе, в ходе которого Фарадей получил систематические знания, ознакомился с новейшими направлениями в науке, завязал знакомства с выдающимися учёными. По возвращении из путешествия Дэви из — за подорванного здоровья уже не вернулся к научной работе, и Майкл Фарадей впервые получил возможность приступить к самостоятельным научным исследованиям.
Для начала он занялся изучением соединений воды с хлором. Однажды, нагревая смесь воды с хлором в запаянной стеклянной трубке, он заметил, что выделяющийся хлор оседает на холодных стенках трубки в виде жёлтых капель, похожих на масло. В эту минуту в лабораторию зашёл его коллега доктор Парис и, увидев на стенках трубки маслянистые капли, рассердился на Фарадея: он решил, что тот берёт для работы грязные сосуды.
На следующее утро доктор Парис получил письмо: «Милостивый государь! Масло, которое Вы видели вчера, оказалось жидким хлором. С почтением, М Фарадей».

Лаборатория Майкла Фарадея
Со временем Фарадею удалось получить не только жидкий хлор, но и целый ряд других газов, проложив тем самым своеобразный мостик между двумя агрегатными состояниями вещества — газообразным и жидким. В частности, он получил жидкий аммиак, углекислый газ, хлор, хлороводород, этилен и др. И всё же некоторые газы ему никак не удавалось сгустить и получить в жидком виде. Эти газы получили название «постоянных» и ещё долгое время оставались несжиженными. Только в 1882 году польские учёные З. Врублёвский и К. Ольшевский смогли наконец получить «жидкий воздух». Ещё позже, в 1908 году, голландскому физику Х. Камерлинг-Оннесу удалось получить жидкий гелий. Твёрдый же гелий впервые был получен нидерландским физиком В. Х. Кеезомом в 1926 году.
Гемфри Дэви, наставника Фарадея, неприятно задело, что его бывший ассистент самостоятельно совершил важное научное открытие и даже опубликовал его. Возможно, имела место банальная зависть, присущая почти каждому человеку. Так или иначе, но когда было предложено выбрать Фарадея в члены Королевского Общества, Дэви оказался единственным, кто проголосовал против. Но Фарадея это не обидело: будучи по натуре человеком скромным и добросердечным, он всё равно был благодарен своему учителю за всё, что тот для него сделал.
У Фарадея было множество способов и возможностей поправить своё более чем скромное материальное положение, но он отвергал их, чтобы больше времени уделять научной работе. Впоследствии он стал директором Королевского института Англии, читал лекции студентам.
Дэви изучал электролиз с качественной стороны, а Фарадей ввёл в эту область точные количественные методы и с их помощью открыл основные законы, которые и сейчас составляют фундамент современной электрохимии. (Кстати, ты знаешь первый закон Фарадея? Так вот первый закон Фарадея гласит: никому не рассказывай о законах Фарадея! Шутка, конечно же.) Фарадей доказал, что одно и то же количество электричества, пропущенное через вещество/раствор, всегда разлагает одинаковое количество вещества, независимо от условий проведения опыта.

Майкл Фарадей читает публичные лекции

Майкл Фарадей, читающий лекцию
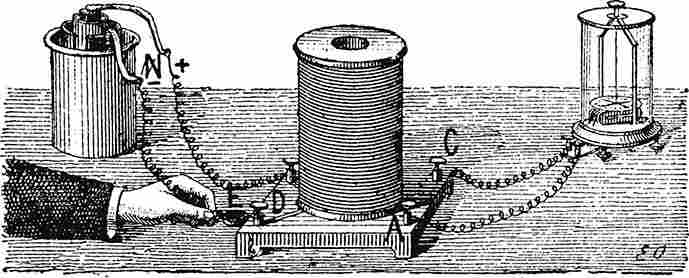
Опыт, иллюстрирующие понятие электоромагнитной индукции
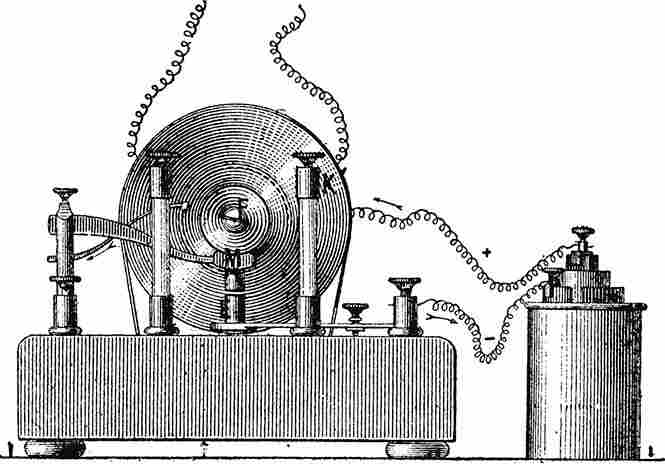
Опыт, иллюстрирующие понятие электоромагнитной индукции
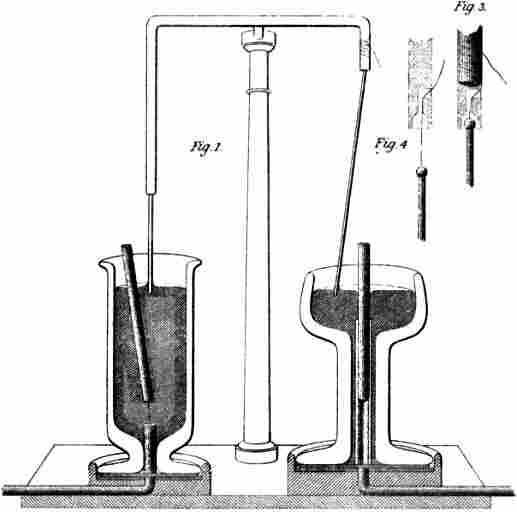
Также мы обязаны Фарадею понятием «ион», которое и сейчас используем в науке.
Ион — это частица, переносящая электрический заряд в жидких проводниках с одного места на другое. То есть ион — это носитель электрической энергии.
Проще говоря, если мы возьмём атом водорода и отберём у него электрон, то получим положительно заряженный ион H+ (но данное понимание пришло только в начале XIX века).
Нельзя не упомянуть и о других фундаментальных работах Фарадея. Так, именно ему мы обязаны открытием фундаментальных законов электродинамики и введением в науку чрезвычайно важного понятия о силовых линиях.
Как видим, недолгая эпоха флогистона закончилась рождением новых научных ветвей и в химии, и в физике. Далее они будут идти плечом к плечу, всё сильнее раскручивая маховик времени и увеличивая достижения научно-технической революции, которая вот-вот произойдёт.
Но об этом — в следующих главах.
| <<< Назад Глава 3. Флогистон и фанат Ломоносова |
Вперед >>> Глава 5. Либих. Изгой один |
- Глава 1. Давным-давно человек пользовался палкой-копалкой
- Глава 2. Химия и «философский камень»
- Глава 3. Флогистон и фанат Ломоносова
- Глава 4. Флогистон пал. Что дальше?
- Глава 5. Либих. Изгой один
- Глава 6. Тёплое пиво и кровь туземцев
- Глава 7. Мал, да удал. Атом
- Глава 8. Органика — наше всё!
- Глава 9. Физика или химия
- Глава 10. Менделеев. Таблица наша
- Глава 11. Эфир и таблица Менделеева
- Глава 12. Тихая смерть. Радиоактивность
- Глава 13. Назад в будущее
