Книга: Химия - просто
Глава 9. Физика или химия
| <<< Назад Глава 8. Органика — наше всё! |
Вперед >>> Глава 10. Менделеев. Таблица наша |
Глава 9. Физика или химия
Наряду с органической химией в конце XIX века развилась и выдвинулась на первый план новая отрасль химии — химия физическая. Физика, двигаясь семимильными шагами, открыв явления магнетизма, законы сохранения массы и энергии и т. д., стала оказывать на химию всё большее влияние. Учёные всё чаще стали применять результаты физики к решению химических вопросов, и в итоге это послужило развитию нового направления в химии.
Так, например, немецкий химик Роберт Бунзен утверждал: «Химик, который не есть также физик, есть ничто». А первым толчком к развитию физической химии послужили открытия голландского химика Вант-Гоффа.
Якоб Генрих Вант-Гофф (1852–1911) родился в Роттердаме. После школы поступил в политехнический институт и за два года освоил там трёхлетний курс, получив степень технолога. Затем он стал слушателем Лейденского университета, но там возникли трудности: Якоб со школы не любил и не знал ни латинского, ни греческого языков. Поэтому он перешёл в Боннский университет, где в то время развивал свои гениальные идеи уже известный нам Ф. Кекуле. Вдохновившись работами профессора, Вант — Гофф разработал ставшую знаменитой теорию о пространственном расположении атомов.

Якоб Генрих Вант-Гофф
И действительно, до этого мы видели, что сначала учёные пришли к мысли, что все вещества состоят из атомов. Затем они начали размышлять о том, что эти атомы должны быть как — то связаны друг с другом и что порядок связи между этими атомами должен влиять на свойства вещества. Когда все их предположения были подтверждены экспериментально, настала пора задуматься о расположении атомов в пространстве. Уже было известно, что атомы в молекуле, состоящей из трёх и более атомов, могут располагаться не в одной плоскости, а в разных.
Здесь, чтобы тебе было понятнее, поясню на игровом примере. Помнишь игру про Марио на старой игровой приставке «Денди»? Это была 2D-игра, в ней все фигуры и элементы выглядели плоскими. А теперь вспомни любую современную SD-игру. В ней все элементы — объёмные! Разница, как говорится, налицо.
Так и с молекулами. Если они состоят более чем из трёх атомов, то эти атомы могут лежать в разных плоскостях. Но тут придётся вспомнить одно из правил геометрии, точнее стереометрии: через три любые точки можно провести только одну плоскость. Когда же появляется четвёртая точка, то она может как лежать в этой же плоско сти, так и не лежать в ней. На самом деле я давно заметил: химия легко даётся тем, у кого хорошо развито пространственное мышление, и тем, кто дружит с геометрией. Если же кто — то плохо понимает химию, то у него, скорее всего, проблемы именно с пространственным мышлением. Либо он просто лентяй.
Однако вернёмся к химикам XIX века. Итак, Кекуле привнёс в химию «структурную теорию», а Вант-Гофф — углубил её. На основе своей теории он провёл ряд опытов и открыл оптические изомеры, у которых структура молекул одинакова, но при этом одна молекула является зеркальным отражением другой молекулы.
В качестве простейшего примера чаще всего брали метан (CH4). Размышляя о том, как выглядит данная молекула, приходили к выводу, что атом углерода окружён со всех сторон атомами водорода. И если представить эту молекулу в виде геометрической фигуры, то она будет выглядеть как тетраэдр, в вершинах которого находятся атомы водорода, а в центре — атом углерода.
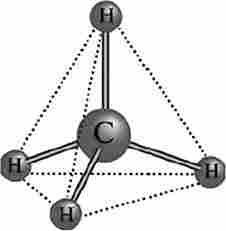
Схема молекулы метана (СН4)
Пользуясь «структурной теорией», химики К. Бишоф и П. Вальден опубликовали в 1894 году обширный том, посвящённый стереохимии, то есть науке о расположении атомов в пространстве. Казалось бы, эта теория должна была сразу же принести Вант-Гоффу всеобщее одобрение, однако вышло наоборот. Так, профессор химии Лейпцигского университета и редактор журнала «Journal fur pracktische Chemie» высказал мнение, что Вант-Гофф создал бессмысленную теорию, которая является отбросом человеческого ума, а сам он шарлатан и летает в облаках.
Но Вант-Гоффа это, конечно же, не остановило. С присущей ему увлечённостью он взялся за изучение вопроса, касающегося скорости химических реакций. Ясно, что химические реакции бывают быстрыми и медленными. Быстрые чаще всего заканчиваются взрывом, а медленные (коррозия металла, например) могут тянуться годами.
«Скорость реакции зависит от концентрации взаимодействующих тел», — первыми этот закон открыли шведские исследователи К. Гульдберг и П. Вааге. Вант-Гофф, ничего не зная об их исследованиях, вывел тот же закон самостоятельно.
Через год Вант-Гофф был поглощён изучением вопроса уже из другой области физической химии, а именно — изучением растворов. Этот раздел науки был совершенно заброшен с того времени, как химия занялась исключительно изучением химических соединений. И вот, благодаря союзу физики с химией, исследователи вновь обратили внимание на основные вопросы, касающиеся теории растворов.
Первый шаг в этом направлении был сделан учёными-ботаниками. Они давно знали, что в растительных клетках существует высокое давление, доходящее порой до десятков атмосфер. Поначалу это считалось проявлением таинственных свойств живой клетки, но в 1877 году немецкий химик-ботаник Вильгельм Пфеффер расставил все точки над «i», построив из глины искусственную клетку, которая имела те же свойства, что и живая. Выяснилось, что давление внутри клеток живых организмов связано с осмотическим давлением.

Вильгельм Пфеффер
Поначалу результаты исследований Пфеффера интересовали только ботаников, но когда о них узнал Вант-Гофф, он сразу понял, что в этих простых фактах скрывается зародыш общей теории растворов.
Вскоре Вант-Гофф пришёл к выводу, что состояние тел в растворе сходно с состоянием тех же тел в газообразном виде. С помощью этой теории удалось не только объяснить свойства многих растворов, но и открыть такие свойства, как упругость пара, температура кипения, температура замерзания и др. Научные заслуги Якоба Вант-Гоффа были в итоге вознаграждены присуждением ему Нобелевской премии.
Примерно в то же самое время на сцену науки вышел молодой шведский физико-химик Сванте Аррениус (1859–1927). В 1885 году он опубликовал работу об электропроводности растворов солей, кислот и оснований. Все эти вещества, способные проводить электрический ток, с лёгкой руки Фарадея получили название «электролиты».

Сванте Аррениус
В 1887 году Аррениус опубликовал очередную работу — «О диссоциации растворённых в воде тел». В ней он допустил, что соли и другие вещества разлагаются в водном растворе на составные части. Эти части, то есть частицы (которые тот же Фарадей ещё раньше назвал ионами) переносят электрический заряд. Например, обычная поваренная соль, которой мы почти ежедневно пользуемся при приготовлении пищи, разлагается в воде на положительный ион натрия и отрицательный ион хлора:
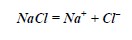
Как ни странно, эта гипотеза Аррениуса встретила сопротивление, причём главным образом со стороны химиков. И не без основания. Действительно, хлористый натрий, по мнению Аррениуса, должен распадаться в растворе на натрий и хлор. Но ведь известно, что натрий — это металл и что при соприкосновении с водой он горит. Также известно, что хлор — это газ, обладающий неприятным запахом. Однако поваренная соль не обладает этими свойствами: не горит при соприкосновении с водой и не выделяет неприятного запаха.
Собственно, это был самый веский аргумент оппонентов Аррениуса. Но нетрудно оказалось опровергнуть и их довод.
«Гипотеза ионов» отнюдь не утверждала, что хлорид натрия разлагается на металлический натрий и газообразный хлор. Известно, что он разлагается на ион натрия и ион хлора. Из курса химии мы знаем, что многие элементы имеют различные аллотропные модификации. Например, углерод — аморфный уголь, графит, алмаз. Вот, согласно гипотезе Аррениуса, и ионы представляют собой аллотропические изменения элементов. Также ионы обладают электрическими зарядами (ион натрия — положительный, ион хлора — отрицательный), вследствие чего и имеют свойства, отличные от свойств обыкновенного натрия и обыкновенного хлора.
Второй логичный аргумент против теории Аррениуса носил физический характер: почему положительные ионы при соприкосновении с отрицательными не разряжаются? Аррениус ответил так: ионы находятся в растворителе, который играет роль изолятора. В пользу этого его заявления выступили учёные В. Нернст и У. Томсон.

Так постепенно, одно за другим, удалось опровергнуть все возражения, направленные против теории ионов. И действительно: самые разные электрохимические явления полностью согласовывались с этой теорией. Так электрохимия получила мощный рычаг не только для объяснения того, что уже было известно, но и для предсказания многих неизвестных фактов.
Примерно в то же время в Лейпцигском Институте физической химии начались исследования, посвящённые каталитическим явлениям. Катализаторы — это вещества, которые ускоряют химическую реакцию, но сами при этом в ней не участвуют, оставаясь в неизменном виде.
Говоря о физической химии, я не могу не упомянуть о французском учёном Анри Муассане(1852–1907), который за сравнительно короткий период научной деятельности успел решить множество важных и трудных задач.

Анри Муассан
Анри Муассан родился в Париже в бедной семье. Его отец был простым железнодорожным служащим. Оставив школу, Анри пошёл на службу в аптеку, а позже начал изучать химию. Только в 30 лет ему довелось поступить в Парижский университет.
Первые исследования Муассана, показавшие его экспериментаторский талант и приковавшие к нему внимание учёного мира, оказались связаны с получением элемента, соединения которого были широко распространены в природе и давно всем известны. Этим элементом стал фтор.
Соединение фтора с водородом (плавиковая кислота HF) известно тем, что прекрасно растворяет стекло. Химики давно пытались получить фтор в свободном виде из его соединений, но до 1886 года все их попытки терпели неудачу. Будучи самым энергичным из всех известных элементов, фтор соединяется практически со всеми другими элементами, и при этом происходит воспламенение. Даже вода горит в газообразном фторе!

Кстати, фтор разрушающе действует не только на стекло, но даже и на платину, поэтому при подборе материала для сосуда, в котором можно было бы получить свободный фтор, Муассан столкнулся с большими трудностями. Однако они его не остановили. Напротив, послужили стимулом для проведения целого ряда опытов, которые продолжались более двух лет и всё-таки привели к желаемому результату.
Для получения фтора Анри Муассану пришлось изготовить U-образную платиновую трубку, заполнить её раствором фторида калия (KF) в плавиковой кислоте (HF) и провести после этого электролиз при весьма низкой температуре. В итоге на аноде выделился газообразный фтор!
Ещё целых 12 лет Муассан проводил опыты с фтором и его соединениями, всякий раз получая чрезвычайно интересные результаты. В конце концов выяснилось, что фтор — это газ жёлто-зелёного цвета, который при -187 °C становится жидким, а при -210 °C затвердевает в жёлтую кристаллическую массу. Более того, даже при температуре -250 °C, когда практически все химические реакции прекращаются, при соприкосновении фтора с жидким водородом происходит взрыв. А это ведь всего лишь на 23 градуса выше абсолютного нуля. (Напоминаю: абсолютный ноль — это -273 °C либо 0 градусов Кельвина.)

Опыт Анри Муассана
Опыт Анри Муассана
Впрочем, Анри Муассан проводил опыты не только при сверхнизких, но и при очень высоких температурах. Он изобрёл способ получения очень высоких температур, какие когда-либо были достигнуты на нашей планете к началу XX века.
Горение обычных веществ (например, ацетилена) в чистом кислороде никогда не даст температуру выше 2000 °C. Так вот Муассан собрал электрическую печь, основанную на совершенно новом принципе нагрева. Для этого он использовал… электрическую дугу. Изобретённый им прибор отличался чрезвычайной простотой: в печь, построенную из известняка, вводятся два угольных электрода, а в центре её находится тигель (стакан), изготовленный из магнезии или другого тугоплавкого материала.
При замыкании вольтовой дуги моментально возникает сильное нагревание. При этом из отверстий печи бьёт пламя, окрашенное в пурпурный цвет цианистым водородом, образующимся из-за взаимодействия угля с водяными парами и азотом воздуха при высокой температуре. Зрелище, похожее на фантастический фильм. Применив ток в 100 вольт и 500 амперов, Анри получил в печи нагрев до температуры в 3000 °C!
Благодаря своей простоте электрическая печь оказалась особенно удобна для лабораторных опытов. С помощью этой печи Муассан за короткое время сделал целый ряд открытий огромной важности. При высокой температуре сплавляются и даже испаряются самые устойчивые минеральные вещества. Известь, из которой сделана печь, испаряется в огромных количествах. Аморфный уголь превращается в графит, а затем возгоняется, не плавясь. Наконец, благодаря электрической печи появилась возможность перегонять металлы как обыкновенные жидкости.

Электрическая печь А. Муассана
Так, Анри Муассан перегонял медь, серебро, золото, даже платину и железо. При высокой температуре в 3000 °C можно легко получать элементы из их оксидов, восстанавливая углём. Сейчас такой способ называется металлотермией. Таким образом удалось получить уран, хром, молибден, вольфрам, алюминий и другие элементы. Именно благодаря изобретению Муассана стоимость производства алюминия сильно снизилась и он получил широкое распространение. Примечание: в настоящее время алюминий получают путём электролиза.
С помощью той же печи Анри Муассан открыл новые классы соединений, которые имеют весьма важное теоретическое и практическое значение. Так, он открыл карбиды, бориды и силициды. Это соединения углерода, бора и кремния с различными металлами.
Многим из нас с детства известно такое соединение, как карбид кальция. Даже если ты не знал его название, то наверняка в детстве баловался им, бросая в бутылку с водой и затем плотно закрывая её. При взаимодействии карбида кальция с водой образуется газ ацетилен. Бутылку разрывает с оглушительным БАБАХ!
В начале XX века карбид кальция был интересен по другой причине. Точнее, был интересен ацетилен, который использовали как горючий материал, дающий при горении большое количество тепла. Существовала достаточно сложная проблема по транспортировке этого газа. Но благодаря открытию Муассана люди смогли достаточно легко получать ацетилен из твёрдого карбида кальция, который очень легко транспортировать и хранить. Использовался он в специальных ацетиленовых лампочках.
Также интересен путь, который привёл Муассана к изобретению электрической печи. Его первые опыты преследовали совершенно иную цель, а именно — искусственное получение алмаза. Ещё Лавуазье доказал, что алмаз — это разновидность углерода (аллотропная модификация). Другие модификации углерода — это графит и уголь, и они достаточно дёшевы. Превращение их в алмаз — очень выгодное предприятие. Но как это сделать?!
Нагревая уголь до высоких температур, можно заставить его кристаллизоваться. Но продуктом кристаллизации является не алмаз, а всего лишь графит. При этом, если нагреть алмаз до температуры 3000 °C, получится всё тот же графит. Сомнительное удовольствие в материальном плане, не правда ли?
Но хотя опыт и не давал надежды на успешное получение алмаза, теория тем не менее говорила об обратом. Учёные знали, что алмазы были когда-то созданы в гигантской природной лаборатории нашей планеты, но при таких условиях, которые им пока воспроизвести не удавалось. Муассан, изучая природные алмазы, подверг анализу метеорит, упавший 23 августа 1886 года в Пензенской губернии.
Кстати, с этим метеоритом связан забавный факт: часть его была потеряна для науки, так как местные крестьяне попросту… съели сей «небесный дар». Вот что делает с людьми научная безграмотность!
Так вот, Анри Муассан обнаружил в том метеорите кристаллики алмаза и на основании этого сделал вывод, что алмаз может образоваться из угля при чрезвычайно быстром охлаждении всей массы и под высоким давлением. С такой мыслью и приступил к опыту.
Он растворял уголь в расплавленном железе. А для получения высокой температуры он, как мы уже знаем, изобрёл электрическую печь. Сплав угля и железа, нагретый до 3000 °C, Анри выливал в воду. Вода, конечно же, тотчас вскипала, а поверхность железа мгновенно покрывалась коркой застывшего металла. Как известно, железо при затвердевании расширяется, поэтому внутри слитка создаётся высокое давление. Таким образом одновременно достигаются оба условия природного образования алмаза: углерод выделяется под высоким давлением и с весьма большой скоростью. И результат оправдал ожидания.

А. Муассан растворяет уголь в расплавленном железе
Растворив застывший слиток в соляной кислоте, Муассан обнаружил на дне сосуда микроскопические кристаллики, способные резать стекло. Анализ показал, что они состояли из чистого углерода. Конечно, количество и размер кристалликов оставляли желать лучшего, а энергозатраты на их производство делали данную идею нецелесообразной. Но зато таким образом Анри Муассан первым доказал возможность искусственного получения алмаза.
Как видишь, дорогой читатель, за относительно короткий промежуток времени наука сделала огромные шаги во всевозможных направлениях. И если бы мы сейчас стали подробно разбирать каждое достижение и каждое открытие, то получили бы учебник, сопоставимый по размеру с советской энциклопедией.
Также в конце XIX века отчётливо прослеживается тренд, что основные усилия учёных больше направлены на систематизацию накопившегося материала, а не на оригинальные исследования.
| <<< Назад Глава 8. Органика — наше всё! |
Вперед >>> Глава 10. Менделеев. Таблица наша |
- Глава 1. Давным-давно человек пользовался палкой-копалкой
- Глава 2. Химия и «философский камень»
- Глава 3. Флогистон и фанат Ломоносова
- Глава 4. Флогистон пал. Что дальше?
- Глава 5. Либих. Изгой один
- Глава 6. Тёплое пиво и кровь туземцев
- Глава 7. Мал, да удал. Атом
- Глава 8. Органика — наше всё!
- Глава 9. Физика или химия
- Глава 10. Менделеев. Таблица наша
- Глава 11. Эфир и таблица Менделеева
- Глава 12. Тихая смерть. Радиоактивность
- Глава 13. Назад в будущее
- Химия и микроорганизмы
- Там, где отступают физика и химия
- Более всего химия
- Физика и химия воды
- Нейрохимия личных отношений
- Глава 9. Мембраны и биохимия
- Химия океана
- Часть третья Химия
- Глава 12 Альтернативная биохимия и водно-углеродный шовинизм
- Химия цианидно-формальдегидных дождей
- Альтернативная биохимия на тех же элементах
- Мембранная электрохимия
