Книга: Химия - просто
Глава 10. Менделеев. Таблица наша
| <<< Назад Глава 9. Физика или химия |
Вперед >>> Глава 11. Эфир и таблица Менделеева |
Глава 10. Менделеев. Таблица наша
К середине XIX века учёные окончательно поняли, что не смогут искусственно превращать одни элементы в другие. Зато они постоянно открывали всё новые и новые химические элементы, которые надо было хоть как-то систематизировать. Для этого учёными придумывались разные теории о протоводороде, о праматерии и т. д., но все они были неудачными и успеха в научных кругах не имели.
К тому времени, как ты помнишь, атомные веса элементов уже были вычислены. Поэтому, прежде чем мы двинемся дальше, советую тебе взять в руки таблицу Менделеева. Для более наглядного, так сказать, представления о теме разговора.
Итак, в 1817 году немецкий химик Иоганн Дёберейнер открыл, что сходные между собой элементы можно группировать в так называемые триады — группы, состоящие из трёх элементов. Атомный вес среднего члена этой триады был равен среднему арифметическому весу двух крайних элементов. Например, в триаде калий (39,1), рубидий (85,4) и цезий (132,9) среднее значение между калием и цезием составляет 86, что примерно равно весу рубидия.

Иоганн Вольфганг Дёберейнер
С тех пор мысль о закономерной зависимости между химическими и физическими свойствами элементов и их атомными весами прочно засела в умах учёных. Многие из них стремились открыть «общий» закон атомных весов, но лишь в 70-х годах XIX века это удалось сделать химикам Д. Ньюлендсу и Л. Мейеру.
В 1864 году Ньюлендс изложил мысль о периодичности атомных весов в Лондонском Королевском обществе. Он заявил: «Если мы расположим все элементы в ряды, по восемь в каждом, по их атомным весам, то убедимся, что через каждые восемь элементов следуют сходные между собой элементы». Данное правило Ньюлендс назвал «законом октав».
Увы, мысль о зависимости атомных весов от других свойств элементов казалась тогда столь неправдоподобной, что председатель Общества обратился к автору с ироническим вопросом: «Не пробовал ли референт разместить элементы в алфавитном порядке?»
Другой немецкий химик Л. Мейер уже несколько лет применял систему элементов, основанную на периодичности их атомных весов, в своих лекциях, но не решался опубликовать её в научных журналах.
Небывалой смелостью в этом вопросе отличился лишь русский учёный-энциклопедист Дмитрий Иванович Менделеев (1834–1907). Он довёл свою периодическую таблицу почти до совершенства и, что ещё интереснее, предсказал ряд фактов, которым суждено было довольно скоро осуществиться. Конечно, поначалу в таблице имелись некоторые недочёты, но Менделеев назвал их следствием неполноты знаний на тот момент.

Дмитрий Иванович Менделеев
Дмитрий Менделеев родился в Тобольске, в многодетной семье (он был шестнадцатым по счёту ребёнком). Его отец директорствовал в Тобольской гимназии, и данное обстоятельство отчасти помогло Менделееву, испытывавшему стойкое отвращение к латыни, окончить это учебное заведение. По свидетельству биографа Менделеева, сестра Дмитрия вышла замуж за учителя латыни из той же гимназии, и поговаривали, что благодаря ещё и этому обстоятельству будущий учёный благополучно обошёл все препятствия, связанные с изучением латыни.

Весы для взвешивания твёрдых и газообразных веществ, сконструированные Д. И. Менделеевым
Пикнометр Д. И. Менделеева
Однако вскоре Менделеев встретил более серьёзные препятствия на пути к дальнейшему образованию. Его отец ослеп, ничтожной пенсии не хватало даже на самые необходимые продукты. Дмитрий с матерью переехал к её брату в Москву. Там он должен был поступить в канцелярию губернатора и стать рядовым чиновником, но, несмотря на нехватку средств, стал подумывать о поступлении в Петербургский педагогический институт. Благодаря рекомендации, полученной в школе, без которой в то время в Петербург нечего было и соваться, в институт Дмитрий поступил. Директор института, бывший товарищ отца Менделеева, даже предоставил ему место в общежитии.
По окончании института Менделеев получил должность преподавателя в Симферопольской гимназии. Оттуда переехал в Одессу, но в 1856 году снова вернулся в Петербург, где стал приват-доцентом университета. Три года Дмитрий посвятил разработке нескольких монографий, напечатанию и защите магистерской работы «Об удельных объёмах».
Вскоре он был командирован за границу. В течение двух лет работал в Гейдельберге под руководством учёных Бунзена, Кирхгоффа и Коппа, что оказало заметное влияние на характер его дальнейших работ. Особо значимую роль в жизни Менделеева сыграл съезд немецких естествоиспытателей, состоявшийся в Карлсруэ в 1860 году. Именно на этом съезде молекулярная теория впервые получила всеобщее признание и была официально признана научной.
В 1861 году, по возвращении из заграничной поездки, Менделеев вернулся к обязанностям приват-доцента университета, но уже в 1863 году стал профессором Технологического института. К тому же времени относится выпуск его обширной докторской работы о соединениях спирта с водой и первого издания всем известных «Основ химии».
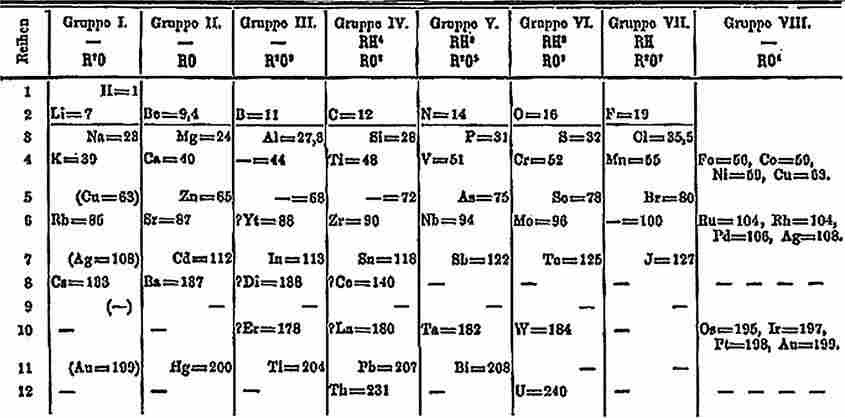
Периодическая таблица Д. И. Менделеева 1871 года
В ходе многочисленных опытов Менделеев пришёл к убеждению, что атомный вес является существенным основанием для классификации элементов. В то время было известно всего 64 элемента. (Сейчас, напомню, их число достигло 118.) Составление им периодической таблицы можно сравнить со сборкой сложного паззла, в котором частично не хватало деталей.
Взгляни на таблицу Менделеева. Все известные элементы он разместил в горизонтальных рядах (строках) по их атомным массам. В каждом ряду химические и физические свойства (температуры плавления, атомные объёмы) элементов постепенно меняются. В вертикальных рядах (столбцах) располагаются похожие, как бы родственные элементы. Так, в первой колонке находятся щелочные металлы, которые одинаково реагируют с водой (реакции сопровождаются взрывом).
Конечно, мы могли бы сейчас рассмотреть множество аналогий в таблице Менделеева, но это потребует углубления в химические основы. Нас же интересует то, какое влияние оказала таблица Менделеева на дальнейшую судьбу химии.
Менделеев считал периодическую систему законом природы.
А так как законы природы не допускают никаких отклонений, то любые исключения из этой системы он приписывал несовершенству человеческих знаний: ошибкам в определении атомных масс и незнанию некоторых элементов. И эти его заключения были подтверждены потом действительностью.
Менделеев исправил атомные веса некоторых элементов, но одно исключение оставалось. Вопреки периодической системе атомный вес теллура больше, чем у йода. Также кобальт тяжелее никеля. Хотя все элементы в таблице стояли по возрастанию атомных масс, эти элементы выбивались из закономерности и стояли в обратном порядке.
Также стоит отметить, что в таблице того времени в первой колонке находились инертные газы, которые в настоящее время располагаются в самой последней колонке. С чем это связано? Всё просто. Как я уже сказал выше, раньше элементы в таблице стояли по возрастанию их массы. Логично было предположить, что газы легче других элементов (на то они, собственно, и газы). Однако вскоре мы увидим, что теория о строении атома расширится, и принцип расположения немного изменится. И, тем не менее, он всё равно совпадёт с логикой, вложенной в таблицу Менделеевым.
В настоящее время элементы располагаются в порядке, который соответствует количеству протонов в ядре каждого конкретного элемента. Например, в ядре водорода один протон, поэтому он стоит на первом месте. В ядре атома гелия два протона, поэтому он на втором месте. В ядре же, например, урана — 92 протона, поэтому его порядковый номер в таблице — 92-й. Логично будет предположить, что с увеличением количества протонов в ядре увеличивается и масса каждого следующего элемента. Однако тогда Менделеев ещё не имел представления об устройстве атома, не знал, что у атома есть ядро, состоящее из протонов и нейтронов, а вокруг «вращаются» электроны.
Зато тогда же, во времена Менделеева, самое сильное впечатление на учёных произвело его сбывшееся предсказание новых элементов. Везде, где в таблице оставались пробелы, Менделеев поставил вопросительные знаки. По его мнению, все эти пустые клетки соответствовали новым, ещё не открытым химическим элементам. Кстати, я тоже, когда учился в школе, задавал себе вопрос: как же Менделееву удалось предсказать свойства новых, ещё не открытых элементов? Теперь — то понимаю, что всё довольно просто: атомные веса неизвестных элементов он вычислил при помощи… интерполяции. Помнишь, чуть выше мы говорили про триады, где атомная масса среднего элемента равна среднему значению крайних элементов? Так вот, именно так Менделеев и вычислил атомные массы неизвестных элементов. Их физические и химические свойства он, попросту говоря, предсказал по аналогии с другими, соседними, уже известными элементами той же группы (элементами одного столбца).
Учёные, довольно скоро открывшие целый ряд новых элементов, подтвердили тем самым гениальные предсказания Менделеева. Кстати, многие новые элементы были открыты ими благодаря изобретению спектроскопа — прибора, позволяющего обнаруживать новый элемент даже тогда, когда он содержится в чрезвычайно малом количестве в каком-нибудь соединении. Авторами (изобретателями) спектроскопа стали немецкий физик Г. Кирхгоф и немецкий химик Р. Бунзен.

Густав Роберт Кирхгоф

Роберт Вильгельм Бунзен
В 1821 году немецкий физик — оптик Йозеф Фраунгофер изучал солнечный спектр, пропуская солнечный свет через призму. Визуально наблюдение выглядело как радуга, и вдруг Фраунгофер обнаружил, что в его «радуге» присутствуют чёрные линии. Физическое значение этих линий оставалось неизвестным на протяжении долгих 35 лет, пока Г. Кирхгофф не вывел общую теорию явлений поглощения света, положив тем самым начало спектральному анализу.
На основании закона сохранения энергии Кирхгофф пришёл к открытию важного общего закона, который звучит так.
Любое тело в раскалённом состоянии испускает определённые лучи, а именно те, которые оно способно поглощать при этой температуре.
Таким образом, линии Фраунгофера объясняются присутствием в атмосфере солнца некоторых элементов, поглощающих лучи определённой длины волны. Например, водород имеет спектр поглощения, в котором отсутствует красный цвет с длиной волны 656 нанометров.
Когда Бунзен и Кирхгофф определили спектры и других известных элементов и соединений, стало возможным определять химический состав веществ без проведения химических реакций, т. е. определяя только спектр конкретного вещества (данный способ и получил название спектрального анализа). Образно говоря, спектр — это своего рода отпечаток пальца для каждого вещества.
20 сентября 1875 года французский химик-исследователь Лекок де Буабодран открыл новый химический элемент — галлий. Тот самый, что плавится в руках. Свойства этого элемента полностью совпали с предсказаниями Менделеева относительно «эка-бора» (так называли галлий до его открытия).
И началось. В 1879 году шведский химик Л. Нильсон открыл скандий, а немецкий химик К. Винклер в 1886 году открыл германий. И оба эти элемента тоже прекрасно вписались в периодическую систему Д. И. Менделеева, а их свойства полностью совпали с его предсказаниями.
Сбывшееся пророчество вызвало в учёном мире настоящую сенсацию! Периодическую систему стали перепечатывать и применять во всех странах, имя Менделеева приобрело мировую известность.

Ларс Фридерик Нильсон

Клеменс Александр Винклер
Казалось, его периодическая система окончательно установила границы поиска оставшихся новых элементов, которым надлежало заполнить в ней пустующие пробелы. Но действительность подкинула учёным интересную неожиданность: новые элементы были открыты там, где их вовсе не ждали.
Так, считалось, что воздух уже давно и тщательно изучен. Ещё со времён К. Шееле и А. Лавуазье было известно, что «чистый» воздух состоит всего из двух газов — азота и кислорода, — причём на 79 частей азота в нём приходится 21 часть кислорода.
Однако в 1892 году британский физик лорд Рэлей, занимаясь определением плотности атмосферного азота, сделал неожиданное открытие. Все физико-химические измерения он проводил в своей лаборатории с чрезвычайной точностью и вот однажды, сравнивая плотность азота, входящего в состав обычного воздуха, с плотностью азота, полученного искусственным путём, обнаружил, что плотность атмосферного азота равна 2,31, а плотность искусственного — 2,30. Разница вроде бы невелика, но её оказалось достаточно, чтобы побудить Рэлея к дальнейшим исследованиям.
И эти исследования, которые он провёл совместно с шотландским химиком У. Рамзаем, привели к открытию нового газа. Газ этот оказался химически менее активным, нежели азот, к тому же не вступал в соединения ни с какими другими элементами, поэтому его назвали «аргоном» («недеятельный»). Содержание аргона в воздухе составляет менее 1 %.
Рэлей и Рамзай тщательно очистили аргон и исследовали его плотность, спектр и другие физические свойства в газообразном состоянии. Почти одновременно с этим профессору К. Ольшевскому из Кракова удалось сжижить аргон и определить его физические свойства в сжиженном состоянии. (Если ты, дорогой мой читатель, хочешь собственными глазами увидеть, как выглядит жидкий и даже твёрдый аргон, то тебе надо просто зайти на YouTube-канал «Химия — просто» и найти видео с названием «Аргон».) Но раз уж был открыт новый химический элемент аргон, значит, следовало найти ему место в периодической системе элементов. Атомный вес аргона составляет 39,9, и, следовательно, логично было бы поместить его между калием и кальцием. Не тут-то вышло! Там для него места не оказалось! Разумеется, тотчас возник закономерный вопрос: что же делать с аргоном, если он не вписывается таблицу Менделеева?!
Сам Д. Менделеев заявил, что надо лишить аргон права считаться элементом, и предложил признать его видоизменённым азотом. Однако гениальное решение в данном вопросе принадлежало У. Рамзаю.

Уильям Рамзай
Невозможность размещения нового элемента в общепринятой периодической системе навела Рамзая на мысль, что помимо аргона в природе должны существовать и другие неизвестные газы, сходные с ним по свойствам. Разыскивая соединения аргона с другими элементами, Рамзай занялся исследованием газа, содержащегося в минерале клевеите. Первоначально газ был подвергнут анализу другим учёным — Гиллебрандтом, посчитавшим, что это азот. Рамзай повторил исследование и обнаружил сходство спектра газа из минерала с солнечным спектром. Плотность этого газа была всего в 2 раза больше плотности водорода. Рамзай понял, что имеет дело с новым газом. А поскольку данный газ присутствовал в солнечном спектре, он назвал его «гелием» (от греческого «гелиос» — солнце).
Следовало ожидать, что скоро будут открыты и другие газы, схожие с гелием и аргоном. Однако предпринятые Рамзаем поиски новых газов в минералах, метеоритах и минеральных водах оказались безуспешны. К счастью, примерно в то же время английским инженером Гампсоном была изобретена новая машина для сжижения воздуха. Именно эта машина и помогла открыть новые элементы группы аргона.
Рамзай описывал очередное открытие так: «Желая изучить искусство работы с этим необыкновенным материалом, я попросил у доктора Гампсона один литр жидкого воздуха. Доктор Траверс и я играли им, проводя различные мелкие опыты, чтобы подготовиться к большому опыту, то есть к сжижению аргона. Однако мне жаль было испарить весь запас жидкого воздуха, не подвергнув исследованию остальной части. Ибо, хотя этот искомый газ, вероятно, не мог в ней заключаться, но не представлялось невозможным, что аргон сопровождается более тяжёлым газом. Это предположение подтвердилось».
Так, в той самой малой части воздуха были открыты два новых газа: криптон и ксенон. Из наиболее летучей части воздуха был выделен ещё один газ, более лёгкий, чем аргон, — неон. Таким образом, вопрос об отношении аргона и других инертных газов (гелия, криптона, ксенона и неона) к периодической системе был решён. Поскольку все эти элементы не соединяются с другими элементами, им приписали валентность, равную нулю, и поместили их в нулевую группу — перед щелочными металлами. (В современной таблице нулевая группа отсутствует: инертные газы расположены в самом правом столбце в последней группе в соответствии с их электронной конфигурацией.)
В итоге эти открытия не только не подорвали авторитет периодической системы Менделеева, но и дополнили её, пусть даже совершенно непредсказуемым образом.
Однако вернёмся к Дмитрию Ивановичу. Его научная деятельность в Петербургском университете прервалась неожиданно даже для него самого.
В 1890 году в высших учебных заведениях России начались массовые беспорядки. Особенно сильно студенческие волнения проявились в Петербургском университете. Во время одной своей «сходки» студенты обратились к присутствовавшему на ней профессору Менделееву с просьбой передать министру просвещения их петицию с разного рода требованиями. Менделеев согласился. Однако, как и следовало ожидать, министр его не принял и вдобавок сделал строгое замечание, укорив в том, что тот вмешивается не в свои дела. Из-за возникшего конфликта Менделеев тотчас подал в отставку.
Оставив университет в возрасте 56 лет, Менделеев без дела не остался: по рекомендации министра финансов С. Ю. Витте стал членом «Совета торговли и промышленности».
Последние годы жизни Дмитрий Иванович работал в основанной по его инициативе Палате мер и весов. Помимо проведения основных научных измерений, в задачи этой Палаты входило наблюдение за мерами и весами, а также постепенное введение метрической системы в практическую жизнь.
К сожалению, большинству наших современников Менделеев известен только своим периодическим законом. А ведь он проводил исследования во многих сферах деятельности! Так, Менделееву принадлежит авторство фундаментальных исследований по физике, метрологии, метеорологии, экономике, трудов по воздухоплаванию, химической технологии, сельскому хозяйству, народному просвещению и многих других работ, тесно связанных с потребностями развития производства в России.
В процессе исследования газов Менделеев вывел общее уравнение состояния идеального газа, которое включало — как частный случай — зависимость состояния газа от температуры, выявленную в 1834 году французским физиком Б. П. Э. Клапейроном. Так, кстати, и появилось известное всем нам со школы уравнение Менделеева — Клапейрона.


Воздушный шар «Русский», на котором Д. И. Менделеев 7 августа 1887 года совершил полёт для наблюдения полного солнечного затмения
Кроме того, именно Менделеев предложил метод дробной перегонки нефти с последующим разделением её на составляющие. Он входил даже в комиссию по рассмотрению спиритических явлений и суеверий, которые были широко распространены в обществе середины XIX века. Работы Менделеева по сопротивлению среды и воздухоплаванию нашли своё продолжение в работах, посвящённых кораблестроению и освоению арктического мореплавания. В 1894 году по просьбе Менделеева был построен бассейн для испытания морских судов с целью создания большого арктического ледокола.

Д. И. Менделеев успел поработать и над улучшением качества используемого в те годы пороха. Одновременно он был выдающимся экономистом, сумевшим грамотно обосновать основные направления развития хозяйства в царской России.
Подводя итог, хочу привести пословицу: «Талантливый человек талантлив во всём». Уверен, что эти слова характеризуют Дмитрия Ивановича Менделеева как нельзя лучше.
| <<< Назад Глава 9. Физика или химия |
Вперед >>> Глава 11. Эфир и таблица Менделеева |
- Глава 1. Давным-давно человек пользовался палкой-копалкой
- Глава 2. Химия и «философский камень»
- Глава 3. Флогистон и фанат Ломоносова
- Глава 4. Флогистон пал. Что дальше?
- Глава 5. Либих. Изгой один
- Глава 6. Тёплое пиво и кровь туземцев
- Глава 7. Мал, да удал. Атом
- Глава 8. Органика — наше всё!
- Глава 9. Физика или химия
- Глава 10. Менделеев. Таблица наша
- Глава 11. Эфир и таблица Менделеева
- Глава 12. Тихая смерть. Радиоактивность
- Глава 13. Назад в будущее
- § 47 Периодический закон и периодическая система химических элементов Д. И. Менделеева
- ЗАКОН МЕНДЕЛЕЕВА — ЗАКОН ПРИРОДЫ
- ЕСТЕСТВЕННАЯ СИСТЕМА ЭЛЕМЕНТОВ И ПРИМЕНЕНИЕ ЕЕ К УКАЗАНИЮ СВОЙСТВ НЕОТКРЫТЫХ ЭЛЕМЕНТОВ. Д. И. Менделеев
- 4.10. МЕНДЕЛЕЕВ И МЕЙЕР
- 2.13. ДМИТРИЙ ИВАНОВИЧ МЕНДЕЛЕЕВ: НЕ НАУКОЙ ЕДИНОЙ
- Глава II. Периодический закон Д. И. Менделеева
- 17. Периодический закон Д. И. Менделеева.
- Экабор Менделеева
- 10.1.2. Живое вещество
- Этапы большого пути гения
- Химические элементы и вещества
- § 48 Строение атома и свойства химических элементов
