Книга: Таинственный геном человека
8. Первые наброски человеческого генома
| <<< Назад 7. Следующий логический шаг |
Вперед >>> 9. Как изменяется наследственность |
8. Первые наброски человеческого генома
Я знаю, что это исторический момент. Это самая важная научная инициатива, которую когда-либо предпринимало человечество… Это навсегда изменит биологию.
В субботу 12 февраля 2001 года две соперничающие организации — Celera Genomics и Human Genome Project (при поддержке множества правительственных и благотворительных организаций в США, Великобритании, Германии, Японии и Франции) — одновременно объявили о завершении первого этапа полной расшифровки генома человека. Это вызвало волну восторгов в мировых СМИ. Президент США Билл Клинтон начал хвалебную оду, которую подхватил премьер-министр Великобритании Тони Блэр, а вслед за ними национальные лидеры и ведущие ученые каждой из стран объявили о начале новой эпохи знания и научных исследований. Роджер Хайфилд, научный редактор The Daily Telegraph, выразился прямо: «Ученые-соперники открывают книгу жизни». По словам Энди Коглана и Майкла Ле Пейджа, корреспондентов New Scientist, геном скоро будут учить в школах как таблицу Менделеева. Не было никаких сомнений, что это открытие знаменует собой начало нового этапа в генетике и является огромным шагом вперед и логическим продолжением открытий в области ДНК. И так же как с ДНК, вновь начались конфликты между двумя соперничающими группами.
Директор Human Genome Project Уотсон сделал проект международным, заручившись таким образом поддержкой, благодарностью и преданностью многих ученых по всему миру. Кроме того, он выделил небольшую часть средств, чтобы донести социологические, религиозные и этические идеи, касающиеся проекта, до интеллектуалов и политиков. В академических кругах многие видели в Celera Genomics наглых выскочек, ведомых предприимчивым ученым Джоном Крейгом Вентером. Но следует отдать ему должное — Вентер благодаря проницательности и обаянию смог преуспеть в длинном списке удивительных научных прорывов, включая новые области генетических исследований. Как Уотсон, Крик и Уилкинс, Вентер отмечал, что его в свое время вдохновила книга Шрёдингера.
Вентер развивался как ученый, работая в Национальном институте здоровья США рядом с кабинетом Маршалла Ниренберга, который внес вклад в открытие гистонового кода. В 1992 году Вентер, которому было сложно вынести неторопливость прогресса в его окружении, организовал собственную коммерческую лабораторию — Институт генетических исследований (The Institute for Genomic Research — TIGR). Теперь он мог совмещать автоматизированное секвенирование с изобретенным его исследовательской группой новым подходом — «пулеметной лентой», в котором длинные генетические последовательности, найденные в живых организмах, можно было разбивать на более мелкие части. Разделяя геном на все более мелкие части, ученые находили повторяющиеся фрагменты, которые в дальнейшем можно было использовать для воссоздания целой нуклеотидной последовательности микроба или, скажем, человеческой хромосомы.
«Техника пулеметной ленты» могла ускорить работу над проектом, однако соперники Вентера заклеймили метод как потенциально неточный. Тем не менее в 1995 году Вентер опубликовал статью о своей первой победе: впервые был полностью расшифрован геном живого организма — бактерии Haemophilus influenza, вызывающей заболевания дыхательных путей и другие инфекции. После этого расшифровали геном бактерии, вызывающей язву, — Helicobacter pylori, в марте 2000 года наконец расшифровали геном насекомого — известной по экспериментам Томаса Ханта Моргана фруктовой мушки. И скептически настроенные научные круги были, так сказать, поставлены на место.
В 1998 году Вентер скооперировался с Перкином Элмером, произошло слияние корпорации Перкина Элмера и Института генетических исследований, давшее начало новой компании — Celera Genomics. Слово celera на латыни означает «торопись» и подчеркивает важность скорости исследований. Вентер дал понять, что цель компании не биотехнологии сами по себе, а предоставление информации. По словам Джеймса Шрива, который описывал это удивительное время, рыночный продукт компании Celera Genetics — огромная генетическая база, основанная на геномной последовательности человека. Таким образом, для новой компании Вентера самим смыслом существования было соперничество с получающей государственные дотации организацией Human Genome Project.
В 1992 году Джеймс Уотсон серьезно разошелся во мнениях с Бернардиной Хили, которая на тот момент отвечала за Human Genome Project. Хили была согласна с директивой Конгресса о том, что открытия организации должны поддерживаться патентами. Уотсон горячо возражал и высмеивал Хили до тех пор, пока она не уволила его, «устав от оскорбительных замечаний». В том же году Уотсона заменил более дипломатичный Фрэнсис Коллинз. Организация Wellcome Trust в Великобритании начала с того, что учредила Sanger Centre — огромную лабораторию по расшифровке генома, расположенную недалеко от Кембриджа, которая вместе с Национальным центром исследования здоровья работала над Human Genome Project.
Амбициозная компания Celera запустила 200 мощнейших автоматов по расшифровке кода, совмещая скорость промышленного производства с «методом пулеметной ленты» Вентера, разделяя 46 хромосом, состоящих из 6,4 миллиарда белков, на маленькие кусочки. Эти кусочки расшифровывались в банках секвенторов, после чего из них можно было собрать целый геном. Подход Celera, как это видел Вентер, должен был сократить время на завершение проекта с десяти лет, заявленных его соперниками, до семи. В то же время Коллинз при поддержке многих ученых, работавших в Human Genome Project, оспорил мнение, что такой подход может привести к недопустимым неточностям. Теперь ученых волновало другое: что коммерческий склад ума Вентера, несмотря на его заверения, приведет к ограничению доступа к данным генома и, таким образом, ограничит последующие исследования. Некоторые ученые даже боялись, что Celera может попытаться присвоить себе авторские права на человеческий геном.
Соперники все еще обменивались язвительными колкостями, просачивающимися в СМИ, когда в 2001-м обе компании заявили об открытиях: Celera опубликовала результаты в ведущем американском журнале Science, а Genome Project воспользовалась его британским аналогом — Nature. В результате у нас есть два варианта расшифровки генома. В Celera ясно заявили, что предоставят доступ к данным только ученым, однако на коммерческое использование это распространяться не будет. В конце концов, они потратили сотни миллионов долларов на эти исследования и теперь, будучи коммерческой компанией, должны вернуть затраченные средства и получить с проекта какую-то прибыль. А вот другая организация, находившаяся на государственном финансировании, заявила, что все их открытия полностью доступны кому бы то ни было.
Возможно, некоторых читателей возмутит, что в святыню человеческого генома вторгаются коммерческие интересы. Однако на самом деле противостояние между коммерческими интересами и интересами общественности в медицине и биологии случается нередко. Иногда сложно провести четкую линию между этими подходами, но на практике исследования наиболее важных областей, например прививок, антибиотиков, лекарств от рака, всегда включают сложный баланс между двумя противоположностями.
Здесь научный прорыв шел двумя путями одновременно, и бурных оваций заслуживают обе стороны. Благодаря двум публикациям в журналах Nature и Science (15 и 16 февраля соответственно) мир науки и человечество в целом узнали о невероятно сложных молекулярных структурах, которые лежат в основе наших генов. Расшифровка генома обещала эпохальные изменения в будущем биологии и медицины — в общем-то, в будущем человечества — и вела за собой головокружительные и очень неожиданные открытия. Газеты и журналы писали: расшифровав карту генома, мы познаем самую суть жизни. Но на деле эта карта оказалась сплошной terra incognita.
Когда мы говорим о прорыве в научных открытиях, мы часто преувеличиваем. Однако здесь действительно происходили прорыв за прорывом, принесшие научному миру три огромных сюрприза, каждый из которых сам по себе был новым вызовом, новой загадкой. Картина станет более ясной, если мы посмотрим на диаграмму.
Соотношение различных генетических элементов в геноме
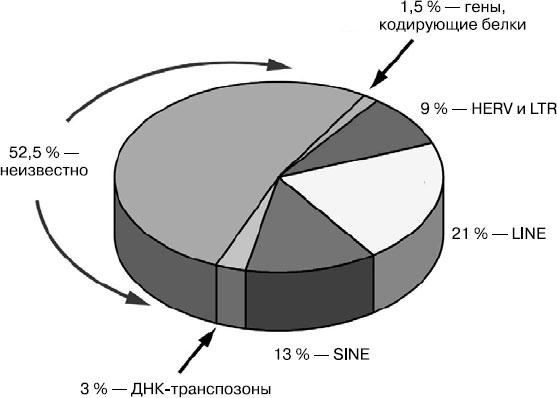
Я должен пояснить, что эта диаграмма — своего рода метафора, допущение. Она показывает процентное соотношение различных генетических элементов в геноме, но не демонстрирует, где все это расположено в наших 46 хромосомах. На этом этапе большинство генетиков интересовались в основном генами, кодирующими белки, и именно в этой области и находилась первая загадка, с которой мы столкнулись.
Биохимики приблизительно оценили количество белков в человеческом организме в 100 тысяч. Мы предполагали, что столько же будет и генов, которые кодируют эти белки. Генетики хотели знать, сколько на самом деле существует генов и где именно они расположены на хромосомах. Каким же шоком оказалось, что эти гены составляли менее 2 % от всего генома, может, даже 1,5! Выглядело так, будто ими просто невозможно закодировать все 100 тысяч белков, из которых построен человеческий организм.
Что же и где пошло не так?
* * *
Эти скромные 1,5 % генома состояли из приблизительно 20,5 тысячи генов, кодирующих белок. Для генетиков и в целом для биологов это было удивительной новостью. На то время весь мир верил в гипотезу Бидла и Татума, по которой один ген кодирует один белок, а значит, генов должно было быть от 80 до 100 тысяч. Оказалось, это бессмыслица. А вслед за ним — другое открытие: по оценке Крейга Вентера, как минимум 40 % этих генов не выполняли никакой известной нам функции. «Мы понятия не имеем, зачем они нужны. Раньше биология о них не знала». Ему пришлось отметить: «Это заставило нас склонить голову».
20,5 тысячи ненужных генов — хочется просто опустить руки. Для сравнения: у нас примерно в 10 раз больше генов, чем у средней бактерии, в 4 раза больше, чем у фруктовой мушки, и всего в 2 раза больше, чем у круглых червей нематод. И у всей этой троицы — человека, мушки и червя — есть 1523 общих гена.
Дарвин был первым, кто осмелился представить, что все живые существа на Земле тесно связаны между собой процессом эволюции, идею которой он предложил. И вот на скрижалях жизни, в человеческой ДНК, мы нашли подтверждение его гениальности — и в то же время новое удивительное несоответствие.
Как наука сможет объяснить, что в 20,5 тысячи генов закодировано примерно 100 тысяч белков?
До этого момента мы считали, что кодирующие белки гены, состоящие из длинных цепочек ДНК, полностью копировались соответствующей информационной РНК — с тем лишь исключением, что четвертый полинуклеотид тимин в ДНК заменяется на урацил в РНК. Эта длинная цепочка соответствующей РНК перемещается из ядра к рибосомам в цитоплазме, которые производят белок. Там, на основе триплетов, РНК транслируется в белки, аминокислоты которых в точности соответствуют исходному генетическому коду ДНК в ядре. По данной гипотезе количество генов должно соответствовать количеству белков.
Ключом к загадке стало ошеломляющее открытие, которое сделали двое ученых в 1977 году.
Ричард Дж. Робертс — выпускник моей альма матер, Шеффилдского университета. Там он получил степень бакалавра наук по химии, закончив докторскую диссертацию в 1965 году. После этого он работал в лаборатории в Колд-Спринг-Харбор, штат Нью-Йорк. Филлип Аллен Шарп — выпускник Иллинойского университета в Нью-Йорке. Он также закончил докторскую в 1965 году и работал в лаборатории в Колд-Спринг-Харбор. Робертс и Шарп исследовали, как гены вируса, называющегося аденовирус 2, кодировали белки в культуре клеток тканей. Ученые выяснили, что информационная РНК, которая у рибосом производила белок, была значительно короче в смысле нуклеотидной последовательности, чем ДНК в ядре вируса. Это подсказало ученым, что только часть так называемых кодирующих белки генов действительно кодировали аминокислоты производимых по их инструкциям белков. При передаче генетического кода из ядра вируса в клетки организмов-носителей, видимо, происходило что-то очень загадочное.
Ситуация такая же, как с исследованиями бактериофагов, самых маленьких из микробов, лет тридцать назад: вирусы открыли нам глаза на более общее биологическое правило. Робертс и Шарп обаружили то, что мы сейчас называем интронами и экзонами, которые очень важны в генетическом механизме сплайсирования. Это открытие принесло им Нобелевскую премию по физиологии/медицине в 1993 году.
Что такое интроны и экзоны? Как они решают вопрос несоответствия между количеством кодирующих белки генов и предполагаемым количеством белков, закодированных в человеческом геноме?
Возможно, настало время вновь вскарабкаться в вагон нашего воображаемого поезда, который отвезет нас в микроскопическую страну по своим удивительным двойным рельсам из фосфатов и дезоксирибозы и не менее удивительным шпалам.
* * *
В мгновение ока мы оказываемся в вагоне — чух-чух-чух — и едем по длинным цепочкам хромосом. Мы знаем, что в этой хромосоме есть определенные участки ДНК, называющиеся генами. Раз уж мы в Волшебной стране и здесь есть место магии, мы можем решить, что следующий ген на наших рельсах будет подсвечиваться зеленым. Зная это, мы замедляемся достаточно, чтобы увидеть впереди участок, пульсирующий изумрудно-зеленым светом, — мы находимся в начале гена. Затем переключаемся на тихий ход и едем вдоль рельсов. Заметно, что светятся зеленым именно шпалы. Через некоторое время они становятся обычного коричневого цвета. И я полагаю, что мы еще не у конца гена: зеленый участок пути, который мы прошли, — просто первый экзон.
И вам хочется спросить: «Где именно мы сейчас находимся?» — «Обычный участок с коричневыми шпалами — это первый интрон».
Мы медленно двигаемся по этому участку и понимаем, что он длиннее предыдущего. Но он внезапно заканчивается, и мы въезжаем на новый зеленый участок — второй экзон. Мы продолжаем путешествие и видим еще три экзона, перемежающихся двумя интронами, как будто пробелами. Все действительно очень просто. Робертс и Шарп поняли, что ДНК отдельного гена не обязательно кодирует один белок. Ген разделен на маленькие участки — экзоны, отделенные друг от друга интронами. Для кодирования одного белка нужно особое сочетание экзонов, а не целый ген, — эти экзоны и копируются в информационную РНК вместе с интронами, однако в процессе кодирования интроны уберутся и экзоны соединятся вместе для получения конечного варианта сообщения, которое передается посредством РНК и кодирует белок.
Будет полезно думать так: экзоны «покидают» ядро, чтобы закодировать белок, а интроны остаются «внутри» ядра. Общее количество экзонов в любом человеческом гене варьируется, но в среднем их 8,4. Следовательно, для кодирования определенного белка геном должен знать, как выбрать нужный ген, а в нем выбрать экзоны, которые придется слепить вместе, чтобы получить нужный код.
Возьмем, к примеру, человеческий бета-глобин — часть молекулы бета-глобулина. Мы знаем, что молекула гемоглобина содержит в своем ядре один атом железа, окруженный двумя первичными и двумя вторичными белковыми единицами. В целом белок состоит из четырех различных частей — такой белок называется четвертичным. Если мы посмотрим на одну из двух одинаковых вторичных белковых единиц, то увидим, что это те же единицы, которые мутируют при серповидной клеточной анемии: мы обнаружим, что участок ДНК, кодирующий этот белок, содержит три экзона и два разделяющих их интрона.
На этом этапе нужно понимать, как активируется ген.
Если бы мы сошли с поезда и посмотрели повнимательнее на участок ДНК, который кодирует бета-гемоглобин, то увидели бы, что где-то ближе к началу первого экзона (помним, что декодирующий механизм движется по молекуле ДНК слева направо) у нас находится секция ДНК, известная как промотор — последовательность, которая обычно присоединяется к началу гена и представляет собой своего рода переключатель, активирующий или подавляющий его. Где-то подальше — может, на вполне значительном расстоянии — есть другие нити ДНК, которые работают как противодействующий регуляторный механизм, офис, полный бюрократов. Бюрократы отдают команду промотору: пора считывать ген. От них зависит, будет ли считан тот или иной ген — а это по-разному происходит в разных клетках, разных тканях и органах человеческого тела. Время экспрессии генов и их количество также зависит от ткани.
Затем промотор отдает команду гену на экспрессию ДНК. Так, в бета-глобине три экзона с разделяющими их интронами превращаются в соответствующую информационную РНК, а после этого (все еще внутри ядра) два интрона удаляются и оставшиеся три экзона соединяются вместе. И только после этого информационная РНК покидает ядро и отправляется к рибосомам в цитоплазме, которые производят белки.
Самый большой известный нам ген человека кодирует необходимый для нормального функционирования мышц белок дистрофин — 79 экзонов, разделенные 78 интронами. Как и в случае анемии, если этот белок затронут мутациями, может возникнуть наследственное заболевание. Например, мышечные дистрофии Беккера и Дюшенна — следствие отсутствия в коде целого экзона, что приводит к повреждению мембраны, окружающей мышечную ткань, и мышцы функционируют неправильно.
Понимание генетических механизмов возникновения таких болезней может помочь ученым-медикам находить лекарства, а в будущем — возможно, недалеком — разработать генетические методы их лечения. То, как работают экзоны и интроны, объясняет, как 20,5 тысячи генов могут кодировать 80–100 тысяч белков.
Ген, в котором, например, есть 14 экзонов и 13 интронов между ними, скорее всего, кодирует более одного белка. Все, что для этого нужно, — регулятивные механизмы, которые решают, какие экзоны слепить воедино, чтобы сделать информационную РНК, выбирая их различные сочетания. Теперь мы знаем, что все работает именно так. Возможность одного гена кодировать разные белки называется альтернативным сплайсингом. Мы также знаем, что эта способность универсальна для эукариотных организмов — всех животных, растений, грибов и простейших, чей геном содержится в ядрах клеток.
Теперь понятно, почему Нобелевский комитет в 1993 году решил отдать премию по физиологии/медицине Робертсу и Шарпу. В 2005 году дорогущая пристройка к химическому факультету Шеффилдского университета, где я когда-то учился, была названа именем Ричарда Дж. Робертса.
* * *
Как мы видим, первая из главных загадок, возникших после расшифровки человеческого генома в 2001 году, уже имела готовую разгадку. Однако еще две из них — обширные сегменты, похожие на вирусный геном, и пустые 50 % — еще только предстоит разгадать. До того как штурмовать новые высоты, нам нужно базовое понимание механизмов, которые могут изменять геномы существующих ныне видов и таким образом создавать новые формы жизни. Это потребует понимания основ эволюционной биологии и многих недавних открытий в этой широкой и очень интересной области науки.
| <<< Назад 7. Следующий логический шаг |
Вперед >>> 9. Как изменяется наследственность |
- Введение
- 1. Кто бы мог подумать?
- 2. ДНК оказывается кодом
- 3. История на картинке
- 4. Парочка неудачников
- 5. Тайна жизни
- 6. Родственная молекула
- 7. Следующий логический шаг
- 8. Первые наброски человеческого генома
- 9. Как изменяется наследственность
- 10. Преимущества совместной жизни
- 11. Вирусы среди нас
- 12. Эволюция на геномном уровне
- 13. Рычаги управления
- 14. История, хранящаяся в ДНК
- 15. Наши более далекие предки
- 16. Великие доисторические дебри
- 17. Родственники человека
- 18. Судьба неандертальцев
- 19. То, что делает нас уникальными
- 20. Пятый элемент
- Список литературы
- Благодарности
- Содержание книги
- Популярные страницы
- Концепция тройственной структуры человеческого познания и знания
- Наброски к портрету Нобелевского лауреата
- § 11 Естествознание и другие способы человеческого познания
- Тайны человеческого мозга
- 5. Парадоксы человеческого генома
- Глава 12 Роль человеческого фактора в развитии биосферы и вопросы экологической политики
- 8.3. Статус человеческого эмбриона: социокультурная и моральная оценка
- ГЛАВА 7 Машина человеческого тела
- ГЛАВА 1 Фортепиано человеческого уха
- «Я поверю в эволюцию не раньше, чем мартышка родит человеческого ребенка»
- ГЛАВА 1 Регуляторы человеческого тела
- Глава четвертая. Пробуждение человеческого духа
