Книга: Онтогенез. От клетки до человека
Глава 6 Долгое деление
| <<< Назад Глава 5 Формирование мозга |
Вперед >>> Часть II Постепенная детализация |
Глава 6
Долгое деление
Никакое дело не покажется невыполнимым, если разбить его на мелкие части.
Важной особенностью, о которой я еще не упоминал, является то, что регионы тела, расположенные на разных уровнях передне-задней оси, отличаются друг от друга. Некоторые структуры, например нервная трубка, простираются от головы до конца тела, но многие другие структуры появляются только на определенных уровнях этой оси. Если принять за целое расстояние от головы до хвоста, то руки, например, выступают из корпуса на уровне примерно три восьмых (у взрослых), а ноги растут фактически из конца этой оси. На участке туловища между руками и ногами конечностей нет. Органы внутри тела тоже располагаются строго определенным образом: глаза находятся на уровне одной восьмой расстояния от головы до хвоста, а печень – на уровне шести восьмых.[85] Все эти структуры развиваются из клеток эмбриона, и появление разных органов на разных уровнях оси «голова – хвост» говорит о том, что клетки эмбриона, расположенные на разных участках этой оси, отличаются между собой. В этой главе речь пойдет о том, как возникают эти различия. Чтобы понять механизмы этих процессов, нужно осознать одну важную, но малозаметную особенность человеческой анатомии.
Если приглядеться к беспозвоночным, таким как дождевые черви, многоножки или осы, то можно увидеть, что их тело состоит из серии повторяющихся сегментов. Тело червя, например, представляет собой длинный цилиндр со множеством поперечных линий, маркирующих границу между смежными сегментами (рис. 21, а). Большинство сегментов тела червя на вид одинаковы, хотя сегменты головы, хвоста и репродуктивной области все-таки немного отличаются от остальных. Многоножка похожа по форме тела на червя, но каждый сегмент ее тела несет пару ног. Головной и хвостовой сегменты многоножки тоже отличаются от других сегментов. Брюшко осы тоже сегментировано, что подчеркивают цветные полосы, а если посмотреть через лупу, то видно, что сегментирована и грудь. Она состоит из трех сегментов, которые отличаются друг от друга. От каждого из них отходит пара конечностей, но только два сегмента несут еще и пару крыльев (чтобы убедиться, что у осы четыре крыла, нужно внимательно присмотреться: задние крылья малы и находятся очень близко к задней кромке передней пары).
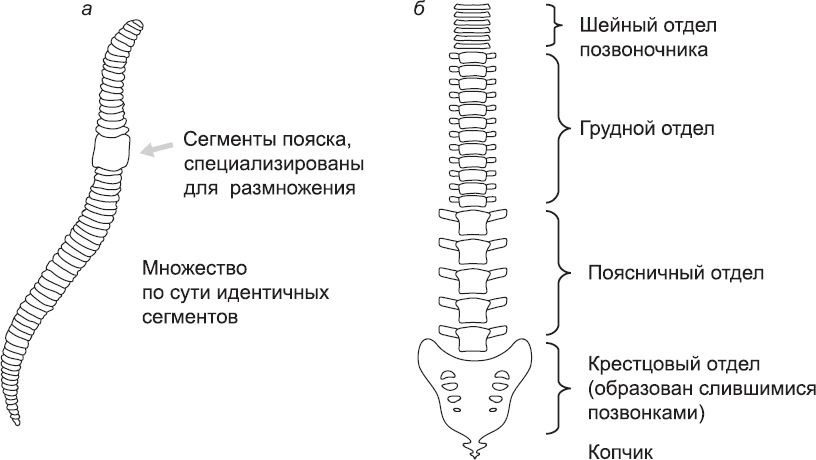
Рис. 21. Сегментация (а) дождевого червя, тело которого состоит из серии повторяющихся сегментов, и (б) человека, сегментация которого менее очевидна. Чтобы лучше продемонстрировать сегментированный характер позвоночника человека, на рисунке (б) не показаны конечности и ребра, а также голова и место соединения с ней (в том числе два самых верхних позвонка). Кроме того, изображение позвоночника немного стилизовано: на самом деле позвонки разных типов отличаются друг от друга рядом деталей
Деление тела на многочисленные сегменты, в основном схожие, но имеющие и определенные специализированные черты, зависящие от их положения в теле, является особенностью многих типов животных. У примитивных видов, например земляных червей, каждый сегмент удивительно самодостаточен с точки зрения физиологии: собственные простейшие легкие, почки, нервная система и т. д. Некоторые системы, например пищеварительная, проходят через все или большинство сегментов, а нервные системы разных сегментов соединены, и поэтому животное ведет себя как единое целое. Тем не менее формирование большей части тела за счет повторения базовых модулей дает большое преимущество, так как позволяет снова и снова использовать одни и те же генетические и клеточные системы. Благодаря такой экономии возникновение таких животных в процессе эволюции было менее маловероятным, чем возникновение животных, каждая часть которых уникальна. Сегменты наиболее схожи именно у самых примитивных животных (примитивных как в смысле простоты организации, так и с точки зрения раннего появления в палеонтологической летописи). В ходе дальнейшей эволюции появляется тенденция к специализации сегментов для выполнения особых задач, таких как полет и ходьба. По мере специализации сегменты становятся более взаимозависимыми с физиологической точки зрения, и на смену сегментам с собственной почкой, дыхательным аппаратом и т. д. приходят сегменты, полагающиеся на единые централизованные системы (выделительную, дыхательную и т. д.) всего организма. Позвоночные тоже сегментированы, хотя это не столь очевидно. Глядя на гладкое тело рыбы, трудно заподозрить, что она имеет сегментированное строение, но любой, кому случалось есть рыбу, замечал, что бо?льшая часть ее тела состоит из повторяющихся серий мышц, расположенных вдоль позвоночника, состоящего из повторяющихся серий позвонков и ребер. Люди, в чьей эволюционной родословной были похожие на рыб предки, тоже имеют сегменты, хотя их еще труднее разглядеть. Сегментированный характер строения человеческого тела проще всего увидеть на примере скелета, особенно позвоночника (рис. 21, б). Он состоит из тридцати трех позвонков, каждый из которых является вариацией на общую тему. Два верхних позвонка (в области шеи) служат для того, чтобы их владелец мог кивать и покачивать головой. В шейном отделе есть еще пять позвонков, далее идут двенадцать соединенных с ребрами позвонков в области груди. Еще ниже расположены пять массивных позвонков поясничного отдела, несущих значительную часть массы тела. И наконец, девять маленьких позвонков в самом низу позвоночного столба сливаются, образуя крестец и копчик. Мягкие ткани, которые крепятся к позвонкам, например мышцы, соединяющие соседние ребра, и нервы, идущие от разных частей тела к спинному мозгу, тоже имеют признаки сегментации. Сегментация прослеживается и в ряде других анатомических структур, но, как правило, на более тонком уровне.
В процессе эмбрионального развития сегментация человеческого тела начинается в мезодерме, лежащей слева и справа от нервной трубки. Клетки этой ткани, образовавшейся в процессе гаструляции (глава 4), вначале не очень прочно связаны между собой и не организованы каким-либо особым образом. В процессе сегментации, однако, эта ткань будет поделена на блоки, называемые сомитами, или первичными сегментами. Сомиты – предшественники позвонков, мышц и некоторых других структур тела. Они формируются не сразу, а последовательно, от шеи эмбриона к хвосту, и попарно (одновременно образуются два сомита – слева и справа от нервной трубки). У человеческого эмбриона каждая новая пара сомитов образуется примерно через шесть часов после предыдущей (рис. 22).
Задача превращения участка несегментированной ткани в сомит решается с помощью изменения адгезионных свойств клеток. Клетки, обладавшие высокими адгезионными свойствами в эктодерме до гаструляции, а затем превратившиеся в неплотную мезодерму, теперь повторно активируют свои адгезионные системы.[86] После этого они отделяются от своих бывших соседей по мезодерме и организуются в закрытые сферические структуры, похожие на цисты, – новые сомиты.
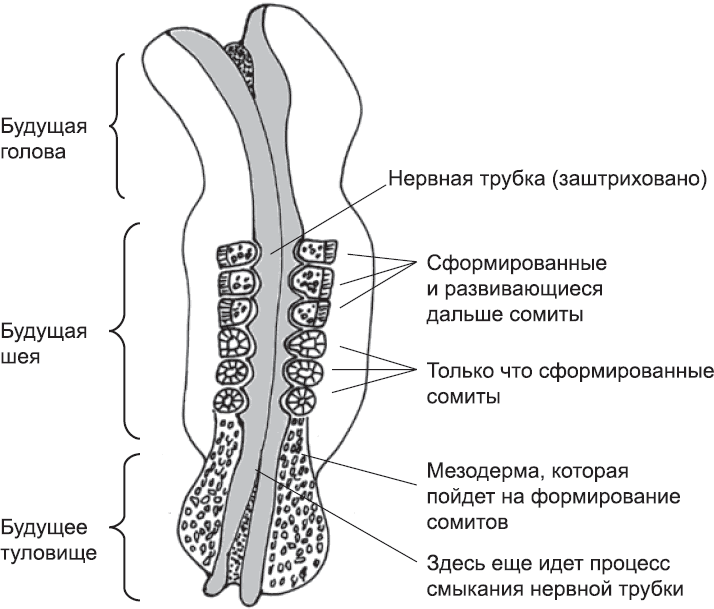
Рис. 22. Образование сомитов у человеческого эмбриона в возрасте примерно пяти недель. Уже сформированы шесть сегментов, которые дадут начало черепу и первым шейным позвонкам. Изображенный на рисунке зародыш по мере развития будет удлиняться в направлении низа страницы
Ясно, что все клетки несегментированной мезодермы не могут «включить» адгезию одновременно. Если бы это произошло, образовался бы один большой «мегасегмент» вместо необходимой серии небольших отдельных сомитов. Вместо этого эмбрион должен использовать какой-то особый механизм, чтобы сообщать коротким блокам клеток, что настал момент для изменения адгезионных свойств. При этом каждый сомит должен закончить формироваться еще до начала формирования следующего. Для выполнения этих условий клетки должны очень точно определять свое положение: находятся ли они именно в том ли месте, где должен образоваться сомит.
Уже на ранних этапах развития, когда эмбрион был еще очень мал, клетки по-разному реагировали на сигналы в зависимости от места и времени, например при создании первичной полоски. Например, во время гаструляции эмбрион был достаточно мал, чтобы градиент концентрации сигналов от ПВЭ определял примерную ориентацию оси «голова – хвост». Однако по мере роста эмбриона простой механизм градиентов концентрации стал все меньше подходить для разметки сложных структур организма. Чем длиннее ткань, которая должна быть размечена с помощью одного концентрационного градиента, тем более пологим будет градиент относительно размера любой клетки (рис. 23). Чем градиент более пологий, тем меньше разница концентраций для соседних клеток. Соответственно, клетке труднее «принимать решения», связанные с ее точным местоположением в эмбрионе. Системы концентрационных градиентов было вполне достаточно, чтобы наметить «черновые» различия поведения клеток раннего эмбриона, однако она просто не справится с задачей нанесения точной детальной разметки на тело, имеющее гораздо большую площадь.
Эмбрион решает эту проблему, не отбрасывая идею градиентов окончательно: он использует короткий градиент, чтобы определить границы одного сомита. Затем этот градиент, по длине равный длине сомита, передвигается вдоль эмбриона и используется снова и снова. Механизм, с помощью которого это достигается, кажется фантастическим по своей сложности, но его существование было подтверждено многочисленными кропотливыми экспериментами над эмбрионами различных видов животных. Несмотря на то что нам еще многое предстоит узнать об этом механизме, на данный момент мы знаем достаточно, чтобы сказать, что он вполне реален.
В течение всего этого процесса клетки мезодермы, еще не сегментированной и, следовательно, находящейся позади уже сформированных сомитов, синтезируют сигнальный белок под названием FGF.[87] Они делают это по умолчанию, и каждая из клеток будет продолжать синтезировать FGF, пока что-то ее не остановит. Клетки могут обнаружить секретированный ими же FGF, и это предотвращает такие изменения их адгезионных систем, которые необходимы для формирования сомита. Другими словами, еще не сегментированная мезодерма продолжает говорить себе «еще не пора» на языке FGF.[88]
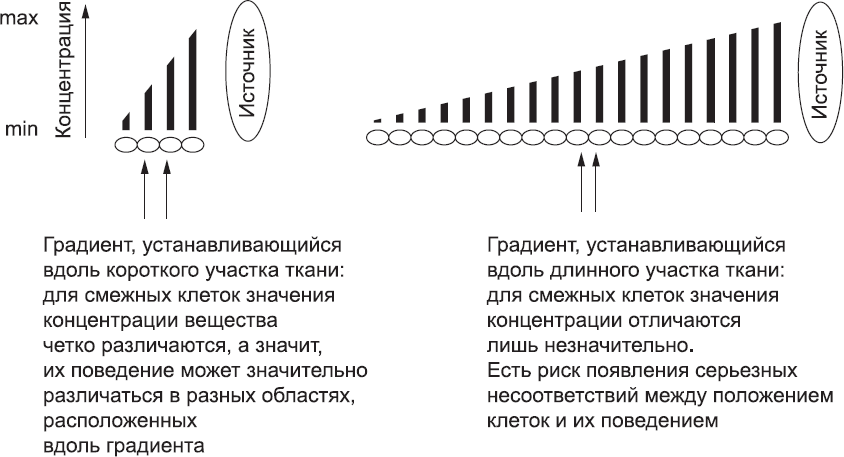
Рис. 23. Градиенты концентрации вещества, распространяющегося от источника, хорошо определяют положение клеток на небольших расстояниях, но с увеличением расстояния различия концентрации этого вещества для соседних клеток становятся незначительными. Учитывая «шум», свойственный биологическим системам, клеткам становится все труднее определить, находятся ли они внутри или же снаружи той концентрационной области, в которой их поведение должно измениться определенным образом. Фиксированные градиенты, следовательно, не подходят для разметки больших и сложных структур, формирование которых требует использования многих вариантов клеточного поведения, и не могут быть использованы для того, чтобы наметить границы между будущими сомитами эмбриона
Клетки, которые уже находятся в процессе создания сомитов, не выделяют FGF. Вместо этого они синтезируют еще одну сигнальную молекулу, ретиноевую кислоту, которая также образуется клетками в голове эмбриона. Ретиноевая кислота распространяется от последнего сомита к еще не сегментированной мезодерме. Она не может распространяться очень далеко, потому что мезодермой синтезируется молекула, которая разрушает ее. Тем не менее она может проникать в мезодерму в значительной концентрации на десятую долю миллиметра.[89] Ретиноевая кислота останавливает синтез FGF в мезодерме. Таким образом, образуется узкое «окно», или «разрешающая зона», в еще не сегментированной мезодерме, в котором не хватает FGF, чтобы предотвратить образование сомита (рис. 24).

Рис. 24. Противоположно направленные градиенты ретиноевой кислоты (РК) и FGF. Градиент РК имеет максимум на головном конце тела, а FGF – на хвостовом конце. Эти градиенты задают узкую «разрешающую зону», в которой клетки могут создавать новый сомит
Определение границ этого окна в пространстве является очень важной частью механизма, в ходе которого новые сомиты образуются один за другим, но этого пока недостаточно, чтобы решить проблему. В конце концов, если клетки смогут превратиться в сомиты, как только разрешающая зона перемещается достаточно далеко к хвосту, они будут делать это одна за другой. Никогда у каждого из сомитов не будет четкой задней части, потому что всегда другие клетки, избавившись от влияния ингибиторов, попытаются сказать «и я тоже!». Такая система не сможет разделить ткани на блоки, и все, что получится, это очень длинный, бесформенный «мегасомит». Однако эту проблему можно решить, если клетки не будут формировать сомит, пока разрешающая зона не переместится на расстояние, равное длине сомита, к хвосту.[90] Тогда все клетки в этой зоне будут иметь возможность участвовать в процессе. Но это возможно только тогда, когда разрешающая зона переходит на расстояние, равное длине следующего сомита, и так далее. Кажется, именно так устроена эта система в действительности: переключение между клетками в разрешающей зоне регулируется «тиканьем» молекулярных часов.
Эти «часы» состоят из сети белков, взаимно контролирующих синтез друг друга. В некоторых случаях они, прямо или косвенно, подавляют собственный синтез. Чтобы понять, как контролируемый синтез белков может превратиться в часы, стоит рассмотреть очень простую «игрушечную» систему. Она намного проще, чем в случае реальных сомитов: эта система состоит из одного-единственного гена, в последовательности которого закодирован белок, который синтезируется в момент активности гена и его же дезактивирует. Другими словами, белок подавляет собственный синтез. Будем считать, что подобный ген присутствует в клетках, так что работа основных биохимических процессов, связанных с синтезом белка, нам уже гарантирована. Напомним, что с активных генов сначала транскрибируются РНК – «копии». Затем с этой РНК в процессе трансляции синтезирует необходимый белок (глава 1).
Предположим, что процессы транскрипции и трансляции происходят за очень короткое время по сравнению со временем жизни РНК и молекул белка. Тогда в нашей системе-«игрушке» концентрация белка постепенно выйдет на стабильный уровень. Если в начале работы системы концентрация белка ниже этого уровня, активность гена не будет сильно подавляться. РНК будет синтезироваться и транслироваться, а концентрация белка при этом вырастет. Появится больше молекул белка, которые будут ингибировать активность гена, и производство новых белковых молекул будет снижаться до тех пор, пока не выйдет на уровень, позволяющий лишь компенсировать потерю белка, связанную с окончанием срока жизни молекул (рис. 25, а). Если же концентрация этого белка изначально слишком высока, работа гена будет подавляться, и новые белки не будут синтезироваться до тех пор, пока исходная концентрация белка не понизится за счет старения и распада молекул (рис. 25, б). Основная функция этой сетевой системы состоит в том, чтобы поддерживать концентрацию белка в четко заданных пределах. Для белков-долгожителей (срок их жизни измеряется в часах и днях) небольшое запаздывание в работе системы, связанное с паузами на транскрипцию и трансляцию (на них уходят минуты), не имеет большого значения. Такие системы используются клетками для поддержания количества отдельных молекул в пределах допустимого.
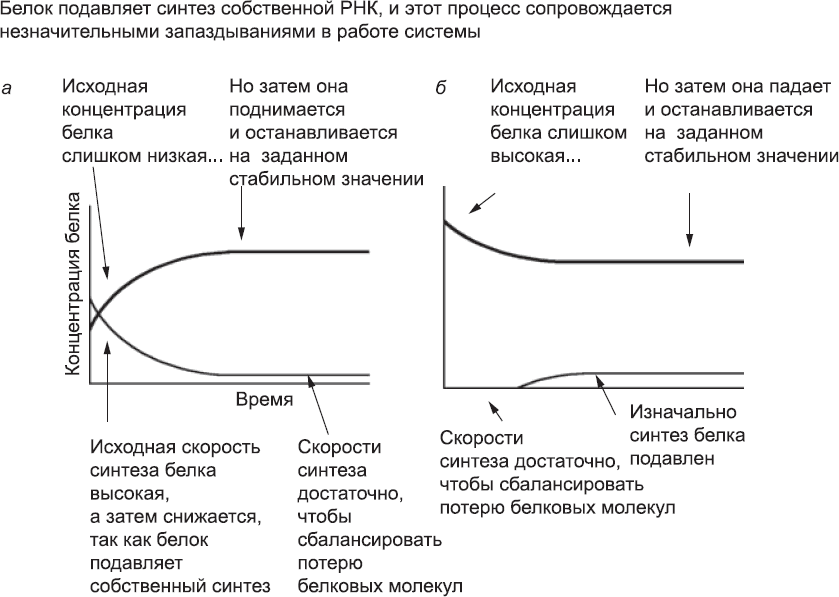
Рис. 25. Поведение системы, в которой белок (обозначен жирной линией) подавляет синтез собственной РНК (обозначена тонкой линией). В результате возникает запаздывание, незначительное по сравнению со временем жизни белка. Даже если исходная концентрация белка слишком низкая (а) или слишком высокая (б), она все равно придет к стабильному значению. Сравните этот рисунок с рис. 26
Если теперь предположить, что белок «живет» так недолго, что время, необходимое для его создания, сопоставимо со временем его жизни, поведение системы становится совершенно другим. Рассмотрим ситуацию, когда в нашей модельной системе концентрация белка очень низкая. В присутствии небольшого количества белка транскрипция гена не подавляется и может проходить быстро. С некоторым запаздыванием увеличивается концентрация РНК, а немного позже, по мере трансляции РНК, вырастет и концентрация белка. С увеличением числа молекул белка транскрипция гена подавляется, но, пока концентрация РНК достаточно высока, белок будет производиться за счет трансляции этой РНК до тех пор, пока она не деградирует. В результате концентрация белка превысит «пороговый» уровень (рис. 26). По-настоящему высокой концентрации белка достаточно, чтобы полностью выключить транскрипцию гена. По мере того как молекулы РНК и белка деградируют, концентрация белка уменьшится, и транскрипция начнется снова. Однако из-за запаздывания, связанного с транскрипцией и трансляцией, понадобится некоторое время, прежде чем концентрация белка начнет расти. Быстрое разрушение белка говорит о том, что его концентрация резко уменьшается и «пороговый» уровень опять будет перейден, но уже в обратном направлении. В системе опять становится слишком мало белка, а это значит, что цикл начнется снова. Запаздывания, связанные с транскрипцией и трансляцией, вызывают многократные резкие скачки системы: от низких значений концентрации к высоким. В результате вместо стабильности мы получаем чередование высоких и низких уровней концентрации белка. Это напоминает тиканье часов.
Сетевая система «часов сегментации» значительно сложнее, чем один белок, контролирующий собственный синтез.[91] Судя по всему, функциональное ядро этих часов основано на системе реакционных петель с отрицательной обратной связью (это означает, что их компоненты репрессируют сами себя), похожих на те, что уже были описаны. Они зависят от белков, время жизни которых коротко по сравнению со временем, которое затрачивается на транскрипцию и трансляцию, необходимые для их синтеза. В работу часов вовлечено большое количество белков. Они способствуют стабильной работе часов и «сверяют» часы соседних клеток. У мышей полный цикл «часов сегментации» занимает около двух часов. Одна фаза этого цикла дает разрешение любой клетке, находящейся в разрешающей зоне еще не сегментированной мезодермы (с низким содержанием FGF), принять участие в создании сомита. Идет чередование фаз. В короткую фазу часов («тик») клетки в окне с малым содержанием FGF могут стать клетками сомита. В долгую фазу («так») они не участвуют в образовании сомита, даже если находятся в пределах разрешающей зоны. Такое чередование означает, что у разрешающей зоны есть запас времени для продвижения к хвостовой части на длину сомита до того, как клетки, обнаружившие, что они находятся в этой зоне, смогут поучаствовать в создании сомита.
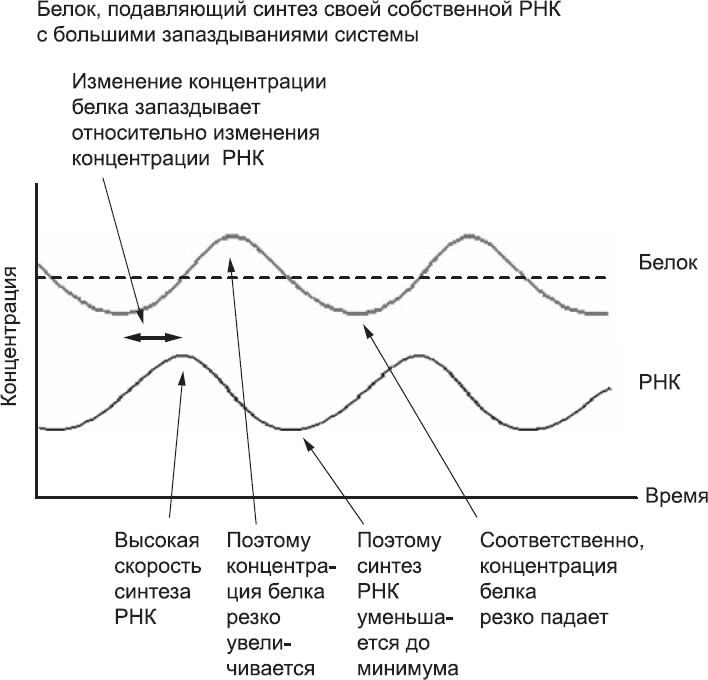
Рис. 26. Поведение системы, в которой белок подавляет синтез собственной РНК. Запаздывание в системе достаточно велико относительно времени жизни белка. В начале рассматриваемого периода исходно высокая концентрация белка понижается. При этом концентрация РНК низкая. Концентрация короткоживущих белков продолжает падать, и хотя на данный момент она и так слишком мала, чтобы ингибировать синтез РНК, понадобится довольно много времени для накопления РНК. Концентрация белка опускается ниже среднего уровня, и благодаря этому РНК синтезируется в больших количествах и аккумулируется. За счет повышения концентрации РНК концентрация белка тоже постепенно увеличивается и переходит средний уровень еще до того, как белку удается подавить синтез новой РНК. В этой модели скачки многократно повторяются. Так и создается некое подобие осциллятора, или «часов»
Затем мезенхима образует блоки, длина которых определяется протяженностью разрешающей зоны и частотой тиканья часов (рис. 27). Рассмотренный здесь механизм работы часов приводит к ряду интересных эффектов: если бы часы шли быстрее, разрешающая зона не продвинулась бы так далеко в хвостовую часть. Это привело бы к возникновению большего количества более мелких сомитов. У таких животных, как змеи, гораздо больше позвонков, чем у людей. Эмбрионы змей создают больше сомитов. Недавно ученые исследовали часы сегментации в эмбрионе змеи. Оказалось, что они работают гораздо быстрее, чем у мышей или людей. Все соответствует вышеизложенной теории.[92]
Четыре механизма действуют на локальном, клеточном, уровне. Производство ретиноевой кислоты, производство FGF, часы сегментации, рост эмбриона по направлению к хвосту – все это позволяет интегрировать пространство и время так, чтобы клетка могла «решить», участвовать ли ей в создании нового сомита. У клеток нет карты внутреннего строения эмбриона. Они даже не знают собственного места нахождения. Мы опять сталкиваемся с ситуацией, в которой клетки могут самоорганизоваться в сложно устроенные структуры достаточно большого пространственного масштаба, используя только набор локальных правил.
Описанная выше система решает проблему деления мезенхимы на серию сегментов. Это не решает проблему создания на основе сомитов структур, которые не одинаковы на разных уровнях передне-задней оси, скажем позвонков в организме человека. Сомиты в грудной области, например, специализируются на формировании позвонков среднего размера, к которым крепятся ребра. Сегменты поясничного отдела формируют крупные позвонки. К ним ребра уже не крепятся! Сомиты в области крестца формируют мелкие позвонки, которые сливаются воедино, чтобы образовать заднюю часть костяного кольца, которая защищает область таза. В связи с этим клетки каждого сомита должны «знать», в какой области организма они находятся. После многолетних генетических исследований ученые начинают догадываться, каким образом клетки это «понимают». По нашим нынешним соображениям, эта система использует время, переводя пространственную информацию с молекулярного уровня на уровень эмбриона как целого. Безусловно, по мере дальнейших исследований наши представления о работе этой системы могут и измениться.
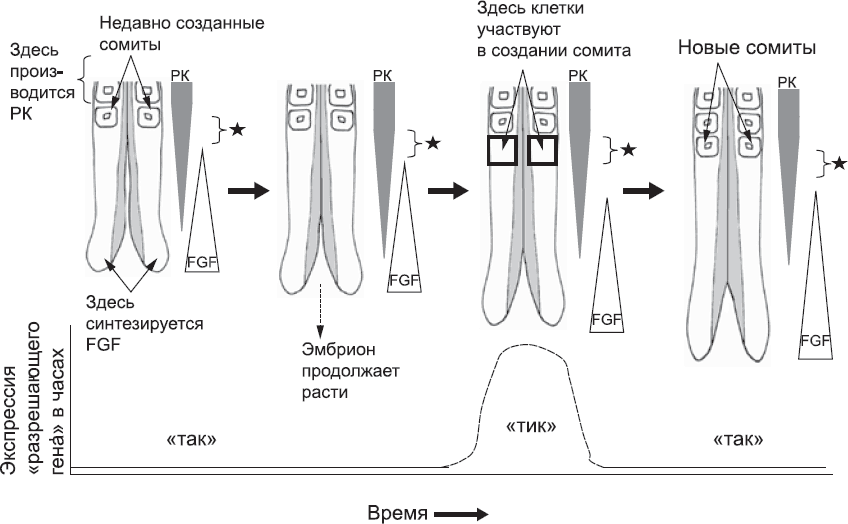
Рис. 27. Принятая в настоящее время модель использования времени и пространства для разделения непрерывного слоя ткани на сомиты. Диаграмма слева, как на рис. 24, отображает заднюю часть эмбриона сразу после формирования новой пары сомитов. Ретиноевая кислота (РК), синтезированная более ранними сомитами, распространяется к хвосту и постепенно расходуется. На диаграмме это показано заштрихованными перевернутыми треугольниками. Белок FGF, синтезируемый в хвостовой почке, распространяется к голове и также постепенно уходит (на диаграмме это отмечено треугольниками). Соотношение РК к FGF варьируется на разных участках оси «голова – хвост» мезенхимы вплоть до последних сомитов. Если клетки находятся в определенном диапазоне соотношения РК к FGF, они могут участвовать в формировании сомита. «Разрешающая зона» отмечена на схеме черной звездочкой. С течением времени рост хвостовой части эмбриона продолжается. Созревающие сомиты начинают синтезировать РК. Так «окно», определяющее клетки, которые будут создавать новый сомит, постепенно продвигается к «хвосту». Клетки в этой зоне возьмутся за формирование сомита только тогда, когда часы находятся в фазе «тик». К тому времени, когда случится следующий «тик», клетки, создававшие сомит, завершат свою работу. Так вырисовывается четкая граница между старыми и новыми сомитами. Затем процесс повторяется столько раз, сколько нужно, чтобы создать все сомиты тела
Необходимая пространственная информация хранится на молекулярном уровне в самой ДНК в виде четырех генных кластеров. Типов так называемых HOX-генов всего тринадцать. Их так и принято нумеровать: от 1 до 13. В каждом из четырех кластеров – HOXA, HOXB, HOXC и HOXD – HOX-гены, расположены в порядке нумерации (рис. 28). Таким образом, ген типа 1 в кластере HOXA называется HOXA1, ген типа 1 в кластере HOXB – HOXB1. Следовательно, в кластере HOXA гены располагаются в порядке HOXA1, A2, A3 и т. д. Ни в одном кластере нет версии каждого гена от 1 до 13. Таким образом, если положение генов изобразить на диаграмме, поместив гены одного типа в одну колонку, в каждом HOX-кластере будут пробелы (рис. 28). Есть весомые свидетельства того, что у наших далеких предков был только один HOX-кластер (именно этот кластер по-прежнему есть у насекомых, например у мучного хрущака), но в процессе эволюции позвоночных HOX-кластер был скопирован дважды. Так образовались первые два кластера (как у бесчелюстные позвоночных), а затем и еще два (как у челюстноротых позвоночных).[93] Это объясняет, почему HOXA1 так похож на HOXB1, а HOXA2 так напоминает HOXB2 и т. д. С тех пор каждый кластер утратил некоторые гены. Предположительно это случилось потому, что вскоре после дублирования гены были настолько похожи, что любой из них мог заменять другой. Потеря предками гипотетического H OX D 6, например, не имела значения, если H OX A 6, H OX B 6 и HOXC6 могли выполнять все его функции. Со временем однотипные гены разных кластеров мутировали и приобретали значительные функциональные отличия, а значит, дальнейшие потери стали невозможны. Верить или не верить таким историям об эволюции – решать вам. Факт в том, что человеческие HOX-кластеры теперь имеют такой вид (рис. 28).
Поразительно, что в течение каких-то 460 млн лет челюстноротые позвоночные плавали, ходили или летали, а порядок HOX-генов внутри кластера ни разу не менялся! При этом большинство других генов уже пережили огромное количество перемен и многократно меняли взаимное расположение. На сегодняшний день последовательность генов у разных типов животных отличается. Причины такого постоянства расположения HOX-генов в кластере напрямую связаны с порядком специализации сегментов вдоль оси тела.
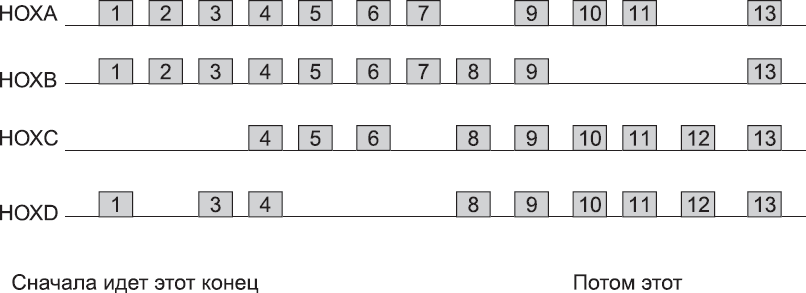
Рис. 28. Генетическая структура четырех человеческих HOX-кластеров. Каждая горизонтальная линия обозначает непрерывную область хромосомы. Каждая ячейка с номером – ген HOX (например, ячейка 1 кластера HOXA – HOXA1 и т. д.)
Генные HOX-кластеры начинают проявлять активность в структурировании организма уже во время гаструляции. На каждом участке оси от шейного отдела к поясничному эта активность проявляется незадолго до образования сомитов. В то время как клетки в ходе гаструляции продвигаются через узелок, активируются гены с левого конца HOX-кластеров («левый» на рис. 28). Процесс начинается с будущего шейного к поясничному отделу. Позже, когда клетки, направленные на формирование задней части тела, вовлекаются в гаструляцию, активируются и гены, расположенные правее в HOX-кластерах. Еще через некоторое время, когда гаструляция продвинется дальше по оси «голова – хвост», активизируются гены, изображенные на рис. 28 правее. В каждом случае клетки «запоминают» набор HOX-генов, которые они «подключили», как только появились из узелка. Они в течение долгого промежутка времени поддерживают активность этих генов. Возможно, не стоило так упрощать, но в данном случае это даже полезно.
Таким образом, клетки, которые проходят стадию гаструляции раньше, «включают» HOX-гены слева (см. рис. 28). Клетки, подвергшиеся гаструляции позже, активируют HOX-гены справа. Как это можно контролировать? Есть способы. Можно направить процесс активации потенциальных генов направо через кластеры HOX-генов. Клетки в это время ожидают гаструляции. Согласно этой идее, когда клетка ныряет через узелок, чтобы гаструляция произошла, она на самом деле активирует экспрессию множества HOX-генов, которые потенциально могут быть задействованы в нужный момент. Она помнит этот набор. Клетки, которые гаструлируют позже, находятся дальше от будущей головы эмбриона, экспрессируют набор генов дальше вправо (см. рис. 28). Так волна активации потенциальных генов будет иметь больше времени для продвижения направо через кластер. По этому механизму, порядок генов в HOX-кластерах на молекулярном уровне транслируется на порядок экспрессии генов HOX на эмбриональном уровне. А эмбрион уже достиг миллиметрового диапазона. Это один из немногих примеров взаимосвязи генетической и эмбриональной структуры.
Прежде чем изучать последствия экспрессии генов на разных уровнях оси «голова – хвост», стоит потратить немного времени, чтобы выяснить, как волна активации потенциальных генов в первую очередь проходит через HOX-кластеры. Детали этого процесса до сих пор тщательно исследуются, но общая схема механизма, кажется, начинает вырисовываться сквозь дымку множества экспериментальных результатов. В хромосомах ДНК может быть довольно компактно упакована среди белков. Это полезно для экономии пространства, но при этом гены недоступны для транскрипции. Принципиально ДНК может быть и в свободной, легко доступной форме. Большую часть времени многие участки хромосом плотно упакованы, а более свободные «петли» ДНК выходят за их пределы. Некоторые участки упакованы плотно. Некоторые никогда не были так упакованы. Некоторые из них могут быть в любом состоянии, в зависимости от присутствия того или иного ДНК-связывающего белка. Последние данные, полученные в ходе экспериментов над мышиными эмбрионами, позволяют предположить, что по крайней мере один из hoх-кластеров,[94] hoxb, может быть в любом из обозначенных состояний.
Перед активацией hoxb-генов кластер в компактном состоянии. Из всех генов hoxb-кластера самый правый ген (hoxb13) «похоронен» в глубине компактного клубка. hoxb1 наиболее доступен, будучи в начале компактной зоны. Экспрессия генов hoxb зависит от освобождения из этой «компактной тюрьмы». Это может случиться, если специфичные последовательности ДНК-связывающих белков присоединятся к ДНК с наиболее доступного конца и «перепрограммируют» упаковочные белки, так чтобы они позволили ДНК принять более свободную, петлеобразную форму. Эти ДНК-связывающие белки активируются ретиноевой кислотой. Эффект ретиноевой кислоты на hoxb-кластер настолько мощный, что его можно разглядеть даже в мышиных СКЭ, выращенных в простой чашке Петри.[95] Если постепенно добавить туда небольшое количество ретиноевой кислоты, «спрессованный» hoxb-кластер начинает ослабевать с конца. Так что hoxb1, hoxb2, hoxb3 и так далее будут доступны для транскрипции (рис. 29). Все это требует времени, что не удивительно, учитывая, что в ДНК hoxb-кластера около 150 000 оснований. Освобождение HOXb гена – постепенный процесс. Необходимо осуществлять контроль над порядком их «укладки» в кластере. Вероятно, то же самое верно[96] для hoxa-, с – и d-кластеров мыши и, по аналогии, для всех кластеров HOX человека.
Получение петли из hoxb-кластера также наблюдается в эмбрионе мыши. Скорость «разматывания» и волны активации генов совпадают с той скоростью, с которой гаструляция распространяется по направлению к «хвосту».[97] Таким образом, можно смело надеяться на то, что описанный выше механизм верен, хотя мы уже знаем, что его сопровождает огромное количество дополнительных сложностей. Необходимо убедиться, что клетки «запоминают» те гены для экспрессии, и это должно быть согласовано с соседними клетками. При этом отключаются гены слева, а те, что справа, подвергаются экспрессии. Тщательная систематизация всего этого процесса может стать делом жизни многих исследователей.
Человеческие HOX-гены (как и мышиные hox-гены) очень важны, поскольку существует связь между набором HOX-генов, экспрессированных сомитом, и типом будущего позвонка.[98] Например, третий, четвертый и пятый позвонки шейного отдела очень похожи: образовавшие их клетки экспрессируют тот же набор генов. Следующие два позвонка от них отличаются, и их клетки уже экспрессируют другие наборы HOX-генов.
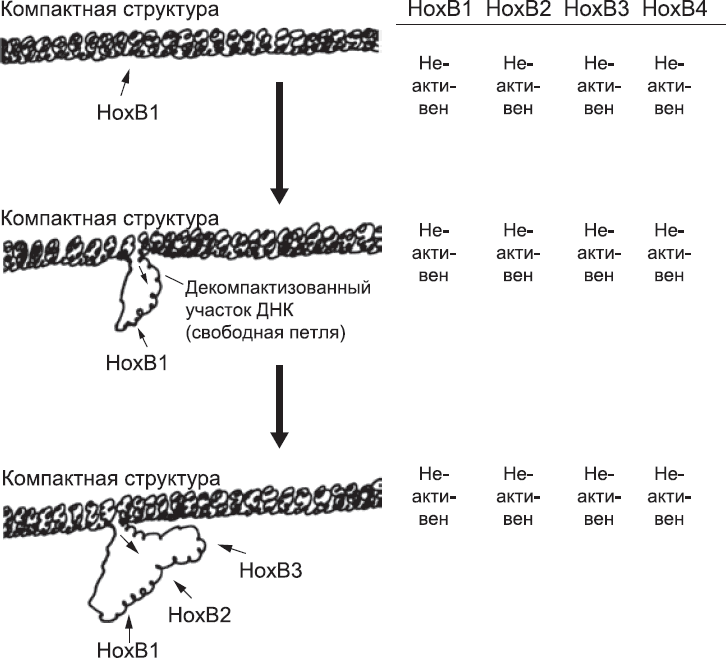
Рис. 29. Постепенное изменение структуры HOX-кластера, от компактной до более рыхлой, высвобождает большее количество генов для транскрипции в том порядке, в котором они расположены в кластере
У различных видов животных число позвонков варьируется. У кур, например, четырнадцать шейных позвонков, а у мышей, как и у нас, – семь. В обоих случаях тем не менее начало экспрессии генов типа HOX6 (Hoxa6, Hoxb6 и т. д.) знаменует конец сомитов, создающих шейные позвонки, и начало тех, которые образуют позвонки грудного отдела. Поэтому гены HOX коррелирует с типом позвонков, а не просто с их числом. Аналогично начало экспрессии генов типа HOX10 означает конец сомитов, идущих на грудные позвонки, и начало тех, которые создают позвонки поясничного отдела. Гены типа HOX11 отвечают за переход от поясничного к крестцовому позвонку. Все это подтверждает, что тип HOX-генов может определять вид позвонков, который создадут сомиты.
Эта идея была проверена экспериментально в ходе генной инженерии эмбрионов мыши. Из них убирали один или несколько Hox-генов и наблюдали последствия этой операции для развития. В шейном отделе нормальной мыши должен быть один первый позвонок («атлант») и один второй («ось»). У каждого из них своя специфика, они позволяют по-разному осуществлять кивки и вращения головы. У третьего, четвертого и пятого позвонков форма, характерная для позвонков шейного отдела. При удалении гена Hoxa4 третий, неспециализированный, позвонок развивается как второй, осевой. Клетки как будто «думают», что они ближе к головной части зародыша. Кроме того, у мышей без генов Hoxa7 и Hoxb7, отвечающих за первые позвонки грудного отдела, позвонки, к которым должны крепиться ребра, развиваются как позвонки шеи, без ребер. Опять же, без этих генов клетки ведут себя так, как если бы они были ближе к голове, чем на самом деле. С другой стороны, когда удаляются Hoxa5 и Hoxa6, клетки в той же области тела «думают», что должны располагаться дальше от головы, где эти гены, естественно, дезактивируются. В результате седьмой позвонок шейного отдела имеет ребра, как полагается первому позвонку грудного отдела. То же происходит и ниже, если гены по правую сторону (см. рис. 28) удаляются.
В обеих системах сегментации, будь то «часы» и градиенты, благодаря которым тело делится на сомиты, или система HOX-генов, сообщающая клеткам этих сомитов специализацию, в масштабах организма протекают простые локальные процессы. В обоих случаях в этих процессах используются определенные временные промежутки для создания структур в пространстве. Это еще один пример того, как сложные клеточные системы эмбрионального развития пользуются простейшими математическими принципами и создают нечто гораздо большее, чем они сами.
| <<< Назад Глава 5 Формирование мозга |
Вперед >>> Часть II Постепенная детализация |
- Определение поясного времени
- 10.1.1. Распределение жизни в биосфере
- Разделение труда в клетке
- 9.3.3. Распределение биологической продукции
- Определение психологического типа
- Определение географических координат
- Определение величины стресса
- Международное географическое разделение труда
- Определение расстояний на карте
- Современное и прежнее распределение суши и моря
- 3.4. Деление клетки. Митоз
- Геномная эволюция путем дупликации генов, модель рождения и смерти гена и универсальное распределение численности парало...
