Книга: Естествознание. Базовый уровень. 11 класс
§ 8 Энтропия и вероятность
| <<< Назад § 7 Энтропия |
Вперед >>> § 9 Информация |
Разделы на этой странице:
§ 8 Энтропия и вероятность
Вопрос. Во сне приснились мышата и крысята в клетке, их было так много, я их кому-то показываю и открываю клетку, они разбегаются, а я их ловлю и в клетку обратно запихиваю! Вроде всех собрала обратно! К чему это?
Ответ. Всякий процесс сопровождается равномерным распределением в пространстве и, соответственно, ростом энтропии. Обратный процесс возможен только с использованием внешнего воздействия.
Итак, что же можно измерить с помощью энтропии? Если бы всё сводилось только к движению молекул и тепловым процессам, понятие энтропии не получило бы такого широкого распространения и популярности и не вышло бы за границы термодинамики.
Энтропию можно использовать при изучении самых различных явлений, а не только тех, которые сводятся к кинетической энергии молекул. Что же именно может характеризовать энтропия в универсальной картине мира? Очевидно, то же самое, что и в термодинамике, – степень беспорядка и хаоса.
Предположим, что у нас имеется некоторое число ячеек, в которые можно помещать одинаковые предметы в любом количестве.
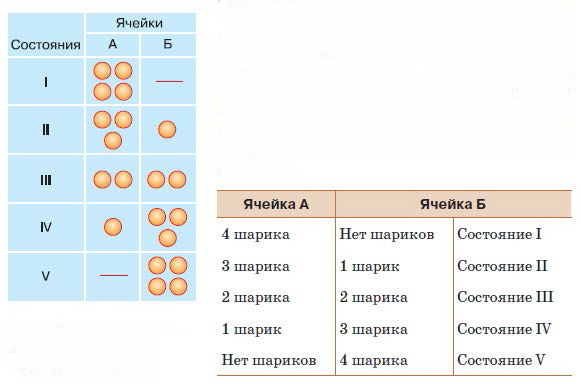
Рис. 17. Схема возможных распределений шариков по ячейкам
В самом простом случае будем иметь дело всего с двумя ячейками и с четырьмя шариками, которые можно произвольно раскладывать по этим ячейкам. Обозначим ячейки как А и Б, а шарики пронумеруем – 1, 2, 3 и 4. Как можно распределить четыре шарика по двум ячейкам? На первом этапе мы не будем принимать во внимание номера шариков, а просто посмотрим, сколько их в каждой ячейке (рис. 17).
Легко убедиться в том, что существует пять вариантов расположения шариков. Обозначим их как состояния I, II, III, IV и V. Теперь обратим внимание на номера шариков и будем учитывать не только, сколько шариков находится в каждой ячейке, но и какие именно шарики там находятся. Мы увидим, что для каждого из состояний существует разное число способов размещения шариков. Состояние I можно осуществить единственным способом, поместив все четыре шарика в ячейку А. Состояние II допускает четыре способа распределения: в ячейке Б может оказаться любой из четырёх шариков. Состояние III (рис. 18) можно реализовать шестью способами. Наконец, состояния IV и V можно осуществить с помощью соответственно четырёх и одного вариантов, так же как и состояния II и I.
А теперь сравним вероятности того, что при случайном перемешивании шариков реализуется какое-либо из пяти возможных макросостояний. Вспомним сведения, которые мы получили ранее. Вероятность события определяется отношением числа благоприятных событий к общему числу возможных событий. В данном случае общее число событий равно 1 + 4 + 6 + 4 + 1 = 16, т. е. четыре шарика можно распределить по двум ячейкам шестнадцатью способами. Поскольку состояния I и V можно реализовать единственным способом, вероятность того, что все шарики окажутся в ячейке А, так же как и вероятность того, что все они попадут в ячейку Б, будет равна 1?16. Вероятность того, что в ячейке А (или Б) окажется один шарик, а остальные попадут в другую ячейку, равна 4/16. Вероятность же того, что шарики расположатся равномерно, по два в каждой ячейке, составит 6/16. Можно подсчитать эти вероятности для любого числа ячеек и для любого числа шариков (или молекул), и всякий раз мы будем убеждаться в том, что чем равномернее распределены предметы по ячейкам, тем вероятнее такое распределение. В этом нетрудно убедиться на любом примере. Насыплем в стакан с водой немного сахарного песка.
Сначала наибольшая концентрация сахарного сиропа будет возле дна стакана, но со временем сахар растворится, и концентрация выравняется по всему объёму.
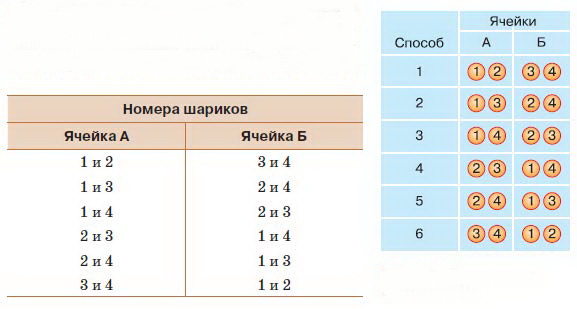
Рис. 18. Реализация состояния III
Представить, что молекулы сахара самопроизвольно соберутся в некоторой части сосуда, практически невозможно, потому что вероятность такого события ничтожно мала.
Таким образом, вероятность состояния с равномерным распределением оказывается наибольшей по сравнению со всеми другими возможными состояниями, и все естественные процессы направлены в сторону достижения этого наиболее вероятного состояния. Но мы также знаем, что в результате всех природных процессов происходит увеличение энтропии. Напрашивается вывод, что между вероятностью существования данного состояния и энтропией должна существовать связь. Эта связь действительно существует, и впервые её охарактеризовал Л. Больцман. Он имел в виду термодинамические процессы, а мы будем рассуждать в рамках наших ячеек и шариков.
Будем называть, как это сделал Больцман, наши состояния I–V макросостояниями. Макросостояние определяется тем, сколько шариков находится в данной ячейке, и не интересуется тем, какие шарики там находятся. В противоположность этому микросостояние определяется тем, какие именно шарики в какой ячейке находятся. Понятно, что, для того чтобы определить микросостояние, требуется более глубокое и внимательное изучение (например, цифры на шариках могут быть едва заметными), поэтому оно так и называется. Разным макросостояниям соответствует различное число микросостояний. Чем более равномерным является распределение шариков по ячейкам, тем больше вероятность такого макросостояния и тем больше микросостояний ему соответствует. Но для такого состояния характерна и наибольшая энтропия. Из этого Больцман сделал вывод, что энтропию данного макросостояния можно измерить числом микросостояний, которым оно определяется. Более точно, энтропия пропорциональна логарифму этого числа. В физике энтропию принято обозначать буквой S, поэтому формулу, выведенную Больцманом, можно представить так:
S = klog W,
где k – коэффициент пропорциональности, а W – число микросостояний, соответствующих данному макросостоянию.
Состояние I, так же как и состояние V, определяется единственным микросостоянием. Так как логарифм единицы по любому основанию равен нулю, то и энтропия этих состояний равна нулю. Это значит, что в этих состояниях существует абсолютный порядок. Число микросостояний, которые определяют макросостояния I и IV, равно четырём, а значит, энтропия каждого из них равна log 4. Величина этого логарифма зависит от того, какое основание для логарифмирования мы выберем. Вообще говоря, основание может быть любым, так как в зависимости от этого изменится только коэффициент пропорциональности. Но по причинам, о которых вы узнаете в дальнейшем, нам будет удобно выбрать основание 2. Тогда энтропия макросостояний I и IV будет равна двум. Самым «беспорядочным» из наших макросостояний будет состояние III, которое может осуществиться шестью микросостояниями. Следовательно, энтропия этого, наиболее вероятного, состояния равна логарифму 6 по основанию 2, что составляет приблизительно 2,6.
Проверьте свои знания
1. Что такое макро– и микросостояние?
2. Чему равна энтропия макросостояния, которое обеспечивается единственным микросостоянием?
3. Почему макросостояние, при котором число шариков в каждой ячейке одинаково, оказывается наиболее вероятным?
4. Какие у создателей статистической физики были основания сопоставить вероятность состояния с его энтропией?
Задания
Предположим, что у нас имеется 6 шариков, которые могут быть распределены по двум ячейкам.
A. Составьте таблицу, в которой будут указаны все возможные макросостояния.
Б. Составьте таблицу, в которой будут указаны все микросостояния для каждого макросостояния.
B. Найдите вероятность каждого макросостояния.
| <<< Назад § 7 Энтропия |
Вперед >>> § 9 Информация |
- § 1 Порядок и беспорядок в строении веществ
- § 2 Теплота и температура
- § 3 Идеальный газ и его законы
- § 4 Энергия и работа
- § 5 Теплота и работа
- § 6 Законы термодинамики
- § 7 Энтропия
- § 8 Энтропия и вероятность
- § 9 Информация
- § 10 Информация, вероятность и энтропия
- § 11 Свойства информации и двоичная система счисления
- § 12 Ценность и избыточность информации
- § 13 Самоорганизующиеся системы
- § 14 Лазеры как неравновесные самоорганизующиеся системы
- § 15 Синергетика – наука о самоорганизации
- § 16 Области применения синергетики
- § 72 Вероятность
- КЕПЛЕР И ЭНТРОПИЯ
- § 5 Теплота и работа
- § 3 Идеальный газ и его законы
- § 16 Области применения синергетики
- § 9 Информация
- § 7 Энтропия
- § 13 Самоорганизующиеся системы
- § 10 Информация, вероятность и энтропия
- § 2 Теплота и температура
- § 1 Порядок и беспорядок в строении веществ
- Эволюционная энтропия и сложность
