Книга: Общая химия
18. Периодическая система элементов.
| <<< Назад 17. Периодический закон Д. И. Менделеева. |
Вперед >>> 19. Значение периодической системы. |
18. Периодическая система элементов.
Ряды элементов, в пределах которых свойства изменяются последовательно, как, например, ряд из восьми элементов от лития до неона или от натрия до аргона, Менделеев назвал периодами. Если напишем эти два периода один под другим так, чтобы под литием находился натрий, а под неоном — аргон, то получим следующее расположение элементов:

При таком расположении в вертикальные столбцы попадают элементы, сходные по своим свойствам и обладающие одинаковой валентностью, например, литий и натрий, бериллий и магний и т.д.
Разделив все элементы на периоды и располагая один период под другим так, чтобы сходные по свойствам и типу образуемых соединений элементы приходились друг под другом, Менделеев составил таблицу, названную им периодической системой элементов по группам и рядам. Эта таблица в современном виде, дополненная открытыми уже после Менделеева элементами, приведена в начале книги. Она состоит из десяти горизонтальных рядов и восьми вертикальных столбцов, или групп, в которых один под другим размещены сходные между собой элементы.
- 49 -
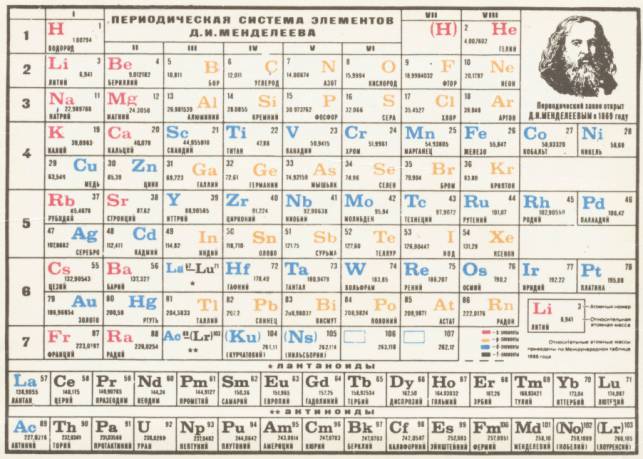
Обратим вначале внимание на расположение элементов в горизонтальных рядах. В первом ряду стоят только два элемента — водород и гелий. Эти два элемента составляют первый период. Второй и третий ряды состоят из рассмотренных уже нами элементов и образуют два периода по восьми элементов в каждом. Оба периода начинаются со щелочного металла и заканчиваются благородным газом. Все три периода называются малыми периодами.
Четвертый ряд также начинается со щелочного металла — калия. Судя по тому, как изменялись свойства в двух предыдущих рядах, можно было бы ожидать, что и здесь они будут изменяться в той же последовательности и седьмым элементом в ряду будет опять галоген, а восьмым — благородный газ. Однако этого не наблюдается. Вместо галогена на седьмом месте находится марганец — металл, образующий как основные, так и кислотные оксиды, из которых лишь высший Mn2O7 аналогичен соответствующему оксиду хлора (Cl2O7). После марганца в том же ряду стоят еще три металла — железо, кобальт и никель, очень сходные друг с другом. И только следующий ряд, пятый ряд, начинающийся с меди, заканчивается благородным газом криптоном. Шестой ряд снова начинается со щелочного металла рубидия и т.д. Таким образом, у элементов, следующих за аргоном, более или менее полное повторение свойств наблюдается только через восемнадцать элементов, а не через восемь, как было во втором и третьем рядах. Эти восемнадцать элементов образуют четвертый — так называемый большой период, состоящий из двух рядов.
Пятый большой период составляют следующие два ряда, шестой и седьмой. Этот период начинается щелочным металлом рубидием и заканчивается благородным газом ксеноном.
В восьмом ряду после лантана идут четырнадцать элементов, называемых лантаноидами ( или лантанидами), которые чрезвычайно сходны с лантаном и между собой. Ввиду этого сходства, обусловленного особенностью строения их атомов (см § 32), лантаноиды обычно помещают вне общей таблицы, отмечая лишь в клетке для лантана их положение в системе.
Поскольку следующий за ксеноном благородный газ радон находится только в конце девятого ряда, то восьмой и девятый ряды тоже образуют один большой период — шестой, содержащий тридцать два элемента.
В больших периодах не все свойства элементов изменяются так последовательно, как во втором и третьем. Здесь наблюдается еще некоторая периодичность в изменении свойств внутри самих периодов. Так, высшая валентность по кислороду вначале равномерно растет при переходе от одного элемента к другому, но затем, достигнув максимума в середине периода, падает до двух, после чего опять возрастает до семи к концу периода. В связи с этим большие периоды разделены каждый на две части (два ряда).
- 50 -
Десятый ряд, составляющий седьмой — пока незаконченный — период, содержит девятнадцать элементов, из которых первый и последние тринадцать получены лишь сравнительно недавно искусственным путем. Следующие за актинием четырнадцать элементов сходны по строению их атомов в актинием; поэтому их под названием актиноиды (или актиниды) помещают, подобно лантаноидам, вне общей таблицы.
В вертикальных столбцах таблицы, или в группах, располагаются элементы, обладающие сходными свойствами. Поэтому каждая вертикальная группа представляет собой как бы естественное семейство элементов. Всего в таблице таких групп восемь. Номера групп отмечены вверху римской цифрой.
Элементы, входящие в первую группу, образуют оксиды с общей формулой R2O, во вторую - RO, в третью R2O3 и т.д. таким образом, наибольшая валентность элементов каждой группы по кислороду соответствует за немногими исключениями номеру группы.
Сравнивая элементы, принадлежащие к одной и той же группе, нетрудно заметить, что, начиная с пятого ряда (четвертый период), каждый элемент обнаруживает наибольшее сходство не с элементом, расположенным непосредственно под или над ним, а с элементами, отделенными от него одной клеткой. Например, в седьмой группе бром не примыкает непосредственно к хлору и йоду, а отделен от хлора марганцем, а от йода — технецием; находящиеся в шестой группе сходные элементы - селен и теллур разделены молибденом, сильно отличающимся от них; находящийся в первой группе рубидий обнаруживает большое сходство с цезием, стоящим в восьмом ряду, но мало похож на расположенное непосредственно под ним серебро и т.д.
Это объясняется тем, что с четвертого ряда начинаются большие периоды, состоящие каждый из двух рядов, расположенных один над другим. Поскольку в пределах периода металлические свойства ослабевают в направлении слева направо, то понятно, что в каждом большом периоде у элементов верхнего (четного) ряда они выражены сильнее, чем у элементов нижнего (нечетного). Чтобы отметить различие между рядами, элементы первых рядов больших периодов сдвинуты в таблице влево, а элементы вторых вправо.
Таким образом, начиная с четвертого периода, каждую группу периодической системы можно разбить на две подгруппы: «четную», состоящую из элементов верхних рядов, и «нечетную», образованную элементами нижних рядов. Что же касается элементов малых периодов, которые Менделеев назвал типическими, то в первой и второй группах они ближе примыкают по своим свойствам к элементам четных рядов и сдвинуты влево в других к элементам нечетных рядов и сдвинуты вправо.
- 51 -
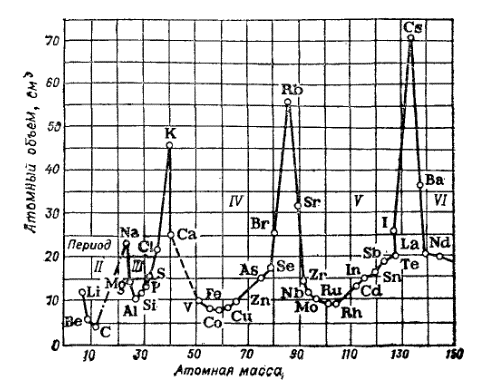
Рис. 1. Зависимость атомного объема элемента от атомной массы.
Поэтому типические элементы обычно объединяют со сходными с ними элементами четных или нечетных рядов в одну главную подгруппу, а другая подгруппа называется побочной.
При построении периодической системы Менделеев руководствовался принципом расположения элементов по возрастающим атомным массам. Однако, как видно из таблицы, в трех случаях этот принцип оказался нарушенным. Так, аргон (атомная масса 39,948) стоит до калия (39,098), кобальт (58,9332) находится до никеля (58,70) и теллур (127,60) — до йода (126,9045). Здесь Менделеев отступил от принятого им порядка, исходя из свойств этих элементов, требовавших именно такой последовательности их расположения. Таким образом, он не придавал исключительного значения атомной массе и, устанавливая место элемента в таблице, руководствовался всей совокупностью его свойств. Позднейшие исследования показали, что произведенное Менделеевым размещение элементов в периодической системе является совершенно правильным и соответствует строению атомов (подробнее см. гл III).
Итак, в периодической системе свойства элементов, их атомная масса, валентность, химический характер изменяются в известной последовательности как в горизонтальном, так и в вертикальном направлениях. Место элемента в таблице определяется, следовательно, его свойствами, и, наоборот, каждому месту соответствует элемент, обладающий определенной совокупностью свойств.
- 52 -
Поэтому, зная положение элемента в таблице, можно довольно точно указать его свойства.
Не только химические свойства элементов, но и очень многие физические свойства простых веществ изменяются периодически, если рассматривать их как функции атомной массы.
Периодичность в изменении физических свойств простых веществ ярко выявляется, например, при сопоставлении их атомных объемов*.
Изображенная на рис. 1 кривая показывает, как изменяется атомный объем элементов с возрастанием атомной массы: наибольшие атомные объемы имеют щелочные металлы.
Так же периодически изменяются и многие другие физические константы простых веществ.
Дмитрий Иванович Менделеев родился 27 января (8 февраля) 1834 г. в г. Тобольске в семье директора местной гимназии. Окончив Тобольскую гимназию, поступил в Петербургский педагогический институт, который окончил в 1855 г. с золотой медалью. В 1859 г., защитив магистерскую диссертацию на тему «Об удельных объемах», Менделеев уехал за границу в двухлетнюю научную командировку. После возвращения в Россию он был избран профессором сначала Петербургского технологического института, а два года спустя — Петербургского университета, в котором в течение 33 лет вел научную и педагогическую работу. В 1892 г. Менделеев был назначен ученым хранителем Депо образцовых мер и весов, преобразованного по его инициативе в 1893 г. в Главную палату мер и весов (ныне Всесоюзный научно-исследовательский институт метрологии имени Д. И. Менделеева).
Величайшим результатом творческой деятельности Менделеева было открытие им в 1859 г., т.е. в возрасте 35 лет, периодического закона и создание периодической системы элементов. Из других работ Менделеева наиболее важными являются «Исследования водных растворов по удельному весу», докторская диссертация «О соединении спирта с водой» и «Понимание растворов как ассоциаций». Основные представления разработанной Менделеевым химической, или гидратной, теории растворов составляют важную часть современного учения о растворах.
Выдающимся трудом Менделеева является его книга «Основы химии», в которой впервые вся неорганическая химия была изложена с точки зрения периодического закона.
Органически сочетая теорию с практикой, Менделеев в течении всей своей жизни уделял много внимания развитию отечественной промышленности.
В 1984 г. научная общественность Советского Союза и многих стран мира торжественно отметила стопятидесятилетие со дня рождения Д. И. Менделеева — выдающегося ученого, открывшего периодический закон и создавшего периодическую систему элементов.

Дмитрий Иванович Менделеев (1834 — 1907)
* Атомный объем — объем, занимаемый одним молем атомов простого вещества в твердом состоянии.
- 53 -
| <<< Назад 17. Периодический закон Д. И. Менделеева. |
Вперед >>> 19. Значение периодической системы. |
- § 47 Периодический закон и периодическая система химических элементов Д. И. Менделеева
- § 51 Скорость и энергия химических реакций
- Периодическая система элементов
- 4. КАК ОТКРЫВАЛИСЬ ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ И СОЗДАВАЛАСЬ ПЕРИОДИЧЕСКАЯ СИСТЕМА
- 32. Принцип Паули. Электронная структура атомов и периодическая система элементов.
- Химические элементы и вещества
- Проверьте свои знания
- Глава четвертая. Пленники невидимой крепости
- Скорость сигнала
