Книга: Достучаться до небес: Научный взгляд на устройство Вселенной
АТОМНЫЙ МАСШТАБ
| <<< Назад ПУТЕШЕСТВИЕ В ГЛУБЬ |
Вперед >>> ЯДЕРНАЯ ФИЗИКА |
АТОМНЫЙ МАСШТАБ
Уйдя от механики биосистем и опускаясь глубже по шкале линейных размеров, чтобы разобраться уже в базовых физических элементах, мы остановимся ненадолго на размере атома — около 100 пикометров, что в 10 тысяч миллионов (1010) раз меньше метра. Точный размер атома определить трудно, поскольку в его составе присутствуют электроны, которые циркулируют вокруг ядра, но никогда не застывают на месте. Традиционно, однако, в качестве размера атома указывают среднее расстояние от электрона до ядра.
Говоря о физических процессах, протекающих на этих крошечных расстояниях, нередко прибегают к наглядным изображениям, но необходимо помнить, что все они основаны на аналогиях. У нас нет другого выхода, и для описания непривычных структур, которые ведут себя странно с точки зрения здравого смысла, приходится привлекать описания объектов, с которыми мы сталкиваемся в обычной жизни.
Корректно изобразить внутреннее строение атома невозможно — ведь рассчитывать при этом мы можем лишь на собственные физиологические качества, а именно чувства и двигательные способности, применимые только в человеческом масштабе. Человеческое зрение, к примеру, опирается на явления, которые видимыми делает свет, то есть электромагнитное излучение. Световые волны — те, что попадают в оптический диапазон — имеют длину волны примерно от 380 до 750 нм. Это намного больше размера атома, который составляет примерно одну десятую нанометра (рис. 14).
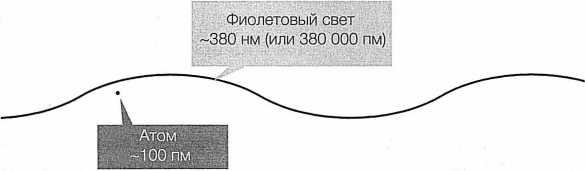
РИС. 14. Отдельный атом — всего лишь крохотная точка по сравнению даже с самой маленькой длиной волны видимого света
Это означает, что исследовать внутреннюю структуру атома при помощи видимого света, пытаясь увидеть его глазами, так же бесполезно, как вдевать нитку в иголку в варежках. Длины волн, о которых идет речь, буквально «размывают» объекты более мелких размеров, и получить с их помощью четкую картинку невозможно, не хватит разрешения. Поэтому, когда мы хотим по–настоящему «увидеть» кварки или даже протон, мы хотим невозможного. У нас просто нет инструмента, который позволил бы точно визуализировать то, что происходит внутри атома.
Но путать способность человека увидеть некие явления и нашу уверенность в том, что эти явления существуют, — серьезная ошибка, которую ученые не могут себе позволить. Тот факт, что мы не только не видим эти явления, но и не имеем их мысленного образа, не означает, что мы не можем логически вычислить физические элементы и процессы, которые имеют место на соответствующих масштабах.
Гипотетически в масштабе атома окружающий мир показался бы нам невероятным, потому законы физики в этом мире резко отличаются от тех, к которым мы привыкли и которые действуют там, где мы бодро отмеряем расстояния при помощи линеек. Мир атома совершенно не похож на тот образ, что возникает в нашем сознании при мысли о материи (рис. 15).
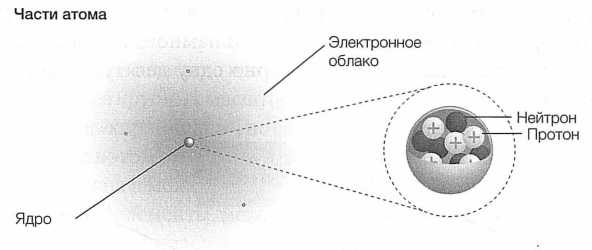
РИС. 15. Атом состоит из электронов, обращающихся вокруг центрального ядра, которое, в свою очередь, состоит из положительно заряженных протонов (заряд каждого из них равен единице) и нейтральных нейтронов (их заряд равен нулю)
Возможно, первое и самое поразительное наблюдение, которое можно было бы сделать в этом масштабе, состояло бы в том, что атом состоит преимущественно из пустого пространства[20]. Ядро — центр атома — примерно в 10 000 раз меньше по радиусу, чем орбиты электронов. Размер среднего ядра — примерно 10-14м (10 фемтометров). Ядро атома водорода еще примерно в 10 раз меньше. Ядро по сравнению с атомом так же мало, как Солнце по сравнению со всей Солнечной системой. Атом по большей части пуст. Объем ядра составляет всего лишь одну триллионную часть полного объема атома.
Это совсем не то, что мы видим и чувствуем, когда стучимся в дверь или пьем прохладную жидкость через соломинку. Чувства подсказывают нам, что вещество непрерывно. Тем не менее на атомном уровне мы обнаруживаем, что вещество по большей части не содержит ничего «вещественного», просто наши чувства усредняют все, что имеет меньшие размеры; за счет этого вещество кажется нам твердым и непрерывным. На атомном уровне оно совсем не такое.
Почти полная пустота — не единственное, что удивило бы нас при взгляде на вещество в атомном масштабе. В свое время мир физики был буквально потрясен тем, что на этих крошечных расстояниях нарушаются даже самые фундаментальные основы ньютоновой физики. Понять свойства электронов в атоме невозможно без представления о двух вещах: волновой природе вещества и принципа неопределенности — ключевых элементах квантовой механики. Электроны в атоме вовсе не летают по простым кривым, описывающим конкретные орбиты, изображение которых мы так часто видим. Согласно квантовой механике никто не в состоянии измерить одновременно положение и импульс частицы с бесконечной точностью, а без этого невозможно и проследить точный путь частицы во времени. Принцип неопределенности, выдвинутый Вернером Гейзенбергом в 1926 г., утверждает, что точность, с которой измерены координаты частицы, ограничивает максимальную точность, с которой можно измерить ее импульс[21]. Если бы электроны двигались по классическим траекториям, мы могли бы в любой момент точно сказать, где находится данный конкретный электрон, а также с какой скоростью и в каком направлении он движется; следовательно, мы могли бы точно сказать, где он будет находиться в любой момент в будущем. Это, однако, противоречит принципу Гейзенберга.
Квантовая механика учит нас, что электроны не занимают в атоме строго определенного положения, как следовало бы из классической картины мира. Вместо этого мы имеем распределение вероятностей, из которого следует, какие у нас шансы в данный момент обнаружить электрон в данном конкретном месте; вероятности — это все, что у нас есть. Мы можем предсказать среднее положение электрона как функцию времени, но любое конкретное измерение подчиняется принципу неопределенности.
Имейте в виду, что эти распределения не произвольны. У электронов может быть далеко не любое распределение энергий или вероятностей. В классической теории не существует внятного способа описать орбиту электрона — ее можно описать только в терминах теории вероятностей. Тем не менее распределение вероятностей — вполне конкретная функция. В квантовой механике мы можем записать уравнение, описывающее волновое решение для электрона, и это уравнение даст нам вероятность нахождения электрона в конкретной точке пространства.
Еще одно свойство атома, замечательное с точки зрения классической ньютоновой физики, заключается в том, что электроны в атоме могут занимать только фиксированные квантованные энергетические уровни. Орбиты электронов зависят от их энергий, и конкретные энергетические уровни и связанные с ними вероятности должны соответствовать правилам квантовой механики.
Без квантованных уровней электронов невозможно разобраться в атоме. В начале XX в. физики начали понимать, что классические правила придется радикально пересматривать: дело в том, что с точки зрения классической физики электроны, обращающиеся вокруг ядра, нестабильны. По идее они должны были бы излучать энергию и быстро падать на ядро. Такая система не только ничем не напоминала бы атом, но и не допускала бы существование структуры вещества, основанной на стабильных атомах, какими мы их знаем.
Нильс Бор в 1912 г. оказался перед непростым выбором — отказаться от классической физики или отказаться от веры в достоверность наблюдаемых данных. Бор мудро выбрал первый вариант и предположил, что на малых расстояниях, разделяющих электроны в атоме, классические законы неприменимы. Этот вывод стал одним из ключевых факторов, приведших к созданию квантовой физики.
Отказавшись от законов Ньютона, Бор смог постулировать, что электроны в атоме могут занимать только фиксированные энергетические уровни в соответствии с предложенным им условием квантования; условие это было связано с величиной, известной как орбитальный угловой момент электрона (он же момент импульса). По Бору, принципу квантования подчинялось все в атомном масштабе. Вообще, в этом масштабе действовали совсем иные правила, нежели те, что применимы в привычном для нас макроскопическом мире и по которым, к примеру, Земля обращается вокруг Солнца.
Технически квантовая механика применима и в макроскопических системах. Но ее действие здесь слишком слабо, чтобы мы смогли его измерить или хотя бы заметить. Когда вы наблюдаете движение Земли — или, вообще говоря, любого другого макроскопического объекта по орбите, — квантово–механическими эффектами можно пренебречь. В подобных системах они усредняются таким образом, что любое предсказание, сделанное на основе квантовой механики, полностью совпадает с предсказанием, сделанным на базе классической физики. Как уже говорилось в главе 1, для измерений в макроскопическом масштабе классические предположения, как правило, дают чрезвычайно хорошие результаты — настолько хорошие, что заметить действие законов квантовой механики, которые лежат в основе всего этого, невозможно. Проведем следующую аналогию. Текст и изображения на экране компьютера даже с самым хорошим разрешением состоят из точек; точки — аналог квантово–механической атомной структуры. Но нам, как правило, достаточно видеть лишь текст и изображения.
Квантовая механика, безусловно, представляет собой изменение научной парадигмы, однако очевидным оно становится только в атомном масштабе. Несмотря на радикальность предложенной модели, Бору не пришлось отказываться от всего, что было прежде. Он вовсе не считал, что физика Ньютона неверна; он всего лишь предположил, что к электронам в атоме классические законы механики неприменимы. В макроскопическом масштабе вещество состоит из такого количества атомов, что квантовые эффекты выделить невозможно, и в целом оно подчиняется законам Ньютона, по крайней мере на том уровне, на котором можно оценить правильность сделанных на их основе предположений. Ньютоновы законы верны, и мы признаем их справедливость в тех масштабах, где они применимы. Однако на атомном уровне законы Ньютона с неизбежностью отказывают — и отказывают весьма наглядным образом, который и позволил ученым разработать квантовую механику.
| <<< Назад ПУТЕШЕСТВИЕ В ГЛУБЬ |
Вперед >>> ЯДЕРНАЯ ФИЗИКА |
- Атомный шантаж
- Масштабы «империи»
- 63. Что означает масштаб карты?
- 11.2. Кооперация в масштабах России
- Самый масштабный из мифов – поворот на юг сибирских рек
- Принципиальное изменение масштабов
- МАСШТАБИРОВАНИЕ ЧЕПУХИ
- Часть I. МАСШТАБИРОВАНИЕ РЕАЛЬНОСТИ
- Часть II. МАСШТАБИРОВАНИЕ ВЕЩЕСТВА
- Часть V. МАСШТАБИРОВАНИЕ ВСЕЛЕННОЙ
- МАСШТАБ НЕИЗВЕСТНОГО
- МАСШТАБЫ ВСЕЛЕННОЙ
