Книга: Популярная библиотека химических элементов. Книга первая. Водород — палладий
Водород и жизнь
| <<< Назад Водород и Вселенная |
Вперед >>> Водород и наука |
Водород и жизнь
Еще раз о том, что нелепо говорить: «Если бы в природе не было того-то, то не было бы того и этого». Дело в том, что картина мира, которую мы имеем возможность сейчас наблюдать, сложилась именно в результате того, что существует в действительности…
Скажем, писатели любят населять планеты, где вместо воды — фтористый водород или аммиак, а основой жизни служит не углерод, а кремний. Но почему же «кремниевая» жизнь не существует на нашей планете, где кремния хоть отбавляй? Не потому ли, что кремний — просто неподходящая основа для жизни?
Однако если и углероду, и кислороду изощренная человеческая фантазия иногда все же находит замену, то ничто не сможет заменить водород. Дело в том, что у всех элементов есть аналоги, а у водорода — нет. Ядро этого атома — элементарная частица, и это не может не сказываться на свойствах атома.
Любой атом, за исключением атома водорода, в обычных условиях не может лишиться всех электронов: у него остается хотя бы еще одна электронная оболочка, и эта оболочка, несущая отрицательные заряды, экранирует ядро. А вот ион водорода — это «голый», положительно заряженный протон, и он может притягиваться к электронным оболочкам других атомов, испытывая при этом не особенно сильное отталкивание от ядра.
И вот что получается. Скажем, в молекуле воды обе валентности атома кислорода насыщены и, казалось бы, между двумя молекулами никакой дополнительной связи возникнуть не может. Но когда атом водорода одной молекулы воды приближается к атому кислорода другой молекулы, то между протоном и электронной оболочкой кислорода начинает действовать сила дополнительного притяжения, и образуется особая, так называемая водородная связь
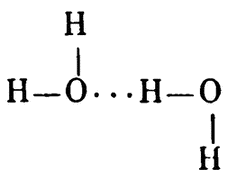
Такие связи раз в двадцать слабее обычных, но все же роль их огромна. Взять, к примеру, ту же самую воду: многие ее удивительные свойства определяются именно необычайно развитыми водородными связями. Попробуйте хотя бы предсказать ее температуру плавления, основываясь на константах соединений водорода с соседями кислорода по периодической системе — азотом и фтором или аналогами — серой и селеном.
Аммиак плавится при —77,7°C, фтористый водород при —92,3°C; следовательно, вода, вроде бы, должна иметь промежуточную температуру плавления около —85°C. Селенистый водород плавится при —64°C, сероводород при —82,9?С; следовательно, точка плавления воды, как аналогичного производного с меньшим молекулярным весом, должна быть еще ниже… Но нет, ее действительная температура плавления оказывается почти на сотню градусов выше предсказанной теоретически, и виной тому — слабые, но многочисленные межмолекулярные водородные связи, которые кислород в силу специфического строения электронной оболочки способен образовывать в значительно большей мере, чем азот, фтор, сера или селен.
Водородные связи лежат в основе самых тонких явлений жизнедеятельности. Например, именно благодаря этим связям ферменты способны специфически распознавать вещества, реакции которых они ускоряют. Дело в том, что белковая цепь каждого фермента имеет строго определенную пространственную конфигурацию, закрепленную множеством внутримолекулярных водородных связей между группировками атомов C=O и N—H
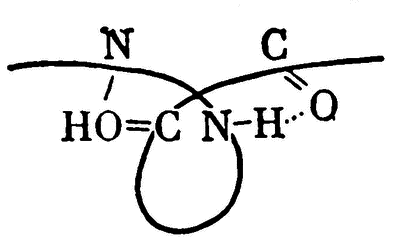
В свою очередь молекула вещества имеет группировки, способные давать водородные связи с определенным участком молекулы фермента — так называемым активным центром

В результате внутримолекулярные связи в этом веществе ослабевают, и фермент буквально «раскусывает» молекулу

Но этим не ограничивается роль слабых водородных связей в процессах жизнедеятельности. Именно благодаря этим связям происходит точное копирование молекулы ДНК, передающей из поколения в поколение всю генетическую информацию; водородные связи определяют специфичность действия многих лекарственных препаратов; ответственны они за вкусовые ощущения, и за способность наших мышц сокращаться… Одним словом, в живой природе атом водорода действительно незаменим.
| <<< Назад Водород и Вселенная |
Вперед >>> Водород и наука |
- 3. ВОДОРОД
- Построение структурных формул. Углеводороды.
- 669. Какое воздействие оказывает сероводород?
- 668. Почему у дна Черного моря скапливается сероводород?
- Юпитер. Жестокий, злой и водородный
- 3. Водородная гипотеза
- Вводные к водороду
- ДНК и водородная бомба
- Сероводородная бомба
- Популярная библиотека химических элементов. Книга первая. Водород — палладий
- ВОДОРОД
- 4.11. ЛЕГЧЕ ВОДОРОДА?
