Книга: Животные анализируют мир
Приборы клеточных делений
| <<< Назад Биоконтакт |
Вперед >>> Живая клетка — приемник электромагнитных полей |
Приборы клеточных делений
Жизнь отдельных клеток измеряется днями, неделями, месяцами и самое большое — десятилетиями, а организм может жить десятки лет. Как же большинству многоклеточных существ удалось вырваться из плена всесокрушающего времени? Благодаря клеточным делениям. Мало того: клеточные деления приносят еще одну незаменимую пользу — позволяют размножить клетки, увеличить живую биомассу.
Как же происходят клеточные деления? Еще до того как клетка начнет делиться, в ней удваивается генетический материал и весь аппарат клеточного деления. Все подготовлено к тому, чтобы после деления получилась копия живой клетки с тем же числом хромосом и с той же морфологией. При делении становятся видимы нити хромосом, а mitos по-гречески — это нить, отсюда и название этого вида деления. Клетка может делиться и прямым делением без образования нитей хромосом, просто поперечной перетяжкой. Однако недолго живет такая клетка и, как правило, делится прямым делением именно перед гибелью.
Теперь давайте посмотрим, как же идут фазы митоза и что происходит внутри клетки на каждой фазе деления.
Период между делениями называется интерфазой. В это время живая клетка выполняет свои прямые функции, предназначенные ей в организме: движется, выделяет различные секреты, борется с микроорганизмами. На этой же стадии клетки, как уже отмечалось ранее, удваивают количество хромосом и все подготавливают для деления. Когда же начинается митоз, клетка только им и занимается. У человека основная часть митозов проходит ночью, когда он спит и большинство органов отключено от повседневной работы.
Первая стадия митоза называется профазой. В это время начинается упаковка хромосом. Ведь если бы пришлось их растаскивать к двум полюсам в неупакованном виде, понадобилось бы устройство, напоминающее лебедку с барабаном, на который накручивались бы длинные нити. В клетке проходит все проще: хромосомы спирализуются, отчего становятся толще, но короче. Потом спираль еще раз закручивается в спираль, теперь хромосомы становятся совсем короткими, плотными и хорошо видны в микроскоп. А как можно растаскивать хромосомы в разные стороны, если они, как в мешке, находятся внутри оболочки ядра? Поэтому в профазе и ядерная оболочка распадается. К полюсам клетки в это время движутся центриоли — органоиды клетки, которые закрепляются нитями у полюсов и становятся центром, притягивающим к себе хромосомы. Но хромосомы к центриолям притягиваются не физическими или биологическими полями, а устройством, которое можно увидеть в микроскоп, — нитями веретена деления. Каждая такая нить одним концом прикрепляется к центриоли, а вторым — к хромосоме. Место прикрепления нити на хромосоме называется центромерой. Все, казалось бы, налажено для митоза. На следующих фазах деления все приходит в движение, и за час митоз заканчивается.
За профазой следует вторая стадия — метафаза. В это время хромосомы из беспорядочного клубка, как по приказу, выстраиваются по экватору. Образуют метафазную пластинку. Теперь видно, что к каждой паре хромосом, подготовленной для расхождения; тянутся две нити веретена деления. Одна нить — к одной центриоли, а другая — к противоположной. По экватору стоят удвоенные хромосомы, как две капли воды похожие друг на друга, называемые сестринскими хроматидами. Начни сейчас сокращаться нити веретена — и поползут хромосомы к разным полюсам.
Это и происходит на следующей стадии деления — анафазе. Нити веретена сокращаются. Сестринские хроматиды расщепляются и движутся к противоположным полюсам.
Наконец, наступает последняя стадия — телофаза. Опять раскручиваются хромосомы, строятся ядерные оболочки, удваиваются центриоли. И оболочка самой клетки как бы перешнуровывается. Все уже и уже становится талия клетки и, наконец, их получается две. А в каждой дочерней клетке есть уже свое ядро и удвоившиеся центриоли для будущего деления.
Вот так на наших глазах произошел процесс деления клетки. Все в нем стройно и отлажено. Какая-то «невидимая рука» скручивала хромосомы, разводила к разным полюсам центриоли, крепила нити веретена деления к хромосомам. Наконец, с помощью каких-то приборов хромосомы выстраивались по экватору, а после их расхождения к разным полюсам какая-то сила перешнуровывала клетку пополам, а это сравнимо с тем, как если бы человек попытался перетянуть шпагатом на две части туго накачанную футбольную камеру. Только современные методы исследования позволили приоткрыть завесу над процессом деления клетки и посмотреть на все другими глазами.
Первое, на что обратили внимание исследователи, были нити веретена, разводящие хромосомы к разным полюсам. Они видны даже в световой микроскоп. Ученые сразу начали думать о механизме их сокращения и пришли к выводу, что они сокращаются, подобно волокнам наших мышц. Но как тогда быть с остальными организованными движениями органоидов клетки во время митоза?
С помощью электронной микроскопии внутри клеток были найдены микротрубочки и микрофиламенты. Микротрубочки — это действительно длинные полые цилиндры с наружным диаметром около двадцати четырех нанометров и толщиной стенок пять нанометров. В световой микроскоп они не видны. Микрофиламенты — это уже нити в три раза тоньше, чем микротрубочки, находящиеся в цитоплазме. В интерфазе микротрубочки держат форму клетки. Они идут от ядра во все стороны и во все отростки клетки. Это внутренний каркас клетки. Стоит только разрушить их высокой температурой, давлением или ядом колхицином, как клетка теряет свою форму и становится округлой. Если вредное действие прекратится, структура микротрубочек может восстановиться и клетка приобретет свою прежнюю форму, А вот микрофиламенты непосредственно участвуют в генерации движения поверхности клетки. Они могут скользить относительно друг друга, прикрепляться к мембране клетки, втягивать и выпячивать ее различные части или же надстраиваться и разрушаться под мембраной. Так что в ускоренной киносъемке поверхность клетки напоминает (благодаря действию микрофиламентов) беспокойный океан.
Однако, как только начинается деление клетки, все микротрубочки и микрофиламенты уходят на построение пространственной организации митоза. Форма клетки становится округлой. На всех стадиях митоза, кроме телофазы, микротрубочки и микрофиламенты строят сходные пространственные фигуры, соответствующие веретену деления. На стадии телофазы микротрубочки во время перетяжки клетки остаются только в соединительном мостике, а микрофиламенты в это время, как кольцом из тонких нитей, перетягивают клетку надвое (рис. 9).
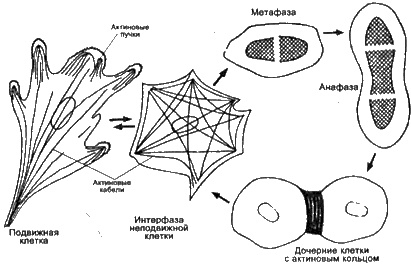
Рис. 9. Перераспределение микрофиламентов в клетке на различных фазах митоза
Кажется, что микроскопический гном намотал нити микрофиламентов на клетку и с каждым витком все туже и туже делает свой моток. И опять рушатся все наши представления о живых приборах, управляющих митозом. Микрофиламентами ведь тоже надо управлять. Так почему же эти тончайшие нити, состоящие из белка актина, знают, где им надо перетянуть клетку, в какую сторону передвинуть центриоли или хромосомы и как выполнить другие пространственные команды?
Пока непонятно, как работают устройства, принимающие непосредственное участие в митозе внутри клетки, но не лучше обстоит дело и с изучением внешних регуляторов клеточного деления. В самом деле, какой из тысячи сигналов, принимаемых живой клеткой, выступает как команда приступить к митозу? И как подается эта команда — непосредственно ли химические соединения призывают клетку к делению или же опять в этом повинны поля: электрическое, магнитное, электромагнитное излучение или комплекс полей, генерируемый самим организмом?
Вот и попробуем хотя бы кратко рассмотреть, Что известно сейчас биологам о регуляции клеточного деления и что они надеются узнать в ближайшем будущем.
Прежде всего обратим наш взор на химическую регуляцию митотической активности клеток. Ученые достигли наибольших успехов в исследовании этого запутанного вопроса и разработали ряд интересных теорий.
Давно известно, что существует целый ряд химических веществ, способных подавлять клеточные деления. Об одном таком веществе уже говорилось. Это яд колхицин, который при небольших дозах разрушает митотический аппарат в клетке и приостанавливает деление клеток. В настоящее время широко применяются в онкологии ингибирующие митозы вещества, называемые цитостатиками. Эти лекарственные препараты подавляют аэробное окисление углеводов, слегка стимулируют тканевое дыхание, подавляют синтез ДНК и уменьшают проницаемость клеточных мембран. Среди этих веществ известны алкилирующие соединения: азотистые иприты, метасульфонаты, этиленимины и эпоксидные соединения, а также различные метаболиты, то есть вещества, подавляющие обменные процессы; аналоги пуринов и пиримидинов, витамин В, антагонисты аминокислот. Целый ряд соединений растительного происхождения действует на образование митотического веретена, колхицин, подофил и алкалоиды барвинка. Наконец, в химиотерапии опухолей применяются антибиотики: актиномицин D, митомицин С. Эти вещества подавляют синтез нуклеиновых кислот.
Цель применения цитостатиков в химиотерапии опухолей понятна: нужно любыми способами остановить безудержные митозы в опухолях, задержать их рост и помочь организму справиться с постигшим его недугом. Теоретическим обоснованием к применению цитостатиков является тезис, утверждающий, что малодифференцированные опухолевые клетки более чувствительны к низким концентрациям этих веществ, чем нормальные клетки.
У цитостатиков есть одно преимущество — клиницисты и экспериментаторы могут их получать в чистом виде, знают их химический состав. Знают, на какую фазу митоза они могут воздействовать. Удалось даже получить цитостатики с высокой избирательностью по отношению к типу клеток. Например, ТЭФА — триэтилен-фосфамид подавляет митозы в лимфоидных тканях, а миелобромол — в миелоидных тканях, которых много в нервных узлах, в мозге. Казалось бы, уже можно бороться со злокачественными опухолями, но на пути этой борьбы встают отрицательные свойства цитостатиков.
Во-первых, к этим же цитостатикам чувствительны нормальные делящиеся клетки, и применение эффективных доз ограничивается из-за их побочного действия. А во-вторых, введение цитостатиков, особенно повторное, может привести к отбору. Среди злокачественных клеток появляются клетки, способные не реагировать на эти лекарственные вещества, и опухоли из таких клеток быстро разрастаются, окончательно поражая организм.
По этой причине ученые, занимающиеся проблемой регуляции клеточных делений, ищут химические вещества, действующие на клетки выборочно и мягко. Но ведь такие вещества есть в самом здоровом организме, где постоянно происходит регуляция как ингибирования, так и стимуляции митозов. Может быть, их можно выделить из тканей и применить для исправления работы поломанной машины, ведающей командами для делящихся и неделящихся клеток?
Ученых всегда интересовали такие факты в клеточном делении, на которые трудно найти ответ. В самом деле, почему клетки после нанесения травмы начинают усиленно делиться и закрывают полученный дефект? И была создана теория раневых гормонов. Смысл ее сводится к тому, что из разрушенных клеток в окружающую ткань разливается вещество, которое играет роль сигнала, побуждающего клетки вокруг травмы к делению. Возникает и второй вопрос: почему после закрытия травмы клеточные деления прекращаются, а в злокачественной опухоли они бушуют безостановочно, пока живет сам организм?
Здесь мы вплотную подошли к теории кейлонов, разработанной известным биологом В. Буллоу. Кейлоны — полная противоположность раневым гормонам: они ингибиторы и ограничители роста. Деление клеток строго контролируется ими. Когда орган вырастает до нужных размеров, в нем как раз необходимая концентрация кейлонов. Но стоит нанести травму, то есть уменьшить количество клеточных ингибиторов, как клетки усиленно начинают делиться. И это продолжается до тех пор, пока рана не закроется, а количество кейлонов при этом придет в норму.
Буллоу и Лауренс провели ряд интересных опытов, чтобы до-казать действенность своей теории. Вот один из экспериментов, проведенных ими ради выбора между теорией раневых гормонов и теорией кейлонов. Все, наверное, представляют, как тонки уши у мыши. Если у нее удалил, эпидермис с одной стороны, то через тонкое ухо химическое воздействие будет оказано и на другую сторону, и клетки на неповрежденной стороне начнут усиленно делиться. Теперь только останется пронаблюдать, какую же картину образуют клетки кожицы неповрежденной стороны уха, приступившие к митозу. Если будут действовать раневые гормоны, то на другую сторону они диффундируют из краев экспериментальной раны, следовательно, на другой стороне уха в коже митозы как бы дадут конфигурацию травмы. И совсем другое дело будет при нехватке кейлонов: если они частично уйдут при уменьшении концентрации в области травмы, то получится как бы обратная диффузия из неповрежденного эпителия кожи. Митозы, конечно, в этом случае появятся на неповрежденной стороне не в виде кольца, а примерно на той же площади, напротив которой снят эпителий. Поставили эксперимент — и подтвердилось последнее.
Подтверждение присутствия ингибитора в клетках эпидермиса кожи вдохновило ученых на дальнейшие исследования. Они получили экстракты, выделенные из кожи, и нашли, что кейлон представляет собой гликопротеид с молекулярной массой около 30 000-40 000. Дальнейшие исследования дали не менее интересные результаты. Оказалось, что кейлон не имеет видовой специфичности. Зато он органоспецифичен, действует только на митотическую активность того органа, из которого он выделен. В частности, митозы в ухе мыши могут быть приостановлены не только экстрактами, выделенными из кожи мыши, но и препаратами, выделенными из кожи свиньи, из кожи пальца человека и даже из кожи трески.
Вот какие возможности открываются для регуляции митозов как в здоровых, так и в раковых тканях. Огромное количество лабораторий мира начало заниматься изучением кейлонов. Начались поиски кейлонов в других органах, выделение кейлонов в чистом виде самыми современными методами биохимии. Ученые начали искать, на какую стадию клеточного цикла действуют эти вещества.
Познакомимся с некоторыми теориями в области онкологии, основанными на принципе приемника и передатчика.
1. Живые клетки снижают или совершенно прекращают выработку кейлонов. Они получают сигнал к делению и начинают давать беспорядочные митозы, порождая все новые и новые группы клеток, не способных вырабатывать кейлоны.
2. В клетках происходит мутация, небольшая поломка в рецепторе, анализирующем присутствие кейлонов. Хотя «антенны» клетки и настроены на прием кейлонов, сигнала об их присутствии вокруг себя она не слышит. Результат тот же — начинается безудержный автономный рост.
Если первый довод правилен, то все опухоли, клетки которых сохранили работоспособные рецепторы приема кейлонов, можно излечить. Нужно только ликвидировать недостаток кейлонов в ткани. Такие опухоли нашли. Оказалось, что VX— опухоль у кролика, хлоролейкемия и меланомы у хомячка излечиваются экстрактами, выделенными из кожи свиньи. Появилась надежда. Однако вскоре она начала угасать. Излечить кейлонами можно было только те опухоли, которые зависят от них, а их не так уж много. Такие клинически важные опухоли, как рак кожи и рак легкого, устойчивы по отношению к эпидермальному кейлону и не реагируют на него. Может быть, здесь уже поломались рецепторы клетки?
Живым клеткам нужно всегда знать, где находятся их сородичи, и получать сигналы о состоянии дел в организме. Поэтому они всегда обмениваются информацией. За обменом сигнальной информацией у клеток эпидермиса кожи очень просто и в то же время изящно удалось проследить японским исследователям Фуджи и Мицуно. Они имплантировали в эпидермис кусочки миллипорового фильтра и отделяли одни клетки от других. Но клетки «слушали» друг друга через фильтр, через мельчайшие поры поступали сигналы. В тех случаях, когда фильтр пропитывали парафином, связь между клетками через поры нарушалась. Клетки начали расти вниз, пока не приходили в контакт и не начинали обмениваться информацией (рис. 10).
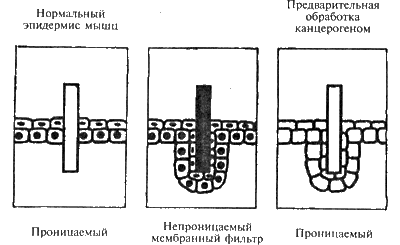
Рис. 10. Обмен информационными сигналами между клетками эпидермиса при наличии мембранного фильтра и при воздействии канцерогеном
А после обработки клеток канцерогенными веществами они вели себя у перегородки так же, как и при непроницаемом фильтре. Фильтр имел поры, но клетки все равно шли для контакта вниз. Разве это, не доказательство того, что вещество, выбывающее опухоль, либо влияет на выработку кейлонов, либо портит рецепторы на клеточных мембранах.
В настоящее время предполагается несколько пересмотреть принцип регуляции клеточных делений в тканях химическими веществами, появляются сообщения не только об ингибиторах, *о и о стимуляторах митозов, выделенных из тканей. Это значительно приближает к истинному положению вещей. В действии и Противодействии совершаются многие физиологические процессы.
Еще меньше известно об управлении клеточными делениями с помощью магнитных, электрических и электромагнитных полей. Опытным путем показано, что слабые электрические поля влияют на рост костной ткани. Но слабое электростатическое поле может ускорить регенерацию конечностей у амфибий и частичную регенерацию у млекопитающих. Раны под влиянием этого поля могут заживать в два раза быстрее. Помимо этого, ученым удалось показать, что электростатическое поле не только стимулирует митозы, но и определяет их ориентацию. Правда, подобные опыты сделаны пока только на клеточной культуре.
Магнитное поле в противоположность электрическому, видимо, подавляет клеточные деления. Особенно это заметно при воздействии слабым переменным магнитным полем как на одноклеточные, так и на многоклеточные организмы. Низкочастотное магнитное поле в 0,6 герца при напряженности в одну гамму подавляет размножение бактерий, например стафилококка.
Электромагнитные поля при тех же частотах и напряженности 0,3–0,4 вольта на метр увеличивают скорость делений клеток бактерий. Но особенно интересно реагировали на электромагнитные поля клеточные культуры млекопитающих. Если воздействовать ослабленным электромагнитным полем до начала митоза, то клеточные деления в культуре почки обезьяны, в эмбрионе свиньи или в амнионе человека как бы подавляются. Но уж если клетки начали делиться, то действие этого же поля еще больше повышает митотическую активность. Так действуют низкочастотные электромагнитные поля от двух до десяти герц, и они в биологическом плане более активны по сравнению с высокочастотными. Однако если мы пойдем дальше по электромагнитному спектру, пройдем видимую часть спектра, то в ультрафиолетовой области найдем еще, интересный диапазон волн, с которым столкнулся известный биолог А. Г. Гурвич.
Экспериментировал А. Г. Гурвич с корешками лука. Это один из удобных объектов для изучения митозов. Его заинтересовало, может ли дистанционно влиять один корешок лука на другой, так, чтобы в нем увеличилось число митозов. Известно, что митозы в корешке лука сосредоточены в самом кончике да еще ориентированы по оси роста. Далее ученый направил кончик одного корешка перпендикулярно ко второму корешку, примерно в его середину, где митозы уже прекратились. Не идут ли какие-нибудь лучи от делящихся клеток, которые могли бы подействовать на неделящиеся клетки?
Опыт подтвердил выдвигаемые предположения. Митозы теперь уже отмечались и в середине корешка. Следовательно, какое-то излучение стимулировало деление клеток в корешке лука. Так, в 1923 году А. Г. Гурвич открыл митогенетические лучи. Несколько позднее такое же излучение, сопровождающее деление клеток, было найдено в других тканях живых организмов. Тщательный анализ испускаемого клетками излучения во время деления показал, что митогенетические лучи относятся к ультрафиолетовым лучам с длиной волны сто девяносто — триста двадцать пять нанометров. Механизм их возникновения полностью неизвестен, но они, видимо, возникают в результате экзотермических реакций. В то же время они служат сигналом, который сообщает другим клеткам, что их соседи приступили к клеточным делениям. Дальнейшее исследование передачи информации между клетками об их митотической активности на молекулярном и физико-химическом уровне может привести к новым открытиям в этой области исследований.
Клетки в пласте ткани, работающие как единая система, также вооружены приборами, способными регулировать пространственное распределение митозов. Очень удобной системой для изучения пространственной регуляции митозов может служить однослойный эпителий хрусталика, расположенный в двумерном пространстве с очень высокой упорядоченностью клеток. В центре эпителия митозов почти нет, далее идет кольцо — герминативная зона, где больше всего делящихся клеток, а за ним опять зона с дифференцированными клетками и резким падением митозов. Работая с эпителием хрусталика рыб и лягушек, я неожиданно столкнулся с удивительной особенностью пространственного, распределения митозов после нанесения травмы в передний полюс хрусталика с поражением части клеток эпителия. После нанесения такой обширной травмы естественные митозы уже в первые сутки затихали, и на вторые сутки появлялась полоса митозов, повторяющая конфигурацию травмы. Все эти митозы были посттравматические. Площадь, ограниченная митозами, была неизменной независимо от площади травмы. А это как раз и противоречит кейлонной теории. Ведь чем больше была бы пораженная область, тем больше ощущалась бы нехватка кейлонов и тем большая площадь эпителия должна бы охватываться митозами, а на самом деле это не так. Потом митозы по кейлонной теории следовало бы ожидать по краям травмы — там ведь больше всего не хватает клеточных ингибиторов, а эксперименты с эпителием хрусталика показывают, что митозы сразу возникают в отдалении от травмы, да еще повторяют ее конфигурацию. Как здесь не предположить, что пространственное распределение митозов регулируется посредством полей. Нельзя исключить и механические силы, ведь после нанесения травмы и разрушения целостности капсулы хрусталика и эпителия натяжение в клетках тоже меняется, а это может влиять на пространственное распределение митозов в эпителии.
Многое еще предстоит расставить по своим местам, прежде чем станет ясно, как работают приборы клеточного деления, а насколько велика здесь работа, говорит противоречивость экспериментов и теорий, которые только что были приведены.
| <<< Назад Биоконтакт |
Вперед >>> Живая клетка — приемник электромагнитных полей |
- Происхождение многоклеточных
- Глава десятая БИОПРИБОРЫ ИССЛЕДУЮТ АНОМАЛЬНЫЕ ЗОНЫ
- Глава шестая «ЖИВЫЕ ПРИБОРЫ» ВРЕМЕНИ
- Самые различные звуковые приборы
- Непрерывность мира вирусов и связи с миром клеточных организмов
- 4.6. Царство Животные. Главные признаки подцарств одноклеточных и многоклеточных животных. Одноклеточные и беспозвоночны...
- 2. Поведение клеточных пластов
- 3. Развитие колониальных одноклеточных
- 2. Элементы развития у одноклеточных
- § 34. Увеличительные приборы
- 319. Какие приборы применяются для измерения течений?
- Биоконтакт
