Книга: Мусорная ДНК. Путешествие в темную материю генома
Теломеры и болезни
| <<< Назад Забота о шнурках |
Вперед >>> Тик-так, говорит теломера |
Теломеры и болезни
Речь идет о заболеваниях, причиной которых служат главным образом мутации теломеразного гена, или гена, кодирующего РНК-матрицу, или генов, кодирующих белки, которые защищают теломеры, или гена, который помогает теломеразной системе эффективно работать[12].
В сущности, мутации в любом из этих генов могут приводить к сходным эффектам. Главным образом они мешают клеткам поддерживать свои теломеры в нужном состоянии. Поэтому теломеры у пациентов с такими мутациями укорачиваются быстрее, чем у здоровых людей. Вот почему такие пациенты демонстрируют симптомы преждевременного старения. Такие заболевания называются теломерными синдромами человека15.
Врожденный дискератоз — редкое генетическое заболевание, поражающее примерно одного человека на миллион. Пациенты страдают от целого ряда проблем. На коже у них в непредсказуемых местах появляются темные пятна. Во рту возникают пятна белого цвета, которые могут приводить к развитию рака ротовой полости. Ногти на руках и на ногах становятся тонкими и хрупкими. А потом отказывают различные органы, и этот процесс кажется необратимым. Он начинается с дисфункции костного мозга и неполадок в легких. Общий риск возникновения онкологических заболеваний у них также повышен.
При исследовании нескольких семейств, которых коснулся этот недуг, ученые выяснили, что причина заболевания — мутации различных генов. В настоящее время выявлено по меньшей мере 8 таких мутантных генов. Вполне возможно, что на самом деле их еще больше16. Все эти гены обладают одним общим свойством: они участвуют в процессах поддержания нормального существования теломер. А значит, как бы ни искажалась эта область мусорной ДНК, симптомы все равно обычно будут схожи.
Совокупность легочных проблем, возникающих в таких случаях, называют пневмофиброзом. Для пациентов, страдающих этим заболеванием, характерно «короткое дыхание», они много кашляют, поскольку их организм не в состоянии с должной эффективностью выводить углекислый газ из легких и с должной легкостью наполнять их кислородом. Рассматривая их легкие под микроскопом, патологи увидели обширные области, где нормальную ткань заменила воспаленная и фиброзная, напоминающая по своей структуре шрам17.
Такая клиническая и патологическая картина легких довольно часто наблюдается при респираторных заболеваниях. Это побудило ученых обратиться к изучению проб биологического материала пациентов, страдающих идиопатическим пневмофиброзом. Слово «идиопатический» означает, что для заболевания пока не выявлено очевидной причины. Исследователи проверили, нет ли у этих пациентов дефектов генов, которые обеспечивают синтез веществ, защищающих теломеры. В среднем дефекты соответствующих генов удалось выявить почти у каждого шестого пациента, в семье которого страдали этим заболеванием, но мутаций прежде не обнаруживали18,19. Даже у пациентов, в семье которых, по-видимому, не страдали пневмофиброзом, мутации теломерных генов обнаружились в 1-3% случаев20,21. В США около 100 тысяч человек страдают идиопатическим пневмофиброзом, так что, по самым осторожным оценкам, примерно 15 тысяч из них, вероятно, заработали эту болезнь из-за того, что их организм не мог поддерживать тело-меры в нормальном состоянии.
Дефекты в механизме, который защищает теломеры, могут становиться причиной еще одного заболевания. Речь идет об апластической анемии — болезни, при которой костный мозг перестает вырабатывать достаточное количество клеток крови22. Это редкий недуг, им страдает примерно 1 человек на полмиллиона. И примерно у 1 из 20 больных наблюдаются мутации фермента теломеразы или соответствующей РНК-матрицы.
У некоторых таких больных могут одновременно наблюдаться и дефекты костного мозга, и дефекты легких, но одна из проблем, как правило, становится клинически очевидной раньше другой. При лечении это может приводить к незапланированным последствиям. Пересадка костного мозга — одна из методик лечения больных апластической анемией. Пациентам дают специальные препараты для профилактики отторжения нового костного мозга их иммунной системой. Некоторые из таких лекарств, как известно, токсичны для легких. Для большинства страдающих апластической анемией это, в общем-то, не проблема. Но для тех, кто имеет дефекты в теломеразной системе, такие медикаменты способны спровоцировать пневмофиброз, который может оказаться летальным23. Иными словами, лекарство в таких случаях может стать причиной смерти.
Существует не совсем обычная генетическая причина, по которой врачи не всегда понимают, что наблюдаемые у пациента симптомы — часть врожденной проблемы с теломерами. Теломеразный комплекс обычно особенно активен в половых клетках: как мы уже знаем, родители должны передавать своим отпрыскам длинные теломеры. Но в некоторых семьях, где наблюдаются мутации генов, кодирующих теломеразу, или мутации сопутствующего РНК-фактора, это не так. А значит, в таких случаях каждое новое поколение передает потомству всё более короткие теломеры. Поскольку симптомы болезни начинают проявляться, когда длина теломер становится меньше определенного значения, каждое следующее поколение рождается всё ближе и ближе к точке критического укорачивания теломер21.
Это приводит к довольно-таки серьезным последствиям. К примеру, дедушка обладает сравнительно длинными теломерами, и пневмофиброз у него развивается только в 60 с лишним. У его сына теломеры уже не такие длинные. Симптомы легочных неполадок проявляются у него в 40 с чем-то лет. А вот третье поколение может получить в наследство по-настоящему короткие теломеры. В результате у внуков проявится апластическая анемия уже в детстве.
Поскольку у старшего и среднего поколения соответствующие болезни возникают лишь в сравнительно позднем возрасте, внук может заболеть еще до того, как у его отца и деда проявятся опасные симптомы, и терапевт будет испытывать трудности при выявлении генетического заболевания в данном семействе. К тому же при более острой и менее острой форме болезни симптомы порой различны.
Эта странная картина, когда у старшего поколения симптомы проявляются слабее и в более позднем возрасте, чем у младшего поколения, чем-то напоминает характер наследования миотонической дистрофии, о котором мы говорили в главе 1. Речь идет о весьма необычном генетическом феномене, и поразительно, что в двух его самых ярких и отчетливых проявлениях эффект, в конечном счете, вызван изменением длины фрагмента мусорной ДНК.
Напрашивается вопрос: почему клетки некоторых тканей подвержены укорачиванию теломер больше других? Пока это не совсем ясно, однако появляются некоторые любопытные модели. Вероятно, активно размножающиеся клетки сильнее рискуют получить дефекты, приводящие к укорачиванию теломер. Классический пример — популяция стволовых клеток крови (мы уже обсуждали это выше). Если эти клетки испытывают трудности с поддержанием нужной длины теломер, то популяция стволовых клеток в конце концов истощится.
Похоже, это объяснение вполне подходит для апластической анемии. Но не для пневмофиброза. Ткань легких реплицируется довольно медленно, однако пневмофиброз распространен среди страдающих теломерными дефектами. Возможно, в клетках легких воздействия укороченных теломер сопряжены с другими факторами, влияющими на геном и функционирование клеток. Клетки эти развиваются сравнительно медленно, поэтому и соответствующие процессы идут не так уж быстро. Возможно, именно поэтому легочные симптомы обычно возникают позже, чем те, причиной которых становятся проблемы со стволовыми клетками крови.
Наши легкие при каждом вдохе подвергаются риску воздействия потенциально опасных веществ. Поэтому неудивительно, что они так отчаянно стараются выносить бремя дефектных теломер. Один из наиболее распространенных источников опасных вдыхаемых соединений — табак. Влияние курения на здоровье человека в мировом масштабе колоссально. По оценкам Всемирной организации здравоохранения около 6 миллионов человек ежегодно умирают из-за курения, причем полмиллиона из них — от воздействия курения вторичного25.
Ученые экспериментально исследовали влияние сигаретного дыма на организм. Они вырастили генетически модифицированных мышей с укороченными теломерами и затем подвергли самых разных мышей воздействию сигаретного дыма26. Результаты показаны на рис. 5.2. По сути, пневмофиброз развивался лишь у зверьков с укороченными теломерами, подвергавшихся воздействию табачного дыма.
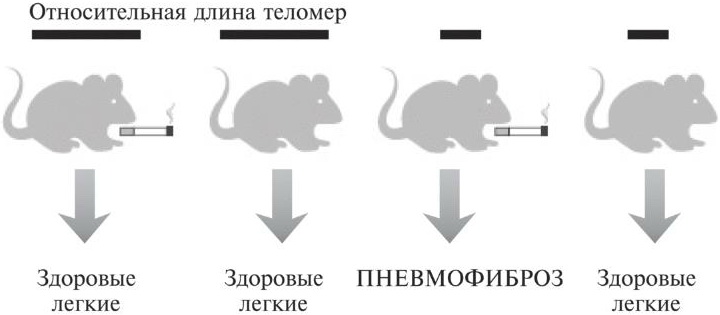
Рис. 5.2. Для возникновения пневмофиброза у мышей требуется одновременное действие двух факторов: генетического дефекта и негативного влияния окружающей среды. У мышей с укороченными теломерами, не подвергающихся воздействию табачного дыма, пневмофиброз не развивается, как и у мышей с нормальными теломерами, которых подвергали воздействию дыма. Однако у мышей с укороченными теломерами, еще и подвергавшихся воздействию дыма, все-таки возникало это заболевание.
Разумеется, курение — не единственный фактор, влияющий на состояние здоровья человека, хотя отказ от курения — вероятно, самое разумное, что вы можете сделать для своего здоровья. Однако главный фактор, влияющий на здоровье жителей богатых стран, — это сам по себе возраст. Но так было не всегда. Нынешним положение вещей стало после того, как мы достигли впечатляющего прогресса — медицинского, фармакологического, социального, технологического — в борьбе с тем, что раньше обеспечивало нам преждевременную могилу, со всеми этими старомодными штуками вроде инфекционных заболеваний, младенческой смертности, недоедания.
| <<< Назад Забота о шнурках |
Вперед >>> Тик-так, говорит теломера |
- Болезни атакуют мир растений
- Удастся ли уничтожить инфекционные болезни?
- Болезни животных, вызываемые микробами
- Болезни мозга и расстройства поведения
- 4. Заразные болезни, их причины и способы борьбы с ними
- Таблица 5. Наиболее распространённые и опасные вирусные болезни человека
- Сплайсинг и болезни
- Эффектное исцеление от "зеленой болезни"
- Старение и болезни
- V.4 Болезни мозга и сексуальность
- XIX.2 Разрушение шаг за шагом при болезни Альцгеймера
- Что чаще убивает людей по всему миру – несчастные случаи или болезни?
