Книга: Происхождение жизни. От туманности до клетки
Происхождение цитохром-с-оксидазы
| <<< Назад Происхождение цитохромных комплексов bc1 (комплекс III) и b6f |
Вперед >>> Эволюция фотосистем |
Происхождение цитохром-с-оксидазы
Ключевой фермент аэробного дыхания, комплекс IV, или цитохром-с-оксидаза, завершает дыхательную цепь и переносит электроны с цитохрома с на кислород. Она относится к семейству гем-медных оксидаз (НСО, haem-copper oxydase). Разные ферменты этого семейства восстанавливают кислород до воды либо оксид азота NO до закиси азота N2O. Все основные функции этих ферментов выполняются одной большой субъединицей, содержащей 12 трансмембранных спиралей, два гема и атом меди между тремя гистидинами (рис. 17.10). У работающих с NO ферментов этого семейства вместо атома меди присутствует железо. По сходству последовательностей главной субъединицы и набору вспомогательных субъединиц семейство делят на четыре подсемейства: НСО-А, НСО-В и НСО-С, которые восстанавливают кислород и переносят протоны через мембрану, и NOR, который восстанавливает NO и не переносит протоны. Подсемейство НСО-А, к которому относится и комплекс IV митохондрий (см. главу 15), оптимизировано для высоких концентраций кислорода и переносит больше протонов, чем НСО-В и НСО-С.
Среди ученых существуют очень разные точки зрения о происхождении и эволюции этого семейства ферментов. Например, в работах группы Анны-Лизы Дуклузье и Вольфганга Ницшке в Марселе (Ducluzeau et al., 2009) отстаивается сценарий, в котором ферменты подсемейства NOR (переносящие электроны с хинона на NO) были еще у LUCA и участвовали в нитритном дыхании или защите от оксида азота, а кислородные подсемейства произошли от него после появления кислородного фотосинтеза минимум два раза независимо. В пользу этого сценария ученые приводят филогенетические деревья, на которых подсемейство NOR, в отличие от других, четко делится на архейную и бактериальные ветви с корнем между ними. Именно такое дерево мы можем ожидать для белка, который был унаследован первыми бактериями и археями прямо от LUCA, а не распространялся путем горизонтального переноса.
Кроме того, до появления кислорода на Земле вся медь была связана в нерастворимых минералах в одновалентном состоянии, например в Cu2S, и не использовалась клетками. Только с появлением кислорода эти минералы стали окисляться в относительно растворимые соединения двухвалентной меди, такие как CuSO4. Все медьсодержащие ферменты эволюционно относительно молоды, и железо в активном центре NOR, казалось бы, свидетельствует о древности этого подсемейства по сравнению с медь-содержащими HCO-A, B и C. Остаток тирозина, абсолютно необходимый для восстановления кислорода, находится в HCO-C совсем не там, где в HCO-A и НСО-В. Следовательно, переход этих ферментов на работу с кислородом был вызван разными, независимыми мутациями, добавившими тирозин к активному центру.
Другие ученые, например Грибальдо (Gribaldo et al., 2009), используя несколько другие методы построения деревьев, обращают внимание на то, что НСО-А распространены в очень многих группах бактерий и архей, тогда как другие подсемейства ограничены в распространении. На основании их деревьев получается, что подсемейство НСО-В появилось у архей Sulfolobales и попало к бактериям путем горизонтального переноса, а НСО-С и NOR – изобретение протеобактерий. Дерево подсемейства НСО-А в их работе очень похоже на дерево 16S рибосомных РНК, не подверженных горизонтальному переносу, и предполагается, что НСО-А еще во времена LUCA участвовало в защите от кислорода – правда, непонятно, откуда кислород мог тогда взяться.
Некоторые факты не укладываются ни в один из этих двух сценариев: например, в составе вспомогательных субъединиц NOR есть медь, значит, и это подсемейство должно быть не старше, чем кислородный фотосинтез. Другой факт связан с липидами. Известно, что для работы НСО во впадинах главной субъединицы должны быть связаны молекулы липидов бактериального типа – с жирными кислотами. Чтобы HCO работал в мембране археи, состоящей из терпеноидных липидов (см. главу 15), в ней должна быть небольшая примесь липидов бактериального типа. Археи, использующие НСО, всегда имеют также ферменты для синтеза бактериальных липидов, явно полученные горизонтальным переносом от бактерий (Dibrova et al., 2014). Иными словами, все НСО архей должны быть получены от бактерий, а не унаследованы от LUCA. При таком переносе мембранный белок оказывается в новом липидном окружении, к которому он не был приспособлен. Оптимизация перенесенного белка для работы в окружении архейных липидов приводит к ускоренной эволюции его последовательности и ошибкам при построении филогенетических деревьев.
Прорыв в понимании происхождения этого семейства наметился в 2014 году. Биоинформатики из Техасского университета, используя чувствительные методы поиска сходства белков, нашли дальних родственников семейства НСО (Pei et al., 2014). Молекула НСО обладает несовершенной трехлучевой симметрией: 12 трансмембранных спиралей образуют 3 похожие группы по 4 спирали, расположенные вокруг общего центра. Два гема и один атом меди нарушают симметрию. Среди обнаруженных родственников НСО часть белков имеет 4 трансмембранные спирали, похожие больше всего на 9–12-ю спирали НСО (их назвали НСОН-s, НСО homolog single domain). Такие белки не могут устойчиво свернуться поодиночке, а должны объединяться по три, чтобы получилась трехмерная укладка, похожая на HCO. Если в геноме есть несколько генов HCOH-s, кодируемые ими белки могут объединяться в комплексы смешанного состава из двух субъединиц одного типа и одной – другого.
Судя по наличию связывающих гем остатков гистидина, комплексы из одинаковых субъединиц могут содержать три молекулы гема, а комплексы состава «2+1» – одну. Другие родственники НСО, НСОН-t (НСО homolog triple domain) состоят из 12 спиралей, уложенных так же, как в НСО. Большинство из них связывают один гем, некоторые – два (рис. 17.10).
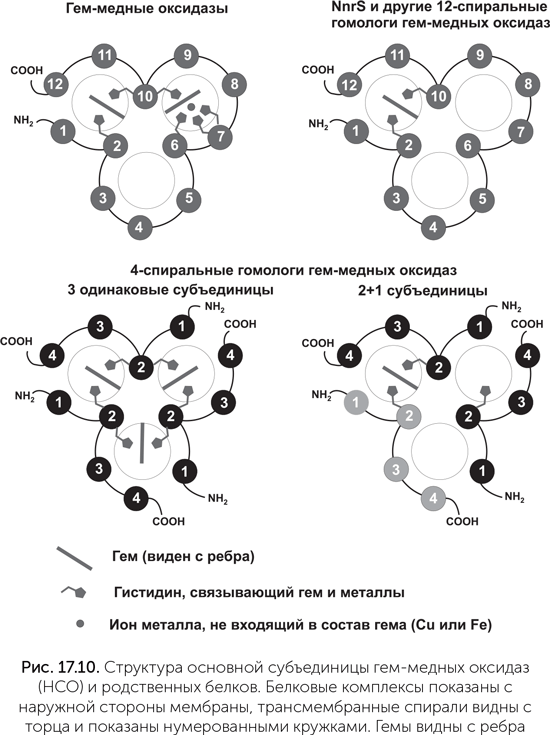
Почти все эти белки известны только из последовательностей полных геномов различных бактерий и никогда не изучались экспериментаторами. Только одна из семи групп HCOH-t попадала в руки экспериментаторов раньше. Это белок NnrS, выделенный из холерных вибрионов. У холерного вибриона он обеспечивает устойчивость к оксиду азота, вырабатываемому иммунной системой хозяина. У почвенных бактерий, где белок NnrS тоже был опознан, он организует движение клеток в сторону большей концентрации нитратов и нитритов. Точный механизм его работы неизвестен, в пробирке NnrS холерного вибриона не окисляет и не восстанавливает NO. Гены nnrS и большинства других родственников НСО в геномах соседствуют с генами ферментов нитратного и нитритного дыхания и генами защиты от отравления NO (не только иммунная система животных, но и сами бактерии травят им друг друга). Так что их функции должны быть как-то связаны с оксидами азота. 4-спиральные НСОН-s явно имеют отношение к предкам НСО, у которых еще не произошло слияния трех белковых субъединиц в одну. Остается ждать, пока биологи-экспериментаторы исследуют разведанные биоинформатиками цели, и тогда мы сможем судить о функциях предков гем-медных оксидаз.
| <<< Назад Происхождение цитохромных комплексов bc1 (комплекс III) и b6f |
Вперед >>> Эволюция фотосистем |
- Разнообразие и происхождение гемов, хлорофиллов и родственных коферментов
- Разнообразие и эволюция гем-содержащих белков
- Разнообразие и эволюция хинонов
- Разнообразие электрон-транспортных цепей
- Модульная структура окислительно-восстановительных ферментов
- Происхождение комплекса I (НАДН-хинон-оксидоредуктаза)
- Происхождение цитохромных комплексов bc1 (комплекс III) и b6f
- Происхождение цитохром-с-оксидазы
- Эволюция фотосистем
- Доступность окислителей и восстановителей на древней Земле
- Энергетика LUCA, первых бактерий и архей
- Глава 17 Происхождение компонентов биоэнергетических систем
- Происхождение цитохромных комплексов bc1 (комплекс III) и b6f
- Эволюция фотосистем
- Происхождение первых мембранных белков
- Происхождение комплекса I (НАДН-хинон-оксидоредуктаза)
- Разнообразие и эволюция гем-содержащих белков
- Происхождение Рюриковичей: ДНК-генеалогия доказывает
- Происхождение растений
- Глава 7. Происхождение человека и половой отбор
- 2. ПРОИСХОЖДЕНИЕ ВОДОРОСЛЕЙ
