Книга: Происхождение жизни. От туманности до клетки
Разнообразие и эволюция гем-содержащих белков
| <<< Назад Разнообразие и происхождение гемов, хлорофиллов и родственных коферментов |
Вперед >>> Разнообразие и эволюция хинонов |
Разнообразие и эволюция гем-содержащих белков
Цитохромы были открыты и разделены на типы (а, b, c) еще в конце XIX века по своим спектроскопическим свойствам – грубо говоря, по цвету. Первое время после открытия гемов считалось, что каждому типу цитохромов соответствует свой тип гема, отличающийся боковыми группами порфиринового кольца. Потом оказалось, что реально существуют только гемы a, b и d1. Цитохромы с содержат гем b, но отличаются от прочих типов цитохромов способом соединения гема с белком. В цитохромах с гем соединен с белковой молекулой двумя прочными ковалентными связями, а в цитохромах а, b и d – только слабыми координационными связями. Цитохромы a и b образуются самопроизвольно в пробирке из очищенного белка и гема. Ковалентное соединение гема с белком в цитохромах c образуется при помощи специальных ферментов. Так что в эволюции цитохромы с должны были возникнуть позже, чем другие типы цитохромов. Распространение цитохромов с и филогенетические деревья ферментов, соединяющих гем с белком, показывают, что цитохромы с появились уже после появления основных групп бактерий. Их изобретателями могли быть протеобактерии или цианобактерии, а возможно, и те и другие независимо. Дальнейшее распространение цитохромов с по другим группам бактерий и архей происходило путем горизонтального переноса генов. Благодаря прочным ковалентным связям гема с белковой цепью в цитохромах с они гораздо устойчивее и могут участвовать в большем разнообразии реакций, чем цитохромы a и b.
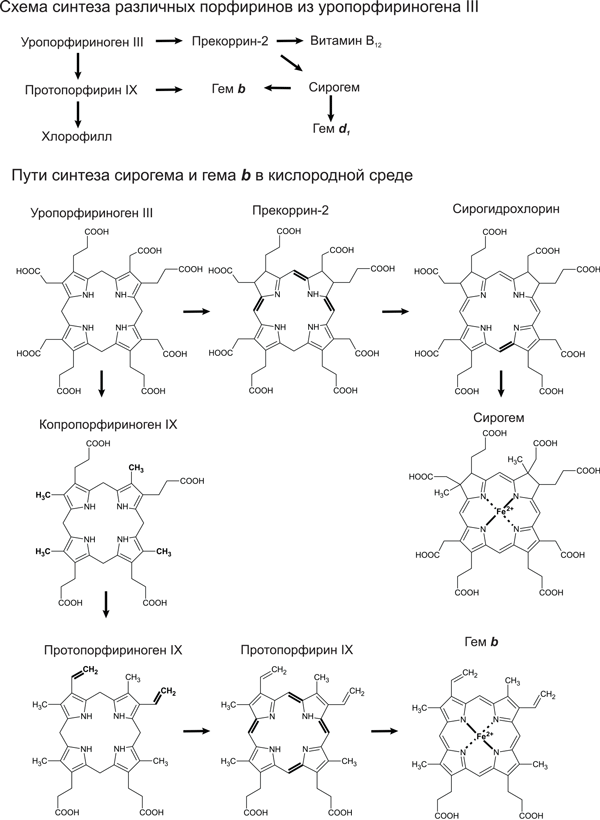
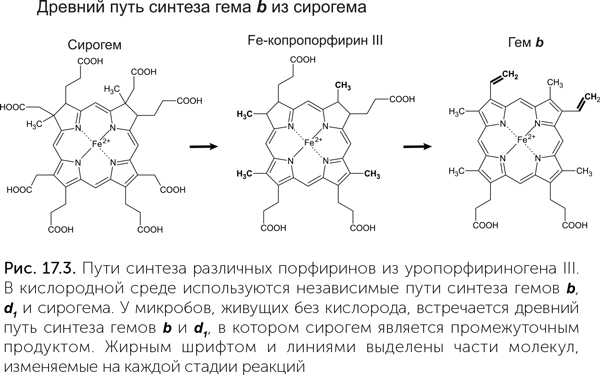
О сирогем-содержащих белках мы можем с уверенностью сказать, что у LUCA из них была диссимиляторная сульфит-редуктаза (Dsr). Она восстанавливает сульфит (SO32-) до серы в сульфатном дыхании либо, наоборот, окисляет серу до сульфита в серном фотосинтезе. Молекула этого фермента состоит из двух похожих субъединиц, каждая из которых связывает сирогем, но только один из двух сирогемов образует активный центр. Значит, древний вариант сульфит-редуктазы Dsr состоял из двух одинаковых белковых половинок, кодируемых одним геном, и имел два активных центра. Филогенетическое дерево белковых субъединиц этого фермента однозначно показывает, что дупликация гена, давшая начало двум разным субъединицам, произошла до разделения бактерий и архей (Dhillon et al., 2005). Ассимиляторная сульфит-редуктаза (Asr) по структуре похожа на сульфит-редуктазу Dsr, но две субъединицы у нее слились в единую белковую цепь, а неработающий второй сирогем был утрачен. Подобной структурой обладает и нитрит-редуктаза. Усиление различий между субъединицами и их слияние указывают, что нитрит-редуктаза и сульфит-редуктаза Asr произошли от Dsr. Это согласуется и с их функциями: редуктаза Asr образует сероводород из сульфита, нитрит-редуктаза – аммиак из нитрита, а в геотермальных водоемах, где обитал LUCA, сероводород и аммиак были в достатке. Сульфит-редуктаза Dsr же может работать в обратном направлении, окисляя серу; и в этом качестве могла быть востребована у LUCA, например, в процессе фотосинтеза.
Итак, мы можем быть уверены, что из разнообразия порфиринов LUCA могли быть сирогем, участвующий в окислении серы, и витамин В12, работающий, среди прочего, в восстановительном ацетил-КоА-пути фиксации углекислого раза (см. главу 11). О древности других порфиринов мы не можем судить так же достоверно. Гемы a и b участвуют во множестве окислительно-восстановительных реакций, и у нас нет четких аргументов ни за, ни против их присутствия у LUCA. Хлорофиллы или промежуточные продукты их синтеза (протохлорофиллиды) могли быть у LUCA в качестве защитных пигментов. Нельзя исключать, что эту же функцию защиты от ультрафиолета могли выполнять какие-нибудь другие порфирины, которые не сохранились до нашего времени.
| <<< Назад Разнообразие и происхождение гемов, хлорофиллов и родственных коферментов |
Вперед >>> Разнообразие и эволюция хинонов |
- Разнообразие и происхождение гемов, хлорофиллов и родственных коферментов
- Разнообразие и эволюция гем-содержащих белков
- Разнообразие и эволюция хинонов
- Разнообразие электрон-транспортных цепей
- Модульная структура окислительно-восстановительных ферментов
- Происхождение комплекса I (НАДН-хинон-оксидоредуктаза)
- Происхождение цитохромных комплексов bc1 (комплекс III) и b6f
- Происхождение цитохром-с-оксидазы
- Эволюция фотосистем
- Доступность окислителей и восстановителей на древней Земле
- Энергетика LUCA, первых бактерий и архей
- Разнообразие и происхождение гемов, хлорофиллов и родственных коферментов
- Разнообразие и эволюция хинонов
- Эволюция. Классические идеи в свете новых открытий
- Глава 4 Эволюция на наших глазах
- Эволюция под управлением компьютера
- Эволюция, повернувшая вспять
- § 9. Строение и эволюция Вселенной
- Эволюция человека том 2 Обезьяны нейроны и душа 2011
- Эволюция человека. В 2 книгах. Книга 1. Обезьяны, кости и гены
