Книга: Происхождение жизни. От туманности до клетки
Происхождение кислородного фотосинтеза
| <<< Назад Геологические следы фотосинтеза и продуктивность древних экосистем |
Вперед >>> Глава 17 Происхождение компонентов биоэнергетических систем |
Происхождение кислородного фотосинтеза
В течение архейского периода химический состав земной коры и верхней мантии постепенно изменялся: железо погружалось к ядру планеты, вулканическая активность слабела, и продуктивность всех типов фотосинтеза, зависящая от поступления водорода, серы и железа из недр Земли, снижалась. В этих условиях естественный отбор поддержал появление кислородного фотосинтеза, который использует бесконечный источник электронов – воду.
Системы защиты от токсического действия кислорода, необходимые для кислородного фотосинтеза, могли возникнуть даже раньше, чем кислородный фотосинтез. Показано, что на поверхности пирита (FeS2) при освещении в воде образуется перекись водорода – Н2О2. Ионы Fe3+ – продукт железо-зависимого фотосинтеза – тоже окисляют воду до перекиси водорода при освещении раствора, так что каталаза и другие защитные системы могли возникнуть вскоре после выхода бактерий из обогащенных цинком геотермальных водоемов в моря. Более того, показано, что водоокисляющий комплекс современных цианобактерий может использовать H2O2 в качестве источника электронов, причем для этого требуется меньше энергии света, чем для окисления воды. Возможно, обезвреживание перекиси водорода было первой функцией примитивного водоокисляющего комплекса. Существуют противоречивые данные о роли H2O2 в современном кислородном фотосинтезе – в зависимости от изучаемого вида и условий перекись может как подавлять его, так и стимулировать. Некоторым видам цианобактерий для выделения кислорода необходимо, чтобы заметное его количество уже содержалось в среде. Как это объяснить, пока непонятно (Olson, Blankenship, 2004).
Окисление воды – крайне сложная задача. Окислительно-восстановительный потенциал (его сокращенно называют редокс-потенциалом) бактериохлорофилла а (0,55 V) достаточен для окисления водорода, двухвалентного железа, H2S и серы. Редокс-потенциал хлорофилла а из цианобактерий выше, около 0,82 V. Однако если окислять воду, отбирая электроны по одному, то первая реакция, превращающая воду в гидроксильный радикал и протон, требует огромного редокс-потенциала в 2,75 V, недоступного ни для каких фотосинтетических пигментов. Поэтому необходим промежуточный переносчик электронов, способный окислить сразу две молекулы воды – редокс-потенциал хлорофилла будет достаточен, только если его равномерно делить на четыре электрона.
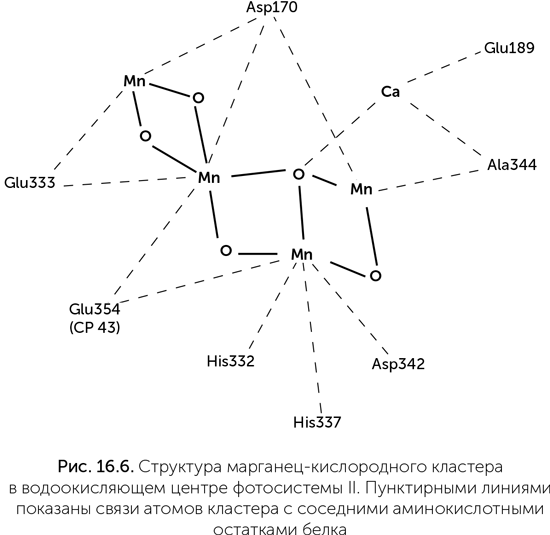
Водоокисляющий комплекс – это связанный с фотосистемой II марганец-кислородный кластер. Он содержит четыре иона марганца, меняющих степень окисления от +3 до +4, кроме того, с ним связано по одному иону кальция и хлора (рис. 16.6). Структура этого кластера напоминает элементарную ячейку таких природных минералов, как рансьеит (CaMn4O9 ? 3H2O) и других слоистых оксидов марганца, подобно тому как FeS-кластеры окислительно-восстановительных ферментов похожи на ячейку пирита. Существовала гипотеза о происхождении водоокисляющего комплекса от защитного фермента супероксид-дисмутазы, одна из разновидностей которого содержит два иона марганца. Такой примитивный фермент, как предполагалось, мог быть способен к двухэлектронным реакциям – окислению H2O2 до кислорода. Окисление воды до H2O2 в такой системе было невозможно из-за недостаточного редокс-потенциала хлорофилла. К сожалению, никакого сходства между последовательностями супероксид-дисмутаз и белков фотосистемы II обнаружить не удалось.
Однако было давно замечено, что выделение кислорода в фотосинтезе сильно стимулируется добавлением бикарбонатов (солей HCO3-). Добавление изотопно меченого тяжелым кислородом 18O бикарбоната показало, что при освещении в первые секунды выделяется кислород, содержащий только тяжелый изотоп 18О. Это значит, что водоокисляющий центр переключается на окисление бикарбоната, при этом выделяются кислород и углекислый газ. Кроме того, было обнаружено, что бикарбонат участвует в сборке марганцевого кластера. Водорастворимая форма марганца – ионы Mn2+. В физиологических условиях они находятся в клетке в основном в виде марганец-бикарбонатных комплексов, таких как Mn2(HCO3)22+. В процессе сборки марганцевого кластера эти комплексы присоединяются к фотосистеме II. А затем под действием света Mn2+ в составе комплексов окисляются ею до Mn3+, а бикарбонат – до кислорода и CO2.
Марганец-бикарбонатные кластеры по своему редокс-потенциалу могут служить донорами электронов для бактериальных фотосистем, при этом происходит окисление Mn2+ до Mn3+. Это было обнаружено в экспериментах с фотосистемой II пурпурных бактерий, в норме окисляющих железо (Khorobrykh et al, 2007). Из этого можно построить следующую схему происхождения кислородного фотосинтеза (рис. 16.7): сначала, по мере исчерпания железа в океане, предки цианобактерий стали переходить на марганец-бикарбонатные комплексы в качестве источника электронов для фотосинтеза. Затем мутации ФСII привели к тому, что ионы Mn3+ (продукт марганец-окисляющего фотосинтеза) стали задерживаться на белке и принимать участие в его работе. Из них собрался примитивный марганец-кислородный кластер, способный проводить фотоокисление HCO3– до кислорода и CO2. Эта реакция требует в полтора раза меньше энергии, чем окисление воды, и возможностей бактериальной ФСII для этого практически достаточно. Так у фотосинтезирующих бактерий появился доступ к новому источнику электронов – бикарбонату. По мере того как запасы марганца в океане были израсходованы и осаждены в виде MnO2, процианобактерии стали переходить на окисление того, что осталось, т. е. бикарбоната. Марганец, который до того был расходным материалом для фотосинтеза, стал катализатором для использования бикарбонатов, и потребность в нем уменьшилась в тысячи раз.
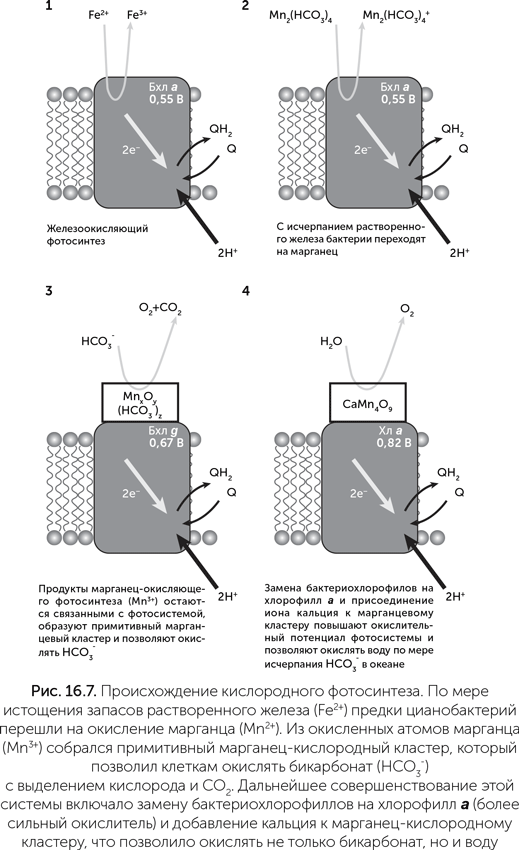
Далее бактериохлорофилл a в составе ФСII был заменен более редокс-активными пигментами, такими как бактериохлорофилл g, а затем и хлорофилл а, для повышения скорости бикарбонатного фотосинтеза. Одновременно совершенствовались системы защиты клеток от выделяемого кислорода. Наконец, по мере истощения запасов СО2 в атмосфере и бикарбонатов в море, к марганцевому кластеру присоединился ион кальция, повысивший его редокс-потенциал и сделавший возможным окисление воды. Так цианобактерии освоили неограниченный источник электронов для фотосинтеза и увеличили продуктивность всей биосферы в несколько раз (Dismukes et al., 2001).
Этот сценарий подтверждается новыми геологическими находками (Johnson et al., 2013). В Южной Африке были найдены морские осадки возраста 2,415 млрд лет, которые сильно обогащены оксидами марганца. Этот возраст примерно совпадает с началом оксигенизации атмосферы и гидросферы планеты. Там же присутствуют зерна легко окисляемого минерала пирита. Следовательно, в этих слоях осаждение марганца происходило не за счет реакций с кислородом. По-видимому, это следы деятельности марганец-окисляющих фотосинтезирующих организмов.
Итак, мы видим, что в течение 1,5 млрд лет после возникновения жизнь постепенно осваивала использование энергии Солнца и новые, все более распространенные восстановители для питания углекислым газом. С появлением кислородного фотосинтеза 2,4 млрд лет назад недостаток восстановителей (железа, водорода, соединений серы) более не ограничивал продуктивность экосистем. Появление в атмосфере кислорода, ядовитого для многих древних групп микробов, вызвало масштабное вымирание и перестройку экосистем. По-видимому, именно кислородная среда стала толчком к появлению новых организмов с более сложными клетками – эукариот, т. е. клеток с ядром. Только на основе эукариотной клетки стало возможно появление крупных многоклеточных растений и животных. В последней, 18-й главе мы рассмотрим движущие силы и механизмы появления эукариот.
| <<< Назад Геологические следы фотосинтеза и продуктивность древних экосистем |
Вперед >>> Глава 17 Происхождение компонентов биоэнергетических систем |
- Расхождение бактерий и архей
- Способы получения энергии у бактерий и архей
- Глубинная биосфера
- Поздняя метеоритная бомбардировка
- Устройство фотосинтеза современных растений и цианобактерий
- Разнообразие систем, запасающих энергию света
- Разнообразие и происхождение хлорофиллов и хлорофилл-связывающих белков
- Варианты хлорофилльного фотосинтеза
- Эволюция хлорофилльного фотосинтеза
- Геологические следы фотосинтеза и продуктивность древних экосистем
- Происхождение кислородного фотосинтеза
- Геологические следы фотосинтеза и продуктивность древних экосистем
- Происхождение Рюриковичей: ДНК-генеалогия доказывает
- Происхождение растений
- Глава 7. Происхождение человека и половой отбор
- 2. ПРОИСХОЖДЕНИЕ ВОДОРОСЛЕЙ
- 3. ПРОИСХОЖДЕНИЕ ГРИБОВ
- 4. ПРОИСХОЖДЕНИЕ ЖЕНСКОГО ГАМЕТОФИТА ЦВЕТКОВЫХ РАСТЕНИЙ
- 3. ПРОИСХОЖДЕНИЕ СТЕБЛЯ
- 6. ПРОИСХОЖДЕНИЕ ПАПОРОТНИКООБРАЗНЫХ РАСТЕНИИ
- 8. ПРОИСХОЖДЕНИЕ ЦВЕТКОВЫХ РАСТЕНИЙ
- 4. ВЫХОД РАСТЕНИЙ НА СУШУ И ПРОИСХОЖДЕНИЕ НАЗЕМНОЙ РАСТИТЕЛЬНОСТИ
- 9. ПРОИСХОЖДЕНИЕ КУЛЬТУРНЫХ РАСТЕНИЙ
