Книга: Логика случая. О природе и происхождении биологической эволюции
Симбиотический сценарий эукариогенеза: происхождение ключевых эукариотических инноваций, инициированных эндосимбиозом
| <<< Назад Сценарий симбиогенеза в сравнении с архезойным сценарием |
Вперед >>> Удивительная история эукариотических интронов |
Симбиотический сценарий эукариогенеза: происхождение ключевых эукариотических инноваций, инициированных эндосимбиозом
Мы уже затронули многие аспекты гипотезы об эукариогенезе, инициированном симбиогенезом. Данный раздел объединяет эти разрозненные свидетельства в согласованную схему эукариогенеза. При этом мы не должны забывать, что детали того, что происходило в действительности, восстановить невозможно, и если бы мы занялись разработкой спекуляций об этих деталях, то в конце концов были бы обречены признать, что это просто вымысел. Тем не менее, если мы удерживаем дискуссию на относительно «крупнозернистом» уровне, вполне возможно обнаружение некоей логики даже в единичных эволюционных событиях, каковым является эукариогенез.
Попробуем привязать сценарий эукариогенеза (см. рис. 7–7) к конкретным стадиям и периодам истории жизни на Земле и самой Земли (Kasting and Ono, 2006). Время и место – приблизительно два миллиарда лет назад (палеопротерозой), умеренная температура и соленость, предположительно океанское дно на мелководье. Атмосфера Земли (и, соответственно, океан) в первые 1,5 миллиарда лет истории жизни находились в сильно восстановленном состоянии. Однако примерно в то время, о котором мы говорим, благодаря появлению кислородного фотосинтеза у цианобактерий, началась микрооксигенизация Земли. Концентрация кислорода была, вероятно, на два или три порядка ниже, чем сейчас, но аэробное дыхание уже сделалось возможным. Разнообразие микробной биоты в биосфере было сравнимо с современным, за исключением малочисленности (почти отсутствия) аэробных организмов. Все главные группы архей и бактерий, известные нам сегодня, уже существовали, и даже, вероятно, были другие, ныне вымершие. Экологическая обстановка – важный пункт, который иногда упускается при обсуждении эндосимбиоза: описываемые события, вероятнее всего, происходили в микробных матах, широко распространенных и тесно объединенных сообществах различных бактерий и архей (Allen and Banfield, 2005). В микробных матах уровень горизонтального переноса генов, вероятно, настолько высок, насколько это вообще возможно, и так же должно обстоять дело с частотой заглатывания одной прокариотической клетки другой клеткой, потенциально способного приводить к эндосимбиозу, но вообще редкого среди прокариот.
Главным персонажем этой драмы, хозяином будущего эндосимбионта (назовем его «архейный прародитель эукариот», АПЭ), наиболее вероятно, как отмечалось выше, был представитель мезофильных архей, предположительно с большим геномом, который мог содержать до 5–6 тысяч генов. Имеющиеся данные о дошедших до нас мезофильных археях удручающе неполны по сравнению с другими группами прокариот. Тем не менее то, что мы все-таки знаем, согласуется с предположением, что генетически сложные организмы с множеством генов, приобретенных путем горизонтального переноса, обычны в этой экологической группе. Действительно, самые большие известные геномы архей, единственные археи, обладающие более чем 5000 генов, обнаружены среди мезофилов (а именно некоторых Methanosarcina), и до 20 процентов этих геномов содержат гены сравнительно недавнего бактериального происхождения. Другие известные мезофильные археи, такие как хорошо описанные Thaumarchaeota, тип архей, до недавнего времени скрывавшийся за неопределенным наименованием мезофильных Crenarchaeota, имеют меньшие геномы, но и они тоже обогащены «бактериальными» генами (Brochier-Armanet et al., 2008). Ни один из известных в настоящее время архей не похож на предполагаемого кандидата на столь важную роль АПЭ. Как обсуждалось ранее в этой главе, архейное наследство современных эукариот – смешанное, с наборами генов, происходящих от различных групп Crenarchaeota, Thaumarchaeota или Euryarchaeota. Существует интересная возможность того, что неуловимый АПЭ сочетал многие (возможно, большинство) из этих генов в пределах одного генома/клетки до того, как произошел эндосимбиоз, хотя и последующее приобретение генов посредством ГПГ также могло быть важно. Отталкиваясь от бурной картины прокариотического мира, описанной в главе 5, можно предположить, что потенциально важными эволюционными посредниками были не вымершие, а неустойчивые группы (линии) архей и бактерий. Такие относительно короткоживущие жизненные формы с очень сложными, мозаичными геномами могли возникать довольно часто (по эволюционным масштабам), но чаще всего они постепенно теряли большие части своих геномов и деградировали до более стабильных, привычных нам форм. Однако некоторые из этих предполагаемых сложных временных состояний могли породить взрывы разнообразия (см. рис. 7–7).
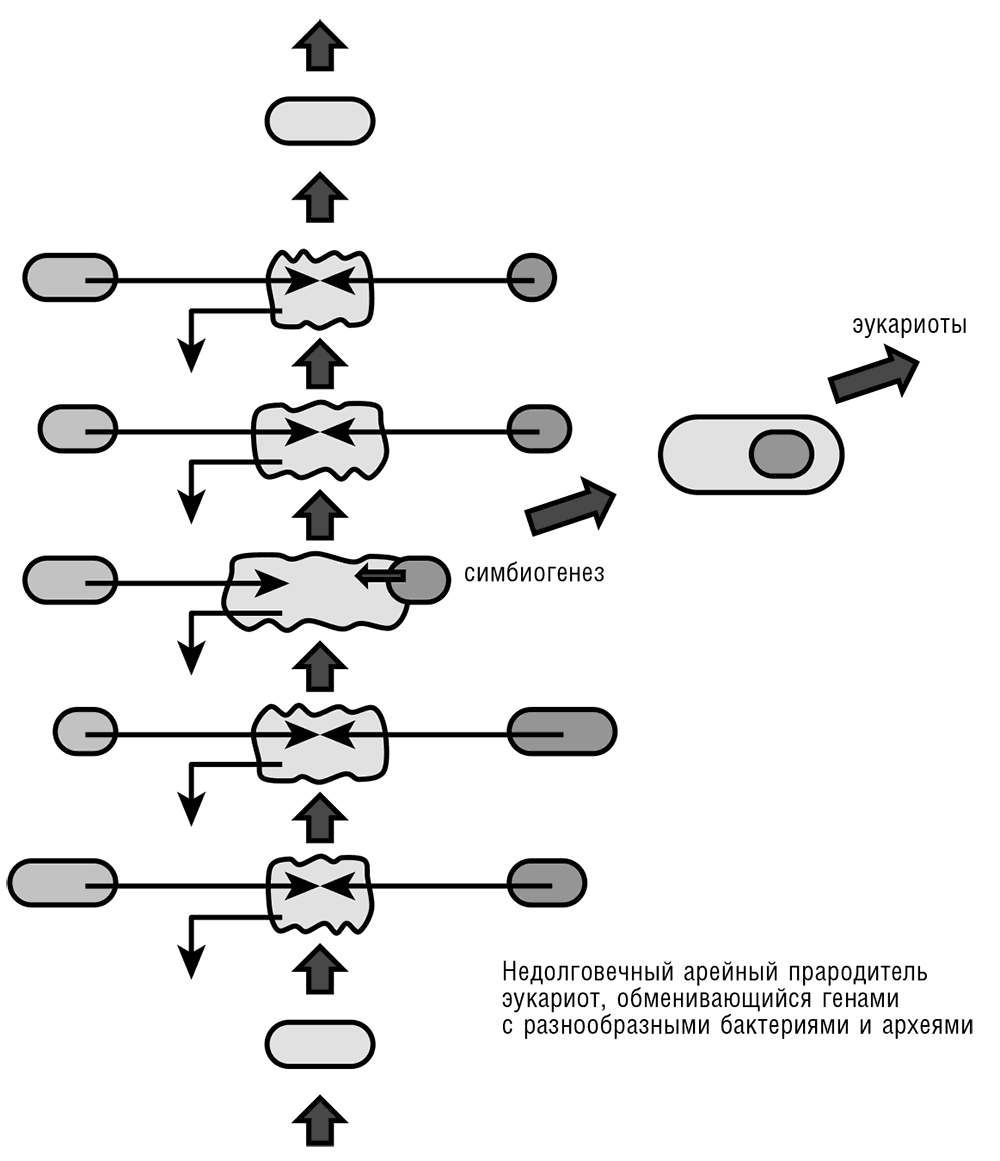
Рис. 7–7. Архейный прародитель эукариот (АПЭ) как переходная сложная архейная форма, предрасположенная к горизонтальному переносу генов, и эндосимбиотический сценарий эукариогенеза.
Когда писалась эта глава, появилось сообщение об удивительном открытии, иллюстрирующем неизученное разнообразие архей и увеличивающем вероятность того, что близкие родственники неуловимого АПЭ могли дожить до сего дня. Оливье Грос с коллегами сообщили о двух видах Thaumarchaeota, населяющих морское мелководье (M?ller et al., 2010). Эти археи обладают гигантскими клетками, которые формируют ясно выраженные макроскопические филаменты. Более того, клетки одного из этих видов покрыты симбиотическими альфа-протеобактериями. Бактерии в этом случае являются экто-, а не эндосимбионтами; тем не менее этот тип археобактериальной ассоциации прекрасно может создавать условия, способствующие эндосимбиозу. Эти новооткрытые археи вряд ли являются близкими родственниками АПЭ (хотя, повторюсь, вероятность того, что являются, – ненулевая), но по любым меркам это открытие красноречивее всяких слов говорит о правдоподобности эндосимбиотического сценария эукариогенеза.
История эукариот (см. рис. 7–7) начинается с АПЭ, захватившего альфа-протеобактерию, которую трудно точно идентифицировать. Этот АПЭ мог иметь специфическую склонность к поглощению других прокариотических клеток, хотя, разумеется, это не был настоящий фагоцит, подобный современной амебе. Однако представляется вероятным, что АПЭ был археем, не имеющим клеточной стенки, похожим в этом отношении на ныне существующих термофильных архей из рода Thermoplasma. Более того, он, вероятно, обладал некоторой разновидностью цитоскелета, образованной актиноподобными белками, родственными тем, которые обнаружены у другой группы термофильных архей (группа в составе Crenarchaeota, известная как Thermoproteales); сравнительный анализ последовательностей этих архейных гомологов актинов (которые, к сожалению, еще не исследованы экспериментально) даже свидетельствует о возможности того, что они образуют ветвистые филаменты, ключевые структуры, вовлеченные в эукариотический фагоцитоз (Yutin et al., 2009)[62]. Так что не будет безосновательным предположение, что АПЭ «пасся» на бактериальном мате, время от времени захватывая бактериальные клетки. Большая часть поглощенных бактерий встретила свой конец в качестве пищи; другие бактерии могли убивать захватчиков, а некоторые могли становиться временными симбионтами. Фиксация эволюционно стабильного эндосимбионта – чрезвычайно трудная задача, поскольку надо преодолеть много препятствий, чтобы создать такой стабильный эндосимбиоз. Ясно, что, хотя изначальный захват будущего эндосимбионта мог произойти по воле случая, фиксация эндосимбионта могла стать возможной только в той мере, в какой это было связано с явными селективными преимуществами для возникшего химерного организма.
Что могло быть фактором (или факторами) отбора, поддержавшими появление архео-бактериальной химерной системы? Если предполагать микроаэрофильные условия во время эукариогенеза (или, может быть, даже анаэробные условия в той специфической среде, где имел место эукариогенез), то вряд ли селективным преимуществом была основанная на дыхании биоэнергетика. Вместо этого начальной причиной, способствовавшей стабилизации эндосимбиоза, могла быть метаболическая интеграция хозяина и симбионта, которая постепенно становилась мутуалистической. Специфическая модель такой метаболической связи, так называемая водородная гипотеза, была предложена Биллом Мартином и Миклосом Мюллером (Martin and M?ller, 1998). Согласно водородной гипотезе, метаболизм архейного хозяина был основан на утилизации молекулярного водорода, который был побочным продуктом анаэробного гетеротрофного метаболизма симбионта. Анаэробная продукция АТФ, а отчасти и аэробное дыхание могли стать дополнительными преимуществами эндосимбиоза.
Эндосимбиоз мог создать особые условия внутри клеток гибридного организма. Естественно, для того, чтобы быть унаследованными, бактерии, ставшие эндосимбионтами, должны были делиться. Все современные аэробные эукариотические клетки содержат множество митохондрий, и само собой разумеется, что эта связь – множество эндосимбионтов внутри одной химерной клетки – тянется из очень ранней фазы эволюции, фактически с момента происхождения этой химеры. Число копий эндосимбионта могло расти постепенно, с растущей зависимостью клетки от метаболизма симбионта. В этой ситуации эндосимбионты неизбежно должны были подвергаться лизису, что приводило к выпуску ДНК симбионта в окружающий (хозяйский) цитозоль химерной клетки. Примечательно, что даже в современных растениях и животных, где хромосомы отчасти защищены от чужой ДНК оболочкой ядра и фиксация любой встроившейся ДНК осложнена необходимостью интеграции в зародышевую линию и переживания рекомбинации в мейозе, встройки больших кусков митохондриальной ДНК в ядерный геном довольно распространены (Hazkani-Covo et al., 2010). В химерной протоэукариотической клетке вскоре после эндосимбиоза незащищенная ДНК хозяина должна была подвергаться настоящей бомбардировке ДНК эндосимбионта. Отметим, что эта ситуация принципиально асимметрична, потому что, во-первых, геномы жизнеспособных эндосимбионтов защищены от инвазии ДНК хозяина бактериальной мембраной, тогда как ДНК хозяина открыта; а во-вторых, потому, что количество свободной ДНК эндосимбионта намного больше. Таким образом, в результате возникает храповик (ratchet) перемещения генов от эндосимбионта к хозяину (Martin and Koonin, 2006a).
Открытость генома хозяина воздействию ДНК эндосимбионта имеет несколько важнейших последствий. Вставка участка ДНК эндосимбионта в ген хозяина, выполняющий важные для выживания клетки функции, должна была приводить к гибели соответствующих клеток и не фиксироваться в протоэукариотической популяции. Прокариоты обладают геномами с тесным («стена к стене») расположением генов, эти геномы в основном составлены из белок-кодирующих генов (см. гл. 5), и нет причины полагать, что АПЭ был исключением из этого правила. Таким образом, размножение эндосимбионта, сопровождаемое случайным лизисом, должно было оказывать на популяцию химерных клеток исключительное давление, возможно приводящее к втягиванию популяции в «бутылочное горло». Такое «бутылочное горло» может резко увеличивать скорость генетического дрейфа и, следовательно, усиливать роль случайности в эволюции при снижении интенсивности отбора (мы обсудим это важное явление подробнее в гл. 8). Предлагаемый сценарий эукариогенеза выглядит парадоксальным: эндосимбиоз кажется выгодным в плане метаболической кооперации, но в то же время разрушительным по причине высвобождения ДНК эндосимбионта и других эффектов его внутриклеточного размножения. Однако можно полагать, что эта ситуация создает сильное напряжение, но не парадокс: химерная клетка может выдержать атаку чужой ДНК без потери эндосимбионта, если взаимные связи между хозяином и симбионтом были установлены спустя очень короткое время после вторжения симбионта. Это напряжение между необходимостью сохранить эндосимбионта и тем гнетом, который он оказывает на химерную клетку, могло оказаться необходимым условием для появления эукариотических нововведений.
Последовательности определенного класса, будучи встроены даже в функционально важные гены, наносят гораздо меньший урон. Это так называемые самосплайсирующиеся интроны группы II, класс обратно-транскрибируемых самореплицирующихся генетических элементов, которые «прыгают» по геномам многих бактерий и некоторых мезофильных архей, а также митохондрий грибов и растений (Lambowitz and Zimmerly, 2004). Они имеют очень интересный, необычный жизненный цикл: используя РНК (рибозимный катализ), они вырезают сами себя из транскриптов соответствующих генов хозяина, а затем, сделав копии собственной ДНК с помощью обратной транскриптазы, которую сами и кодируют, встраиваются в новые сайты на хромосоме хозяина. Сегодня считается доказанным, что интроны группы II, которые в мире эукариот представлены только в некоторых органеллах эндосимбиотического происхождения, являются предшественниками сплайсосомных интронов, которые прерывают эукариотические белок-кодирующие гены (Keating et al., 2010; Toor et al., 2008). Действительно, терминальные структуры интронов группы II, ответственные за вырезание интрона, имеют близкое сходство с каноническими терминальными структурами сплайсосомных интронов. Еще важнее, что небольшие молекулы РНК в сплайсосоме, катализирующие сплайсинг у всех эукариот, также происходят от интронов группы II. Большинство бактерий контролируют число интронов группы II, удерживая его на уровне нескольких копий на бактериальную хромосому (или удаляя вовсе), вследствие интенсивного очищающего отбора в бактериальных популяциях (см. гл. 8). Интересно, что альфа-протеобактерии относительно богаты этими элементами, они содержат до 30 копий на бактериальный геном. Наиболее высокое содержание интронов группы II наблюдается в митохондриях грибов и растений, где они составляют существенную долю генома. Размножение интронов группы II в геноме эндосимбионта могло начаться вскоре после установления эндосимбиоза и было, вероятно, инициировано неизбежным снижением размера популяции симбионта и последующей невозможностью эффективно избавляться от самореплицирующихся элементов.
Таким образом, интроны группы II могли в значительном количестве присутствовать в ДНК эндосимбионта, бомбардировавшей геном хозяина. Более того, эти элементы обладают способностью активно интегрироваться в другие молекулы ДНК, так что они могли агрессивно атаковать хромосомы хозяина, встраиваясь в гены, а затем перемещаясь куда-то еще (Martin and Koonin, 2006a). Хотя интроны группы II после транскрипции автокаталитически вырезаются из транскрипта, так что окружающие экзоны сшиваются вместе, все же массовое «заражение» генов хозяина может представлять серьезную опасность. В самом деле, сплайсинг – относительно медленный процесс, он намного медленнее трансляции. У прокариот, где транскрипция и трансляция сопряжены, транскрипты со встроенными интронами группы II во многих случаях были бы транслированы раньше, чем дело дошло бы до сплайсинга. При большом количестве интронных вставок последствия могли быть чрезвычайно существенны, возможно, фатальны: накапливались бы неправильно транслированные белки, и это оказывало бы пагубное воздействие на клетку. Еще более серьезными могли бы быть последствия инактивации открытой рамки считывания, кодирующей обратную транскриптазу (ОТ) интронов группы II, действующую в цис-положении как кофактор сплайсинга (на этой стадии – не как фермент). Для генов, содержащих интроны с инактивированными генами ОТ, должен был бы идти сплайсинг in trans[63]. Как известно, он непродуктивен, так что такие интроны с высокой эффективностью прекращали бы синтез соответствующих функциональных белков. Таким образом, заражение генов хозяина интронами группы II должно было создать мощную движущую силу для каскада эволюционных обновлений (Koonin, 2006):
1. Аппарат сплайсинга, способный к эффективному функционированию в транзакции.
2. Инструмент защиты, который мог бы разобщить трансляцию и транскрипцию, позволив относительно медленному процессу сплайсинга завершиться до того, как начнется трансляция.
3. Дополнительные «линии защиты» от накопления аберрантных полипептидов.
Действительно, все три типа адаптаций к вторжению интронов развились в эволюции прокариот до появления LECA: сплайсосома, ядро, дополнительные системы контроля качества, такие как нонсенс-опосредованный распад (НОР) – механизм, удаляющий незрелые транскрипты, и убиквитин-зависимая система деградации белков, которая непосредственно разрушает аберрантные белки (см. рис. 7–6).
Таким образом, в принципе натиск ретроэлементов эндосимбионта на геном хозяина создает давление отбора, необходимое для возникновения ряда определяющих нововведений эукариотической клетки, и самое главное – системы внутренних мембран, главным компонентом которой является ядро. При более близком рассмотрении, однако, проблема развития этих систем все еще подозрительно напоминает «неупрощаемую сложность». Необходимы особые объяснения, и их непросто находить. Например, сложно устроенный комплекс ядерной поры не может работать и, соответственно, не может быть подхвачен отбором в отсутствие оболочки ядра, но последняя не может сообщаться с цитозолем без комплекса ядерной поры. Скорее всего, эволюция системы внутренних мембран и ядра, хоть и быстрая в масштабах, все же проходила через промежуточные стадии. Пролиферация эндосимбионтов внутри развивающихся химерных клеток могла быть очень постепенной, что позволяло бы протоэукариотам жить достаточно долго, чтобы нововведения с ограниченным положительным эффектом могли зафиксироваться. Можно представить, что серия нововведений началась с образования везикул из мембраны эндосимбионта. Эти везикулы могли сформировать примитивную систему внутренних мембран, включая протоядро, то есть компартмент, заключавший в себе одну или несколько хромосом и имевший не поры современного типа, а только просветы между уплощенными везикулами; каждая их них оставалась связана с системой внутренних мембран. Просветы в протоядерной мембране предупреждали доступ рибосом к сайтам транскрипции, таким образом разъединяя транскрипцию и трансляциию, типично сопряженные у прокариот, и уменьшая тем самым вред от встроившихся ретроэлементов (интронов группы II). В такой ситуации клетка могла пережить дальнейшую пролиферацию (прото)митохондрий и усиление выхода из них ДНК и ретроэлементов. Это, в свою очередь, могло создавать селекционное давление, способствующее дальнейшей эволюции ядра, которая в итоге привела к появлению комплекса поры современного типа, активно контролирующего ядерно-цитоплазматические потоки и соединяющего сплайсинг первичных мРНК с экспортом зрелых мРНК из ядра. Пролиферация внутренних мембран в конечном итоге привела к полной реконструкции мембранной системы прокариотической клетки, причем предковая архейная плазматическая мембрана была замещена бактериальными мембранами, предположительно изнутри, путем распространения эндомембран, происходящих от симбионта.
Можно представить себе подобный сценарий для эволюции сплайсосомы, начиная с системы, состоящей только из РНК, в которой как интроны, так и каталитическая малая РНК, участвующая в сплайсинге, происходят от ретроэлементов. Следующая стадия эволюции могла, в числе прочего, задействовать Sm-белок[64], стабилизирующий РНК-дуплексы, вовлеченные в сплайсинг (Veretnik et al., 2009), за чем последовала эволюция рибонуклеопротеидной сплайсосомы. Замечательно, что совсем недавние наблюдения указывают на то, что один из ключевых белковых компонентов сплайсосомы, Prp8, является инактивированным производным обратной транскриптазы интрона группы II (Dlakic and Mushegian, 2011). Это неожиданное открытие – еще одно свидетельство разнообразного вклада интронов группы II в происхождение как сплайсосомных интронов, так и самой сплайсосомы. В более общем плане такая пошаговая эволюционная настройка может отчасти объяснять эволюцию сложных систем, столь характерных для эукариотической клетки.
Конечно, многие важные аспекты клеточной организации эукариот не могут быть легко связаны с прямыми последствиями эндосимбиоза. Обратите внимание на эукариотический хроматин, с его множеством линейных хромосом, заменяющих кольцевые хромосомы, обычные у бактерий и архей. Чрезвычайно изощренная организация эукариотического хроматина, с его регулярными нуклеосомными структурами, по крайней мере внешне резко отличается от много более простой структуры прокариотических хромосом (Branco and Pombo, 2007), хотя археи (эуриархеи) обладают простыми нуклеосомами, содержащими гистоны (Bailey et al., 2002). Добавьте к этому фундаментальное изменение устройства генома, в котором главный принцип прокариотических геномов – оперонная организация – отброшен. Эту серию крупных изменений, связанных с эукариогенезом, трудно приписать специфическому влиянию эндосимбиоза. Тем не менее можно проследить некоторые интересные связи. Линейные хромосомы стоят перед трудной проблемой репликации концов, учитывая, что все известные ДНК полимеразы требуют затравки и не могут стартовать с первого нуклеотида матрицы. Если не работает специальный механизм, обеспечивающий сохранение концевых участков хромосом, то в каждом цикле репликации они укорачиваются, делая репликацию неустойчивой. Все эукариоты используют фермент, называемый теломеразой, который сохраняет набор повторов на концевых участках хромосомы путем обратной транскрипции небольшой молекулы РНК, ассоциированной с ним (Autexier and Lue, 2006). Поразительно, но теломераза – это еще одно (кроме Prp8) эволюционное производное от обратной транскриптазы интрона группы II, в данном случае сохранившее энзиматическую активность. Теломераза представляется тем связующим звеном, которое обеспечило переход к линейным хромосомам в пределах связанного с эндосимбиозом или, говоря более узко, стимулированного ретроэлементами каскада инноваций (Koonin, 2006; см. рис. 7–6 и 7–7).
Для всей последующей эволюции эукариот критически важным и, очевидно, неизбежным следствием возникновения ядра стало радикальное снижение уровня ГПГ, если не полное его прекращение. Хотя имеются многочисленные сообщения о захватах бактериальных генов одноклеточными эукариотами, уровень ГПГ трудно сравнивать с тем, который наблюдается у непаразитических бактерий и архей (Keeling and Palmer, 2008). Большая часть ДНК, которая попадает в эукариотическую клетку, разрушается, даже не успев войти в ядро и достичь хроматина. Такое резкое замедление ГПГ подсказывает естественный ответ на вопрос, который иначе ставит в тупик: почему эукариоты утратили все опероны своих прокариотических предков? (Архейный хозяин, несомненно, обладал типичной оперонной организацией генов, как и эндосимбионт.) Вспомним концепцию эгоистичного оперона: как только происходит эффективный ГПГ, храповик приводится в движение; значит, коль скоро оперон разрушен, вероятность его воссоздания посредством рекомбинации, а затем сохранения отбором становится чрезвычайно мала. Фактически этот оперон безвозвратно утрачивается в данной линии. Видимо, этот храповой механизм уничтожил все прокариотические опероны на ранних стадиях эволюции эукариот. Опероны, все-таки существующие у некоторых эукариот, таких как нематоды, не имеют ничего общего с прокариотическми оперонами; по всей видимости, они возникли de novo и не были зафиксированы в далеко разошедшихся эукариотических линиях.
Данный сценарий приводит к простому, но неожиданному предсказанию: те гены, которые могут функционировать только внутри оперонов, но оказывают повреждающее действие, оказавшись вне контекста оперона, будут полностью утрачены у эукариот. Замечательно, что это в точности соответствует случаям систем токсин – антитоксин и рестрикции – модификации, которые повсеместно распространены у бактерий и архей (см. гл. 5), но, по-видимому, полностью отсутствуют у эукариот.
Почти полная элиминация ГПГ также дает эволюционный стимул для широкомасштабной дупликации генов, которая является главным механизмом инновации у эукариот (Lespinet et al., 2002). Популяционное «бутылочное горлышко», обусловленное размножением эндосимбионтов, сделало возможным взрыв дупликаций во время фазы ствола (Makarova et al., 2005; также см. гл. 8), но в более общем смысле дупликации замещают ГПГ как главный источник обновлений в течение всей эволюции эукариот.
Последнее по порядку, но, конечно, не по значению – это то, что низкий уровень ГПГ у эукариот можно считать принципиальным фактором, обусловившим возникновение полового размножения с использованием мейоза, одного из определяющих биологических процессов у эукариот. Действительно, у эукариот вредные мутации обычно не могут быть скомпенсированы горизонтально перенесенными генами, и это давление должно способствовать эволюции системы регулярной рекомбинации, которая бы предупреждала накопление таких мутаций и последующий мутационный крах. Такая система, противодействующая храповику Мёллера, развилась в форме мейоза и полового размножения. Это мог быть и не единственный фактор, который послужил движущей силой в эволюции полового размножения, но он, несомненно, важен (мы не имеем возможности обсуждать подробно данную проблему, чрезвычайно популярную среди эволюционных биологов [de Visser, Elena, 2007]). Учитывая, что снижение ГПГ в большой степени является следствием эволюции ядра, «изобретение» мейоза и полового размножения – на базе систем репарации и деления клеток у архей – по-видимому, является частью цепи инициированных вторжением интронов адаптаций, направленных на защиту и контроль повреждений (см. рис. 7–6).
Другое важнейшее последствие пролиферации протомитохондриального эндосимбионта внутри химерной протоэукариотической клетки состоит в том, что в известном смысле комплементарным снижению ГПГ из внешних источников является высвобождение случайных участков бактериальной ДНК (в противоположность эгоистичным элементам) посредством лизиса эндосимбионтов. Такие фрагменты ДНК тоже могут встраиваться в хромосому хозяина, хотя и реже, чем эгоистичные элементы. Во многих случаях такие включения окажутся фатальными. Однако, когда полная последовательность гена из эндосимбионта встраивается в межгенный участок на хромосоме хозяина, заметного повреждающего эффекта может и не быть. Более того, встроенный ген может экспрессироваться, если необходимые регуляторные элементы доступны по соседству с местом встройки. Фрагменты митохондриальной ДНК случайно встраиваются в ядерные геномы растений и животных даже теперь (Hazkani-Covo et al., 2010), несмотря на преграды, создаваемые ядром и системами защиты от цитозольной ДНК. Несомненно, частота встроек была намного выше во время эукариогенеза, до полного формирования эукариотической клеточной организации. Храповик переноса генов приводит к удвоению гена, когда функциональные копии одного и того же гена представлены как в геноме эндосимбионта, так и в ядерном геноме. Некоторые из ядерных генов, возникших таким путем, были задействованы в клеточных функциях вне эндосимбионта. Однако в других случаях встроенному гену предшествует последовательность, кодирующая так называемый транзитный пептид, способный опосредовать импорт белка обратно в эндосимбионт. Это еще одно «счастливое совпадение», но оно не так невероятно, как кажется, потому что транзитные пептиды обычно представляют собой простые повторяющиеся последовательности, которые вполне могут возникнуть по чистой случайности (Neupert and Herrmann, 2007). Коль скоро есть некий ядерный ген, кодирующий белок, который функционирует в митохондрии, функционально избыточные митохондриальные гены могут быть утрачены без каких-либо вредных последствий. Эта избыточность создает другой храповик, который направляет митохондрии прямо на путь редуктивной эволюции, притом что ядерный геном постоянно подвергается воздействию ДНК из лизированных эндосимбионтов, приводя к многочисленным «отборочным соревнованиям» для переноса каждого гена эндосимбионта в ядерный геном. Конечный результат: огромное большинство белков, функционирующих в митохондриях, кодируется ядерным геномом, и только те гены, которые непременно должны экспрессироваться внутри митохондрии для ее собственного функционирования (см. обсуждение выше в этой главе), остаются в геноме органеллы. Та же самая схема сохраняется для других эндосимбионтов, в частности для пластид. Конечно, редуктивная эволюция также приводит к необратимой утрате многих генов эндосимбионта, которые оказываются избыточны без необходимости привлечения белков хозяина, поскольку сама функция этих белков становится несущественной для эндосимбионта или потому, что метаболиты хозяина, такие как нуклеотиды и аминокислоты, импортируются в эндосимбионт, устраняя необходимость в соответствующих метаболических путях. Эндосимбионты с существенно редуцированным геномом вытеснили эндосимбионтов с большими геномами просто-напросто из-за быстрой репликации генома и соответственно быстрого деления, и таким образом редукция генома зафиксировалась в ходе эволюции.
Приписывание единственной все объясняющей причины любому крупному эволюционному сдвигу неизбежно будет недопустимым упрощением и эпистемологической ошибкой, поскольку «причины» вообще являются конструктами человеческого сознания (см. прил. I). Тем не менее я уверен, что согласованность между многими ключевыми эукариотическими нововведениями, легко интерпретируемая как ответ на эндосимбиоз, и в частности на атаки происходящих из эндосимбионта мобильных элементов, слишком убедительна, чтобы отказаться от нее как от беспочвенной фантазии. Такой сценарий, даже если он не является фальсифицируемым в целом (см. прил. I), тем не менее включает частные фальсифицируемые предсказания и стимулирует новые эксперименты. Действительно, с тех пор, как мы с Биллом Мартином предложили нашу версию эндосимбиогенетического сценария, в которой центральная роль отводится интронам группы II (Martin and Koonin, 2006a), она выдержала две весьма жесткие проверки на фальсифицируемость. Одна из них – открытие сопряжения транскрипции и трансляции у Archaea (French et al., 2007). И еще более показательная проверка – определение структуры интрона группы II, которая не оставляет места серьезным сомнениям по поводу происхождения сплайсосомных интронов от прокариотических ретроэлементов, что воспринималось как спекуляция в то время, когда наша гипотеза была сформулирована (Toor et al., 2008).
Еще одно направление экспериментальных исследований могло бы сконцентрироваться на необычных бактериях, таких как Planctomycetes, которые обладают внутриклеточными компартментами, заключающими в себе хромосому (Fuerst, 2005). Конечно, эти организмы – прокариоты по всем критериям[65]. Более того, сравнительный анализ геномов показывает, что они не кодируют гомологов белковых субъединиц комплекса ядерной поры (Mans et al., 2004). Наша модель предсказывает, что, хотя Planctomycetes и некоторые родственные бактерии обладают «ядроподобным» компартментом, у них сохраняется сопряжение транскрипции и трансляции, типичное для прокариот. Это означает, что функциональные рибосомы входят в «ядерный» компартмент и инициируют трансляцию матричных РНК еще до завершения их транскрипции, или же образующиеся молекулы мРНК одновременно с транскрипцией выталкиваются через отверстия в стенках компартмента.
Если, напротив, эксперименты покажут, что у «ядерных» бактерий транскрипция разобщена с трансляцией, то это будет серьезным возражением против нашей модели. Немедленным ee опровержением было бы открытие ныне существующих архезой, то есть свободноживущих эукариот, не имеющих никаких признаков МПО, однако обладающих всеми остальными типичными признаками эукариотической клеточной организации. (Паразит с сильно редуцированным геномом, однако, не будет здесь убедительным примером.) Вероятность того, что архезои будут однажды открыты, уменьшается с каждым случаем обнаружения еще одной группы простейших, не имеющих нормальных митохондрий, но все-таки содержащих МПО.
| <<< Назад Сценарий симбиогенеза в сравнении с архезойным сценарием |
Вперед >>> Удивительная история эукариотических интронов |
- «Кунинский сценарий»
- Происхождение Рюриковичей: ДНК-генеалогия доказывает
- Происхождение растений
- Глава 7. Происхождение человека и половой отбор
- 2. ПРОИСХОЖДЕНИЕ ВОДОРОСЛЕЙ
- 3. ПРОИСХОЖДЕНИЕ ГРИБОВ
- Семь ключевых терминов и понятий
- 4. ПРОИСХОЖДЕНИЕ ЖЕНСКОГО ГАМЕТОФИТА ЦВЕТКОВЫХ РАСТЕНИЙ
- 3. ПРОИСХОЖДЕНИЕ СТЕБЛЯ
- 6. ПРОИСХОЖДЕНИЕ ПАПОРОТНИКООБРАЗНЫХ РАСТЕНИИ
- 8. ПРОИСХОЖДЕНИЕ ЦВЕТКОВЫХ РАСТЕНИЙ
- 4. ВЫХОД РАСТЕНИЙ НА СУШУ И ПРОИСХОЖДЕНИЕ НАЗЕМНОЙ РАСТИТЕЛЬНОСТИ
