Книга: Логика случая. О природе и происхождении биологической эволюции
Точность передачи информации в биологических системах и ее (не)адаптивная эволюция
| <<< Назад Континуум дарвиновских и ламарковских механизмов эволюции |
Вперед >>> Шум в биологических системах и его созидательная роль в эволюции |
Точность передачи информации в биологических системах и ее (не)адаптивная эволюция
Эволюция жизни целиком основана на процессах передачи дискретной информации – между поколениями путем репликации генома и от генома к эффекторным молекулам (РНК и белкам) – как описано в главе 2. Не существует канала передачи информации, свободного от ошибок, как впервые математически сформулировал Клод Шеннон, создавший теорию информации, связав процесс передачи информации с законами термодинамики. Как отмечалось в главе 2, точность репликации генома не должна быть ниже определенного минимума; соответственно, частота мутаций не должна превышать определенный порог, чтобы избежать мутационного вырождения популяции. Очевидно, что частота мутаций не может быть и слишком низкой, дабы оставить возможность хотя бы для минимальной эволюционируемости (потенциала для эволюции – см. обсуждение в следующем разделе). Менее ясно, важен ли этот нижний предел практически в реальных биологических системах. Таким образом, фундаментальный вопрос сводится к следующему: каким образом отбор контролирует частоту мутаций (если он это действительно делает)? Точнее, удерживает ли очищающий отбор частоту мутаций просто ниже порога вырождения, или же происходит по крайней мере, для некоторых организмов и, возможно, в особых ситуациях, отбор на достаточно высокую частоту мутаций, чтобы обеспечить сырье для эволюции?
Отбор на приемлемую точность репликации (и, более глобально, всех процессов передачи информации) является одним из центральных аспектов эволюции. Это непосредственно видно из того огромного разнообразия, сложности и многоуровневой организации репарационных систем, которые обнаруживаются во всех клеточных формах жизни (Aravind et al., 1999; Friedberg et al., 2005). У прокариот до 10 процентов кодирующей емкости генома могут быть заняты компонентами систем репарации, которые действуют на всех этапах репликации ДНК, а также устраняют различные мутационные повреждения, происходящие за пределами процесса репликации. С другой стороны, существует класс репликаторов, у которых (практически) отсутствуют механизмы исправления повреждений; это РНК-содержащие вирусы. Действительно, эти вирусы демонстрируют чрезвычайно высокий уровень ошибок включения нуклеотидов и общий уровень мутаций, явление, хорошо известное в связи с важностью для медицины быстрой эволюции вирусов гриппа и ВИЧ (Holmes, 2009). Эти вирусы, по-видимому, эволюционируют не слишком далеко от порога мутационного вырождения (Drake and Holland, 1999). Все РНК-вирусы обладают небольшими геномами (менее 30 Кб), что отчасти является следствием физической хрупкости длинных молекул РНК, но также связано с отсутствием репарационных механизмов. (Можно было бы утверждать, что сложные системы репарации в таких вирусах не могли развиться, потому что они не были бы выгодны, учитывая фундаментальную нестабильность генома.) На самом деле РНК-содержащие вирусы с самыми большими геномами (вирусы отряда Nidovirales), по всей видимости, обладают различными, хотя и простыми, системами репарации (Eckerle et al., 2007). Кроме того, открытие РНК-деметилаз в геномах различных растительных РНК-содержащих вирусов означает, что даже в этих простейших геномах репарация может эволюционировать, когда вирус распространяется в условиях повышенного давления окружающей среды (Aravind and Koonin, 2001; van den Born et al., 2008).
В рамках концепции мутационного вырождения возникает естественная мысль, что частота мутаций на нуклеотид должна быть обратно пропорциональна размеру генома организма, так чтобы число мутаций на геном на поколение оставалось примерно постоянным. Ян Дрейк первым выразил эту идею явным образом, и потому ее часто называют гипотезой Дрейка (Drake, 1991). Гипотеза Дрейка довольно хорошо работает для вирусов и прокариот. Однако изучение новейших данных, проведенное Майклом Линчем, неожиданно (по крайней мере, на первый взгляд) выявило противоположную зависимость у эукариот: скорость мутирования в расчете на нуклеотид положительно коррелирует с размером генома (Lynch, 2010). Следуя в русле неадаптивной теории эволюции сложности, Линч показал, что небольшое повышение частоты мутаций не будет «замечено» очищающим отбором в небольших популяциях, которые типичны для многоклеточных эукариот, и, соответственно, не может элиминироваться в ходе эволюции этих организмов. Отсюда появляется «полуадаптивная» гипотеза эволюции мутационного фона: существует селективное давление на понижение частоты мутаций ниже порога вырождения и чуть дальше, поскольку за счет этого популяция становится более устойчивой, однако не на окончательную минимизацию частоты мутаций. В соответствии с этой гипотезой отбора, который бы препятствовал падению частоты мутаций ниже любого минимального значения, не существует; частота мутаций остается относительно высокой по чисто стохастическим причинам (см. также следующие разделы в этой главе).
Однако ситуация не столь проста, как видно из результатов долгосрочных экспериментов с эволюционирующими популяциями кишечной палочки, проведенных Ричардом Ленски и его коллегами. Эти эксперименты показывают, что интенсивный отбор на адаптацию бактериальных популяций к новой среде часто ведет к появлению аллелей-мутаторов (иными словами, бактерий с повышенной частотой мутаций в связи с повреждением одного из ферментов репарации), которые вытесняют предыдущие поколения с низкими показателями мутаций (Sniegowski et al., 1997). Если быть более точным, представляется, что аллели-мутаторы достигают значительного распространения в популяции и даже фиксируются за счет тесного сцепления с адаптивными мутациями, вызываемыми этими мутаторами. Однако, когда внешнее селективное давление убрано, мутаторы становятся невыгодными и вымываются отбором (Denamur and Matic, 2006). Эти результаты приводят к важному обобщению: в зависимости от целого ряда факторов, таких как экологический стресс и эффективный размер популяции, отбор на низкую или высокую частоту мутаций может происходить и происходит в действительности.
Частота ошибок транскрипции гораздо выше, нежели частота ошибок репликации, а ошибки трансляции случаются еще более часто (см. рис. 9–4). Хотя экспериментальные измерения уровня ошибок включения аминокислот в ходе трансляции немногочисленны и ограничены несколькими модельными системами, все же ясно, что точность трансляции удивительно низка. В самом деле, частота встраивания ошибочных аминокислот составляет 10-4—10-5 – любопытно, что она близка к частоте ошибок репликации у РНК-вирусов. Получается, что около 20 процентов белковых молекул, синтезируемых в любой из клеток, содержат по меньшей мере одну неверную аминокислоту (Drummond and Wilke, 2009). Последствия ошибок транскрипции и трансляции, иногда метко называемых фенотипическими мутациями, очевидно, менее критичны, чем последствия генетических мутаций, по той причине, что фенотипические мутации, как правило, не наследуются (существуют примечательные исключения, например обратная транскрипция с последующим включением в геном ДНК-копии ошибочно транскрибируемой РНК; Burger et al., 2006). Учитывая сравнительно короткий срок жизни любой РНК или белковой молекулы, никакая фенотипическая мутация сама по себе не может оказать серьезного влияния на выживаемость, поэтому неудивительно, что для фенотипических мутаций допустимы гораздо более высокие частоты ошибок, чем для генетических мутаций. Однако столь же очевидно, что чрезмерно высокие темпы фенотипических мутаций несовместимы с жизнью. А значит, как и в случае с системами репарации ДНК, многочисленные механизмы, служащие для отслеживания ошибок транскрипции и трансляции, безусловно, существуют. Было показано, что коррекционная активность ДНК-зависимой РНК-полимеразы уменьшает процент ошибок на несколько порядков (Alic et al., 2007; Sydow and Cramer, 2009). Кроме того, также были открыты остающиеся пока слабоизученными процессы посттранскрипционного исправления ошибок метилирования в РНК (Begley and Samson, 2003; Falnes, 2005). Вероятно, из механизмов, контролирующих частоту фенотипических мутаций, лучше всего исследована коррекция аминоацил-тРНК-син тетазой (АРСазой), при которой молекулы аминоацил-тРНК, связанные с ошибочными аминокислотами, гидролизуются и утилизируются (Hussain et al., 2010; Ling et al., 2007). Упомянутая коррекция АРСазой дополняется рибосомной коррекцией на следующей стадии трансляции, при которой рибосома отбраковывает ошибочно связанные тРНК (Blanchard et al., 2004; Daviter et al., 2006). Однако значительное увеличение надежности трансляции, по-видимому, вступает в противоречие с требованием высокой скорости синтеза белка. Существенное повышение точности трансляции может быть легко достигнуто путем мутации конкретных позиций в рРНК или в рибосомных белках, но эти мутации оказываются вредными для клеток, по-видимому, из-за медленной трансляции (Dong and Kurland, 1995; Johansson et al., 2008).
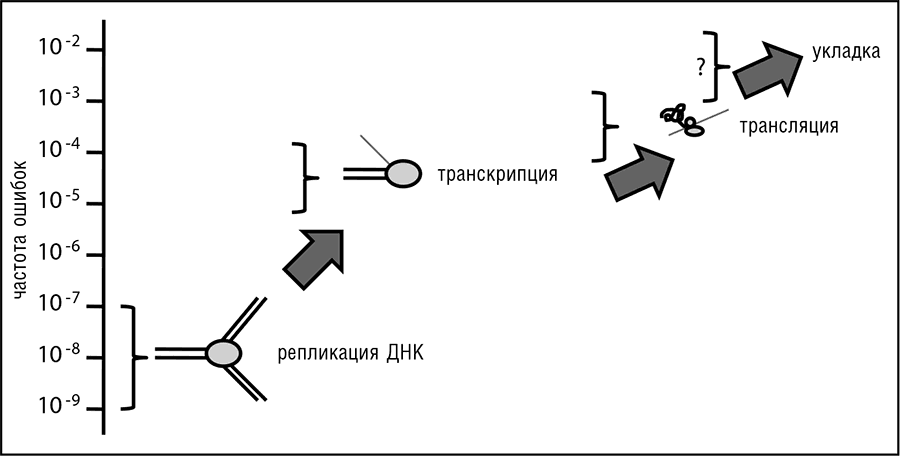
Рис. 9–4. Типичные частоты ошибок на различных стадиях передачи биологической информации.
Эксперименты с точными, но медленными рибосомными мутантами позволяют предположить, что компромисс между скоростью и точностью трансляции связан с механическими ограничениями трансляционной системы и с трудом может быть преодолен мутациями в ее компонентах. В результате для ограничения ошибок трансляции и их пагубных последствий эволюция, похоже, выбрала другие способы адаптаций.
Твердо установлено, что «высокостатусные» гены (те, что интенсивно экспрессируются и медленно эволюционируют) обладают более выраженным предпочтением триплетов по сравнению с «низкостатусными» генами. Оптимальные триплеты, которыми насыщены гены с высоким статусом, обеспечивают более низкую частоту ошибок, равно как и более высокую скорость трансляции, и, таким образом, частично избегают вышеупомянутого компромисса (Drummond and Wilke, 2009, 2008). Асимметрия триплетов между высокостатусными и низкостатусными генами может объясняться ценой селекции; в силу этого заметный отбор оптимальных кодонов может идти только в генах высокого статуса.
Основным вредным эффектом ошибок трансляции считается неправильная укладка белка (Drummond and Wilke, 2009, 2008), хотя ошибки включения аминокислот в каталитических сайтах, безусловно, могут стать дополнительным фактором. Как уже говорилось в главе 4, отбор на устойчивость к неправильной укладке является одним из главных аспектов эволюции белков – возможно, даже ее основной движущей силой. Менее ясно, какой источник неверной укладки наиболее важен – изначально неправильная последовательность или ошибки при ее трансляции. В любом случае, хотя укладка белка обычно не рассматривается в качестве процесса передачи информации, в действительности она им является. В самом деле, укладка предполагает поток информации, идущий от одномерной аминокислотной последовательности к трехмерной структуре белка.
Ровно то же самое относится к структурным РНК. Частоту неправильной укладки трудно определить экспериментально, и этого не было сделано для большого числа белков или РНК. Если тенденция, отражающая процент ошибок и показанная на рис. 9–4, – чем дальше от генома, тем менее точен этап передачи информации, – служит каким-либо индикатором, частота ошибок укладки должна быть даже выше частоты ошибок трансляции.
Такое предсказание также следует из здравого смысла, учитывая невероятную сложность процесса укладки и огромное количество ошибочных вариантов, доступных в принципе для укладываемого белка или РНК-молекулы (Bowman et al., 2011; Pande et al., 1998). Имея в виду высокую сложность пространства укладок, эпохальное открытие (сделанное первоначально Кристианом Анфинсеном и впоследствии подтвержденное многочисленными экспериментами), что белки способны самопроизвольно складываться в нативную конформацию, вызвало огромное удивление (Anfinsen, 1973).
Спустя почти 50 лет после открытия Анфинсена все еще остается предметом споров, глобальный или локальный минимум свободной энергии ищут спонтанно укладывающиеся белки. Но стало ясно, что лишь небольшие белки укладываются спонтанно; большинство белков нуждаются в специальных молекулярных устройствах, других белках, известных как шапероны, чтобы сформировать правильную структуру. Шапероны функционируют удивительным образом: их молекулы образуют «ячейку» (известную также как ячейка Анфинсена), которая изолирует укладываемый белок от цитоплазмы и частично разворачивает его, облегчая тем самым поиск нативной конформации (Ellis, 2003). Большинство шаперонов – синтезируемые в больших количествах, высококонсервативные, высокостатусные белки.
Первоначально некоторые из шаперонов были открыты как «белки теплового шока», то есть белки, которые резко усиливают свою активность при повышенной температуре (и, как было показано позже, при других стрессовых условиях) и противодействуют неправильной укладке других белков, которая усугубляется при стрессе (Vabulas et al., 2010). Хотя это явление менее детально исследовано, белковые шапероны также способствуют укладке молекул РНК (Russell, 2008; Woodson, 2010). В целом контроль над укладкой белков (и, вероятно, РНК) является, без сомнения, одной из основных функций во всех клетках.
Помимо устройств, подобных шаперонам, все клетки задействуют арсенал разнообразных молекулярных машин для контроля управляемого расщепления белков, в частности неправильно уложенных, и РНК. Как и молекулярные шапероны, эти машины – протеасомы, в случае белков, и экзосомы (деградосомы у бактерий) в случае РНК – повсеместно распространены во всех трех доменах жизни, присутствуют в изобилии в большинстве клеток и подвержены регулированию в условиях стресса (Hartung and Hopfner, 2009; Volker and Lupas, 2002; см. также гл. 7). Кроме того, эти машины, наряду с дополнительными вспомогательными системами регулируемого протеолиза, являются основными внутриклеточными потребителями энергии (АТФ). Бактерии дополнительно обладают высококонсервативными системами так называемой транс-трансляции, которые освобождают забуксовавшие рибосомы из аберрантных мРНК, на которых трансляция не в состоянии прекратиться должным образом, и предназначают такие мРНК и их белковые продукты (также аберрантные) к разрушению (Keiler, 2008).
Как мы подробно обсуждали в главе 7, эукариоты обладают важной стадией обработки информации, которая фактически не имеет эквивалента у прокариот: сплайсинг первичных транскриптов. Сопутствующая система контроля качества, по-видимому, эволюционировала одновременно с возникновением эукариот (см. гл. 7): механизм нонсенс-опосредованного распада (НОР), распознающий и уничтожающий аберрантные мРНК, которые содержат стопкодоны внутри экзонов помимо последнего, 3’-концевого экзона кодирующей последовательности (Behm-Ansmant et al., 2007; Stalder and Muhlemann, 2008).
Итак, контроль частоты ошибок и их влияния на биологические процессы передачи информации представляется одним из ключевых аспектов эволюции. По причинам, которые мы понимаем лишь частично (в лучшем случае), процент ошибок, по-видимому, не падает сильно ниже максимально допустимого значения: порога мутационного вырождения и соответствующего катастрофического порога фенотипических мутаций, который не изучен подробно, но предположительно существует. В случае частоты мутаций, простая неадаптивная теория популяционной генетики вполне способна объяснить наблюдаемые значения с достаточной степенью надежности (Lynch, 2010). Аналогичная аргументация была применена к фенотипическим мутациям (Burger et al., 2006), но в этом случае решение представляется менее очевидным.
Существует противоречие между относительно высокой частотой ошибок транскрипции, трансляции, сплайсинга, а также, весьма вероятно, укладки и исключительной сложностью устройств предотвращения повреждений, таких как протеасомы, экзосомы, системы НОР и др. Эволюция этих многоуровневых систем контроля предполагает, что вредное воздействие фенотипических мутаций при той частоте, что наблюдается при воспроизводстве клеток, довольно значительно, однако издержки отбора на повышение точности процессов были бы непосильными, и, соответственно, неоднократно выбирались альтернативные пути эволюции систем предотвращения повреждений.
В целом, по-видимому, борьба с энтропией является одним из важнейших аспектов эволюции. Отбор на уменьшение и контроль энтропии носит универсальный характер и последовательно распространяется по этапам передачи информации, от репликации до укладки и сортировки белков и РНК. Антиэнтропийная эволюция частично ведет к снижению самой частоты мутаций/ошибок, а частично действует на уровне контроля повреждений. Эволюционные эксперименты показывают, что отбор на повышение частоты мутаций действительно происходит. Тем не менее остается неясным, широко ли распространен такой отбор на повышение шума и достаточен ли уровень шума, который антиэнтропийные механизмы не способны устранить, чтобы обеспечить изменчивость, необходимую для эволюции. Мы обсудим эту ключевую проблему в следующих разделах.
| <<< Назад Континуум дарвиновских и ламарковских механизмов эволюции |
Вперед >>> Шум в биологических системах и его созидательная роль в эволюции |
- Драма ламаркизма
- Ламарковский, дарвиновский и райтовский режимы эволюции и критерии для обнаружения ламарковского наследования
- Ламарковские и квазиламарковские явления в эволюции
- Другие (квази)ламарковские системы, функционирующие по принципу CRISPR
- Континуум дарвиновских и ламарковских механизмов эволюции
- Точность передачи информации в биологических системах и ее (не)адаптивная эволюция
- Шум в биологических системах и его созидательная роль в эволюции
- Эволюция эволюционируемости, надежность биологических систем и реализуемость эволюционного предвидения
- Краткий обзор и перспектива
- Рекомендуемая дополнительная литература
- Эволюция. Классические идеи в свете новых открытий
- Глава 4 Эволюция на наших глазах
- Эволюция под управлением компьютера
- Эволюция, повернувшая вспять
- § 9. Строение и эволюция Вселенной
- Эволюция человека том 2 Обезьяны нейроны и душа 2011
- Эволюция человека. В 2 книгах. Книга 1. Обезьяны, кости и гены
- Раздел I. Источники Географической Информации
- Глава 5 Человек – эволюция: в чью пользу счет?
- Эволюция и прогресс
- Эволюция и религия
- Эволюция продолжается
