Книга: Эволюция. Классические идеи в свете новых открытий
Бактерии наследуют приобретенный иммунитет
| <<< Назад Горький привкус победы, или Как дрожжи заплатили за успех |
Вперед >>> Бактериальные гены помогли нематодам стать паразитами |
Бактерии наследуют приобретенный иммунитет
Говоря о горизонтальном переносе у неродственных организмов и РНК-интерференции, нельзя не упомянуть об одном исключительном явлении — приобретенном иммунитете у бактерий. Это явление замечательно вдвойне. Это, во-первых, неопровержимый случай наследования приобретенных признаков (о чем так долго спорили и продолжают спорить биологи) и, во-вторых, горизонтальный перенос, поставленный на конвейер и работающий на пользу своему хозяину. Речь идет о так называемой CRISPR-системе.
В книге «Рождение сложности» в главе о наследовании приобретенных признаков мы рассказали о смелой гипотезе австралийского иммунолога Эдварда Стила и его коллег, предположивших, что приобретенный иммунитет у позвоночных иногда может наследоваться (Стил и др., 2002). Будь это так, пришлось бы признать реальность «ламарковского» наследования приобретенных признаков у позвоночных, пусть и в виде редкого, специфического исключения. Но прошло уже больше десятилетия, а гипотеза Стила так и не получила весомых подтверждений. При нынешних темпах развития биологии это означает, что Стил был не прав и приобретенный иммунитет у позвоночных не наследуется.
Но пути науки неисповедимы. Не успели неоламаркисты оплакать эту потерю, как микробиологи преподнесли им роскошный подарок. Они обнаружили, что у многих бактерий и архей есть особая система приобретенного иммунитета, основанная на заимствовании генетического материала у паразитов (вирусов и плазмид) и «вписывании» приобретенных защитных свойств прямо в геном. Эти свойства автоматически становятся наследственными и передаются всем потомкам данной бактерии. Новооткрытая система — максимальное приближение природы к «подлинно ламарковскому» наследованию, известное на сегодняшний день.
Этот тип иммунитета обеспечивается маленькими молекулами РНК, гены которых находятся в особых локусах (участках хромосомы), получивших неудобоваримое название CRISPR (clustered regularly interspaced short palindromic repeats — расположенные группами, регулярно подразделенные короткие палиндромные повторы).
Локусы CRISPR найдены у 90 % архей и 40 % бактерий. Каждый такой локус состоит из нескольких несоприкасающихся палиндромных повторов[77], между которыми имеются промежутки — спейсеры. Спейсер — это короткий участок вирусной или плазмидной ДНК. Размер CRISPR-повтора — от 23 до 47 нуклеотидных пар, спейсера — от 21 до 72. Число групп «повтор/спейсер» может достигать 375, но обычно меньше 50. В бактериальном геноме может быть один или несколько локусов CRISPR.
Поблизости от CRISPR расположены гены белков Cas (CRISPR associated). Эти белки необходимы для работы данной системы. Большинство Cas — это нуклеазы (ферменты, разрезающие молекулы ДНК и РНК), полимеразы (ферменты, осуществляющие матричный синтез НК) и нуклеотид-связывающие белки. Всего эта группа объединяет около 40 семейств белков.
Повторы CRISPR-последовательностей в пределах каждого вида микробов почти одинаковы, но сильно различаются от вида к виду.
В 2007 году было показано, что бактерия Streptococcus thermophilus в ходе борьбы с вирусами-бактериофагами изменяет свой локус CRISPR, достраивая к концу старой последовательности одну или несколько единиц «повтор/спейсер». Добавленные спейсеры совпадали с участками вирусного генома. При этом бактерии приобретали устойчивость к данному вирусу. Если изменить последовательность нуклеотидов нового спейсера или вообще удалить его, приобретенная устойчивость к фагу теряется.
В последующие два года ученые доказали, что локусы CRISPR эволюционируют в ответ на вирусные атаки, так что состав и порядок расположения спейсеров — это своебразная хроника вирусных инфекций, перенесенных данной бактерией и ее предками. Итак, взаимодействие с вирусами приводит к появлению иммунитета, который сохраняется в ряде поколений.
В формировании иммунитета участвуют Cas-белки. Без них микроб не может вставлять в свой геном вирусную или плазмидную ДНК в качестве спейсеров. Если в клетку проникает чужеродная ДНК, то Cas-белки перво-наперво распознают ее. Потом они же вырезают участок чужой ДНК и встраивают в локус CRISPR новую рабочую единицу «повтор/спейсер». Обновленная бактериальная хромосома нормально реплицируется и передается по наследству потомкам.
При транскрипции CRISPR формируется цепочка РНК (CRISPR-РНК, или crРНК), которая затем нарезается на короткие кусочки, состоящие из двух половинок палиндромного повтора и заключенного между ними спейсера. Эту нарезку также осуществляют Cas-белки.
В результате получается внушительный набор коротких сгРНК с различными вирусными спейсерами. Среди них и тот, который был счастливо приобретен при недавнем инфицировании. Молекулы crРНК объединяются с некоторыми Cas-белками. Если в клетку снова попадет такой же вирус, то РНК, несущая соответствующий спейсер, узнает комплементарный участок вирусной ДНК, а Сas-белки обезвредят ее. Узнавание чужой ДНК при помощи комплементарной crРНК происходит эффективно и быстро.
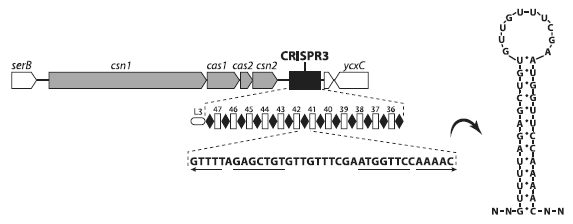
Схема одного из двух локусов Streptococcus thermophilus, содержащих CRISPR и ассоциированные гены cas. Серым цветом показаны cas-гены, черным — CRISPR-последовательности. Под черным прямоугольником вынесена подробная структура CRISPR. Черные ромбики — это палиндромные повторы, а белые маленькие прямоугольники — спейсеры, представляющие собой участки плазмидной или вирусной ДНК. Буквами внизу обозначена нуклеотидная последовательность палиндромного повтора. Справа — «шпилька», петлеобразная структура, в которую сворачивается РНК, считанная с палиндромного повтора. Из Horvath, Barrangou, 2010.
При частых атаках определенного вируса соответствующая рабочая единица «повтор/спейсер» поддерживается в рабочем состоянии в ряде поколений (мутации, повреждающие ее, отсеиваются отбором). Если же паразит больше не нападает, то соответствующая единица «повтор/спейсер» со временем накопит мутации, перестанет работать или исчезнет. Так что CRISPR-иммунитет — это самонастраивающаяся система (Horvath, Barrangou, 2010).
В любой иммунной системе важнейшая проблема состоит в том, чтобы предотвратить атаку защитных молекул на собственный организм. Иммунная система должна отличать свое от чужого, иначе это будет не иммунитет, а самоубийство. Американским ученым из Северо-Западного университета (Эванстон, США) удалось выяснить, как бактерии решают эту задачу. Оказалось, что в узнавании чужеродной ДНК участвуют не только спейсеры, но и ограничивающие спейсер фрагменты палиндромных повторов. Если комплементарным оказывается не только спейсер, но и окружающие его нуклеотиды, то это «родная» ДНК, и иммунной атаки не происходит. Если же спейсер комплементарен проверяемой последовательности, а фрагменты повторов — нет, то это чужой геном, и тогда белки Cas избавляются от паразитической ДНК (Marraffini, Sontheimer, 2010).
Итак, система CRISPR позволяет микробам напрямую вносить полезные изменения в свой геном, не прибегая к помощи случайных мутаций и отбора. Своеобразный (и, по-видимому, совершенно уникальный) способ быстрого создания полезных наследственных признаков! Но сама эта замечательная система, конечно, развилась более традиционным способом. Ее происхождение пока не выяснено в деталях, однако прослеживается преемственность между ней и системой РНК-интерференции, о которой рассказано выше (Deltcheva et al., 2011).
| <<< Назад Горький привкус победы, или Как дрожжи заплатили за успех |
Вперед >>> Бактериальные гены помогли нематодам стать паразитами |
- Изменения белок-кодирующих генов
- Изменения регуляции генов
- Дупликация генов
- Секретный код позвоночных выдал ланцетник
- Откуда взялся новый фермент?
- Обоняние и цветное зрение развивались в противофазе
- Новые белки из старого конструктора
- Горизонтальный перенос генов и симбиоз
- Горький привкус победы, или Как дрожжи заплатили за успех
- Бактерии наследуют приобретенный иммунитет
- Бактериальные гены помогли нематодам стать паразитами
- Сельскохозяйственные симбиозы
- Врожденный иммунитет
- 4. Особенности противовирусного иммунитета
- 18. Предмет иммунологии. Виды иммунитета
- Могут ли бактерии конъюгировать?
- Свет убивает бактерии
- ЛЕКЦИЯ № 19. Грамотрицательные бактерии – возбудители гнойно-воспалительных заболеваний
- Бактерии, открытые Виноградским
- 11. Культивирование вирусов. Противовирусный иммунитет
- 1. Бактерии
- Бактерии и наше меню
- 2. Бактерии в почве
- Бактерии под микроскопом
