Книга: Эволюция. Классические идеи в свете новых открытий
Новые белки из старого конструктора
| <<< Назад Обоняние и цветное зрение развивались в противофазе |
Вперед >>> Горизонтальный перенос генов и симбиоз |
Новые белки из старого конструктора
Большинство белковых молекул состоит из нескольких функциональных блоков (доменов). Например, белки, участвующие в передаче сигналов, часто содержат домены двух типов — регуляторные и каталитические. Первые реагируют на поступающие сигналы и определяют условия, при которых белок-передатчик «сработает». Вторые передают сигнал следующему участнику каскада (например, присоединяют фосфатную группу к другому белку, переводя его в активное состояние). Каждый такой белок действует как оператор условного перехода «если… то», причем регуляторный домен отвечает за «если», а каталитический — за «то».
Ученые давно предполагали, что перетасовка фрагментов белковых молекул может быть важным источником эволюционных новшеств (Ратнер, 1993). На это указывают данные сравнительной генетики, а недавно начали появляться и прямые экспериментальные подтверждения. Одно из них получили биологи из Калифорнийского университета в Сан-Франциско, взявшись изучать сигнальный каскад, регулирующий половое поведение дрожжей (Peisajovich et al., 2010).
Дрожжи, как уже говорилось в главе 3, делятся на два «пола»: а и ?. Эксперименты проводились с полом а. Сигналом к спариванию для этих клеток служит альфа-фактор — феромон, выделяемый полом ? (см. рисунок). Феромон взаимодействует с рецептором Ste2, который находится на поверхности клетки а. В результате комплекс из трех белков, прикрепленный к рецептору с внутренней стороны мембраны, распадается. Освободившийся белок Ste4 взаимодействует с белком Ste5, в результате чего Ste5 с прикрепленными к нему протеинкиназами[75] Ste11, Ste7 и Fus3 транспортируется к клеточной мембране. Здесь благодаря посредничеству белка Ste50 устанавливается связь между Ste11 и Cdc42. Последний белок входит в состав комплекса из трех белков, один из которых — киназа Ste20 — активирует белок Ste11, прикрепляя к нему фосфатную группу. Ste11 в свою очередь фосфорилирует киназу Ste7, а она активирует киназу Fus3. Активированный белок Fus3 отправляется в ядро, где он активирует несколько транскрипционных факторов, которые в свою очередь включают комплекс генов, необходимых для спаривания. В клетке приостанавливаются процессы, связанные с ростом и делением, меняется морфология клетки, и кончается все тем, что клетка а сливается со своим половым партнером — клеткой ?.
Эксперименты проводились с 11 белками, которые на рисунке обозначены серыми овалами. Шесть из них состоят более чем из одного домена. Гены многодоменных белков разрезали на части, а фрагменты перекомбинировались случайным образом. В итоге были получены гены 66 новых белков. Эти гены затем поодиночке вставляли в дрожжевые клетки. При этом исходный сигнальный каскад оставляли без изменений, лишь добавляя к нему новых потенциальных участников. Все искусственные гены были соединены с одним и тем же регуляторным участком (промотором), что обеспечивало одинаковый (невысокий) уровень активности внедренных генов.
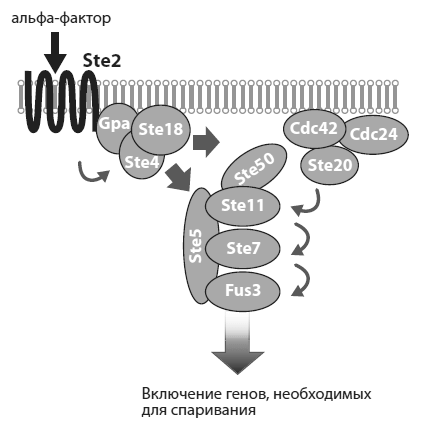
Схема сигнального каскада, запускающего программу «брачного поведения» у дрожжей. Из Peisajovich et al., 2010.
Чтобы оценить эффективность работы сигнального каскада у 66 генно-модифицированных штаммов дрожжей, в их геномы был добавлен ген зеленого флуоресцирующего белка, соединенный с промотором, который реагирует на один из транскрипционных факторов, активируемых белком Fus3. В результате по силе свечения можно было определить силу реакции сигнального каскада на добавление в среду альфа-фактора. Регистрировались два параметра: «базовая» сила свечения, которая наблюдается до добавления альфа-фактора, и скорость, с которой свечение усиливается после добавления феромона.
Оказалось, что в десяти случаях из 66 добавление нового белка изменило поведение сигнального каскада. У одних штаммов изменился базовый уровень активности, у других — интенсивность реакции на феромон.
Но эти изменения теоретически могли быть вызваны не перекомбинированием доменов в добавленном белке, а просто тем, что какого-то домена в клетке стало больше. Чтобы исключить эту возможность, провели контрольные эксперименты. В клетки вставляли дополнительные копии целых генов и их усеченных, но работающих вариантов (кодирующих только один из доменов многодоменного белка). Эти манипуляции, однако, не повлияли на работу сигнального каскада. Значит, полученные в эксперименте новые признаки связаны именно с новыми свойствами белков, образованных путем перекомбинирования доменов.
Приводит ли более интенсивная работа сигнального каскада к реальному повышению половой активности? Чтобы это выяснить, исследователи смешивали модифицированные дрожжи с дикими дрожжами другого пола (альфа) и подсчитывали число успешных слияний. Оказалось, что те клетки, у которых скорость реагирования каскада на феромон увеличилась, действительно спариваются чаще, чем контрольные, и наоборот — те клетки, у которых чувствительность каскада снизилась, спариваются реже.
Рекордсменами оказались дрожжи с искусственным белком, состоящим из половинок Ste50 и Ste7, и с другим химерным белком, собранным из фрагментов Ste5 и Ste11. Эти «половые гиганты» спаривались втрое чаще, чем контрольные исходные дрожжи.
Для некоторых случаев удалось расшифровать молекулярные механизмы возникших изменений. Например, белок, собранный из регуляторного домена Ste5 и каталитического домена Ste11, создал новый «обходной» путь передачи сигнала от рецептора Ste2 к Fus3. Это заставляет клетку интенсивнее реагировать на феромон, что повышает вероятность спаривания.
Может ли повышение половой активности дрожжей, наблюдавшееся в эксперименте, быть полезным? Будет ли оно поддержано отбором, если такая мутация возникнет в природной популяции? Судя по тому, что мы знаем о действии отбора на склонность к сексу (см. главу 3), это возможно, особенно в неблагоприятных и переменчивых условиях. В эксперименте повышение половой активности ничуть не повредило здоровью подопытных клеток.
Такие исследования показывают, что перекомбинирование доменов может быть важным источником эволюционных новшеств — наряду с другими «крупномасштабными» мутациями, такими как дупликация генов и появление новых регуляторных участков ДНК. Важно, что перекомбинирование может приводить к мгновенному появлению новых признаков, тогда как дупликация генов создает новшества не сразу, а лишь после того, как две копии гена хоть немного «разойдутся» по своим функциям, накопив нуклеотидные замены.
—————
Комбинаторика, поставленная на поток
Большинство генов у эукариот состоит из кодирующих участков — экзонов и некодирующих вставок между ними — интронов. Интроны — потомки мобильных генетических элементов, буйно расплодившихся в геномах ранних эукариот. Экзонно-интронная структура генов облегчает создание новых белков комбинаторным путем, хотя возникла она, конечно, не для этого. Тем не менее, раз уж так получилось и гены эукариот приобрели экзонно-интронную структуру, это открыло перед эволюцией интересные возможности.
Интроны необходимо удалить, прежде чем синтезировать белок на основе инструкций, записанных в гене. Если этого не сделать, интроны начнут транслироваться, и вместо рабочего белка получится ерунда. Для удаления интронов из молекул матричных РНК (мРНК), считанных с гена, развился механизм сплайсинга. Мобильные элементы — предки интронов — сами себя вырезали из мРНК. Это были «самосплайсирующиеся» элементы (такие и сейчас есть у некоторых прокариот). Если бы они этого не делали, зараженный ими геном стал бы нежизнеспособным, а вместе с ним погибли бы и они сами. У древних эукариот функция сплайсинга перешла от интронов к специальным молекулярным машинкам — сплайсосомам. В состав сплайсосом входят молекулы РНК — наследники тех частей древних самосплайсирующихся интронов, которые, собственно, и осуществляли самосплайсинг. Интроны, разумеется, должны содержать (и действительно содержат) в своей последовательности нуклеотидов специальные сигнальные участки, по которым сплайсосома распознает интрон и определяет, где у него конец и где начало — иначе интрон не может быть вырезан.
С универсальной системой вырезания интронов у эукариот появилась возможность изготавливать новые белки путем альтернативного сплайсинга. Так называют ситуацию, когда одна и та же молекула мРНК в зависимости от условий комбинируется (на генетическом жаргоне это звучит как «сплайсируется») по-разному. Например, в клетках печени из конкретной мРНК вырезаются только интроны, а в клетках мозга из нее же вместе с двумя соседними интронами вырезается и расположенный между ними экзон. Получается два разных белка, синтезируемых на основе одного и того же гена.
Недавно выяснилось, что альтернативный сплайсинг чаще всего используется у самых сложных организмов, таких как наземные позвоночные, и особенно млекопитающие. Более того, оказалось, что у приматов — к которым мы имеем честь принадлежать — альтернативный сплайсинг развит в полтора-два раза сильнее, чем у других млекопитающих (Barbosa-Morais et al., 2012).
Именно поэтому у человека и других приматов разнообразие белков намного выше, чем у дрозофилы или червя C. elegans, хотя по числу белок-кодирующих генов все эти животные не так уж сильно отличаются друг от друга. Как мы помним из главы 3, нельзя до бесконечности наращивать количество полезных генов в геноме, потому что это повышает риск генетического вырождения. Так вот, похоже на то, что альтернативный сплайсинг стал для высших животных удобным способом увеличивать разнообразие белков, не повышая числа генов в геноме.
Альтернативный сплайсинг позволяет по-разному комбинировать экзоны одного и того же гена. При этом порядок экзонов не меняется: разница только в том, что одни экзоны могут быть выброшены вместе с интронами, а другие оставлены. В некоторых генах даже возникли целые наборы — «кассеты» альтернативных экзонов, причем в зрелую мРНК после сплайсинга попадает только один экзон из каждой кассеты. Об одном из таких генов (DSCAM) мы рассказали в заключительной главе «Рождения сложности».
Однако альтернативный сплайсинг не позволяет комбинировать экзоны, входящие в состав разных генов. Для этого нужны перестройки уже не на уровне мРНК, а на уровне геномной ДНК: нужны транспозиции, т. е. перемещения фрагментов ДНК из одного места генома в другое. Это не редкость — случайные транспозиции являются одним из классических типов геномных мутаций, а для геномных паразитов — транспозонов это и вовсе стиль жизни. Вопрос в том, играет ли перекомбинирование экзонов в геномной ДНК существенную роль в появлении эволюционных новшеств.
У эукариот есть немало белков, скорее всего, возникших именно этим способом. Интересно, что они крайне неравномерно распределены по эволюционному дереву. Их очень много у животных, причем у всех — от губок до млекопитающих. У других эукариот (растений, грибов и протистов) их намного меньше. Функции большинства таких многодоменных белков животных связаны с поддержанием целостности организма (взаимодействие клеток, формирование тканей, прием и передача сигналов, формирование межклеточной среды и т. п.). Похоже, на ранних этапах эволюции животного царства был своеобразный бум формирования новых генов путем перекомбинирования экзонов (Patthy, 1999).
—————
| <<< Назад Обоняние и цветное зрение развивались в противофазе |
Вперед >>> Горизонтальный перенос генов и симбиоз |
- Изменения белок-кодирующих генов
- Изменения регуляции генов
- Дупликация генов
- Секретный код позвоночных выдал ланцетник
- Откуда взялся новый фермент?
- Обоняние и цветное зрение развивались в противофазе
- Новые белки из старого конструктора
- Горизонтальный перенос генов и симбиоз
- Горький привкус победы, или Как дрожжи заплатили за успех
- Бактерии наследуют приобретенный иммунитет
- Бактериальные гены помогли нематодам стать паразитами
- Сельскохозяйственные симбиозы
- Глава 5 Новые гены, новые признаки
- Новые уточнения
- Новые вопросы, поднятые современными исследованиями
- Как России не растерять существующие экспортные рынки и приобрести новые
- Как разглядеть новые ловушки прогресса
- 2 Новые взаимосвязи Как все человеческие контакты стали более плотными и сложными
- 1 Новый Свет Как новые карты и новые средства связи преобразили мир, в котором мы живем
- Появляются новые термины
- Новые предложения из фрагментов старых текстов
- Глава 5. Новые формы разумных существ, или: ожидание зловещего киборга
- Не только антибиотики: новые способы борьбы с микробами
- Старые привычки, новые открытия
