Книга: Происхождение жизни. От туманности до клетки
Выбор химических элементов
| <<< Назад Химические свойства биомолекул, которые важны для их функции |
Вперед >>> Альтернативная биохимия на тех же элементах |
Выбор химических элементов
Биомолекулы на 99 % состоят из четырех элементов: углерода, водорода, кислорода, азота. Оставшийся процент приходится в основном на фосфор и серу. Какие общие свойства отличают эти элементы?
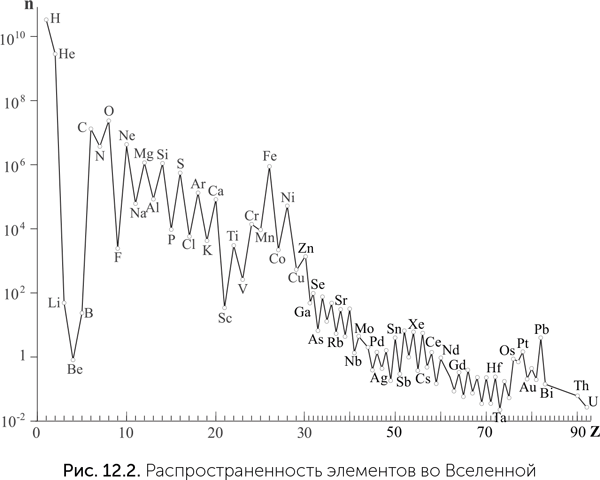
Во-первых, их очень много: все они, кроме фосфора, входят в десятку самых распространенных во Вселенной (рис. 12.2). Во-вторых, все эти элементы отличаются малыми размерами атомов. Размер атома определяется радиусом, на котором находятся самые внешние (валентные) электроны, и сложно зависит от положения атома в таблице Менделеева. В каждом периоде размер атома уменьшается с повышением атомного номера, потому что заряд ядра растет, и притяжение электронов к ядру усиливается. Но при переходе к следующему периоду появляется следующая электронная оболочка, и размер атома увеличивается скачком. C, N, O, P, S занимают правый верхний угол таблицы Менделеева и являются самыми маленькими атомами с валентностью 2 (O), 3 (N), 4 (C), 5 (P) и 6 (S), а водород – самый маленький атом с валентностью 1. В-третьих, все они, кроме водорода, образуют двойные и тройные химические связи. Помимо С, N, O, P и S стабильные двойные связи известны только у хлора, брома, мышьяка и селена.
Молекулы с двойными связями очень важны в биологии. Это азотистые основания (аденин, гуанин, цитозин, урацил), большинство витаминов, гем, хлорофилл и многие другие. Благодаря длинным системам сопряженных двойных связей биомолекулы могут взаимодействовать с видимым светом, обеспечивая окраску и фотосинтез. Кольцевые системы двойных связей в азотистых основаниях обеспечивают их плоскую форму и стэкинг-взаимодействие между соседними основаниями. Стэкинг-взаимодействие облегчает рост цепи при копировании и повышает устойчивость ДНК к ультрафиолету.
Сера и фосфор играют особую роль в биохимии. Их связи с другими атомами менее прочные, чем связи углерода, кислорода и азота. Поэтому фосфор и сера незаменимы в нестабильных промежуточных веществах биохимических реакций, для временного хранения энергии и переноса групп атомов с одних молекул на другие. Энергия, запасенная в фосфоэфирных (P-O-P и P-O-C) связях таких веществ, как АТФ, ацетилфосфат и креатинфосфат, используется для сшивания аминокислот в белки, нуклеотидов – в ДНК и других химических реакций. Сера используется для переноса кислотных групп на коферменте А (ацетил-КоА, сукцинил-КоА и т. д.), при этом энергия, запасенная в тиоэфирной связи (C-S-CO), расходуется на создание новых связей С-С. Другой серосодержащий кофермент, S-аденозил-метионин, аналогично переносит метильные (CH3) группы и тоже участвует в создании новых связей С-С.
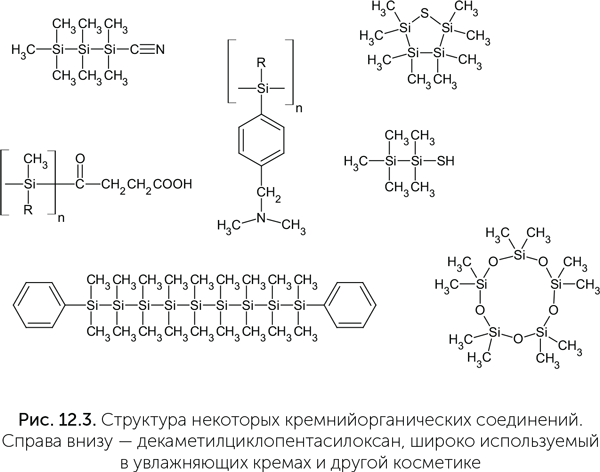
Углерод образует до четырех прочных связей с другими атомами, и из него легко строятся цепочки и разветвленные молекулы. Кремний практически не уступает ему в этом отношении (рис. 12.3). Более того, на поверхности Земли кремния в 150 раз больше, чем углерода, следовательно, доступность углерода не была причиной его выбора для биохимии.
Хотя кремний действительно находится под углеродом в таблице Менделеева и во многом похож на него по свойствам, между ними есть и серьезные различия. Кремний обладает большим атомным радиусом, чем углерод, и поэтому прочность связи Si-Si вдвое меньше, чем связи C–C, а Si-H– меньше, чем C-H. Углерод легко образует двойные связи, в которых расстояние между атомами меньше, чем в обычных.
Кремний из-за большего размера атома практически не способен участвовать в двойных связях. В оксиде углерода CO2 углерод связан двойными связями с двумя атомами кислорода, и при обычных условиях СО2 – газ. В оксиде кремния SiO2 каждый атом Si связан одинарными связями с четырьмя атомами кислорода, каждый из которых образует мостик между двумя атомами кремния. Поэтому SiO2 образует твердые тугоплавкие кристаллы, например кварц.
Многие соединения кремния более химически активны, чем их аналоги с углеродом. Если метан (СН4) не реагирует с водой ни в обычных условиях, ни при сильном нагревании, то силан (SiH4) при комнатной температуре быстро разлагается водой с выделением водорода и кремниевой кислоты:
SiH4 + 3H2O ? 2H2 + H2SiO3.
В подобные реакции вступают и многие другие соединения кремния, где атомы кремния не связаны с кислородом или азотом. Химик сказал бы примерно следующее: «Кремний – элемент третьего периода, поэтому его атом имеет незаполненные 3d-орбитали, которые позволяют ему проявлять электрофильные свойства и легче вступать в реакции с нуклеофилами».
Так что кремний, с одной стороны, образует очень прочные и устойчивые связи с кислородом, которые, в отличие от связей С-С, практически невозможно ослабить, а с другой – большинство других его химических связей неустойчивы в присутствии воды, аммиака и кислот. Поэтому практически в любых известных в космосе условиях кремний находится в виде устойчивых кристаллов оксида кремния и силикатов, иногда – карбидов и нитридов кремния, но не образует тех сложных молекул, которые получены в лаборатории. Углерод же не только на планетах, но и в межзвездных газово-пылевых облаках легко образует разнообразные органические соединения.
Известны и другие элементы, которые образуют сложные и разнообразные молекулы. Например, сосед углерода слева в периодической системе – бор. Его атом имеет три валентных (образующих химические связи) электрона, поэтому с кислородом образует три связи (например, в борной кислоте H3BO3). При этом атом бора не может достроить свою внешнюю электронную оболочку до восьми и образует уникальные дополнительные связи, охватывающие сразу три атома (рис. 12.4, справа).
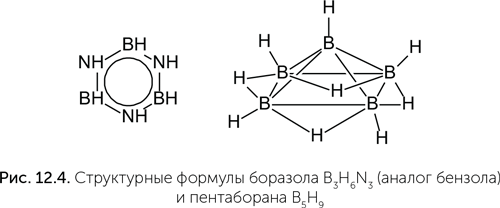
В паре с азотом он может образовать близкие аналоги органических соединений углерода: например, боразол – неорганический аналог бензола. К сожалению, большинство соединений бора химически очень активны и легко реагируют с водой, образуя борную кислоту. Но это не главный недостаток бора. Гораздо хуже то, что во Вселенной его крайне мало, примерно в 1 млн раз меньше, чем углерода. Ядра атомов бора менее устойчивы, чем ядра углерода и гелия, и в звездах бор быстро превращается в гелий и углерод. Те скромные количества бора, которые все же есть, образовались в результате ядерных реакций в газово-пылевых облаках под действием космических лучей. Таким образом, существование жизни на основе бора запрещено ядерной физикой.
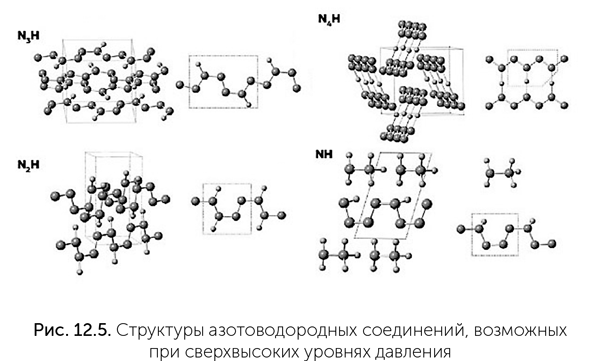
Очень экзотические сложные молекулы могут быть возможны на основе азота при сверхвысоких давлениях. Как предсказано в работах Артема Оганова (профессор Нью-Йоркского университета в Стоуни-Брук и Сколковского института науки и технологий), при давлениях выше 360 000 атмосфер азот может образовывать устойчивые разнообразные цепочки, кольца и плоские слои. Разнообразие азотоводородных молекул в этих условиях не уступает разнообразию углеводородов при обычном давлении (рис. 12.5). К сожалению, это разнообразие известно только по квантово-механическому моделированию поведения атомов и молекул. Проверить эти расчеты экспериментально очень трудно, потому что такие уровни давления достижимы лишь в очень малых объемах на гидравлических прессах с алмазными столами. В природе подобные условия могут существовать в глубинах водно-аммиачно-метановых океанов Урана и Нептуна.
Много шума вызвала публикация, сообщавшая о бактерии, которая заменила часть фосфора в своих клетках на мышьяк (Wolfe-Simon et al., 2010). Однако более тщательные исследования опровергли этот результат. Как оказалось, это просто бактерия, устойчивая к мышьяку, в том числе и внутри клетки. В состав ее ДНК и других веществ входит фосфор, а не мышьяк, как и у всех других земных организмов.
| <<< Назад Химические свойства биомолекул, которые важны для их функции |
Вперед >>> Альтернативная биохимия на тех же элементах |
- Определение жизни
- Химические свойства биомолекул, которые важны для их функции
- Выбор химических элементов
- Альтернативная биохимия на тех же элементах
- Альтернативные варианты биохимии на древней Земле. Ксенонуклеиновые кислоты
- Треозонуклеиновые и гликоленуклеиновые кислоты
- Пептидо-нуклеиновые кислоты
- Жизнь без полимеров
- § 48 Строение атома и свойства химических элементов
- § 47 Периодический закон и периодическая система химических элементов Д. И. Менделеева
- Глава 8 Биогенная миграция химических элементов и биогеохимические принципы
- 426. Сколько химических элементов содержится в морской воде?
- Образование химических элементов
- Популярная библиотека химических элементов. Книга первая. Водород — палладий
- Популярная библиотека химических элементов. Книга вторая. Серебро — нильсборий
- 7.28. ФАУНА И ФЛОРА — «КОПИЛКИ» ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
- Нет почвы без живого
- Живое и минеральное вещество
- 2.2. Факторы рисков опасных воздействий взрывов
- Химия и микроорганизмы
