Книга: Происхождение жизни. От туманности до клетки
Вирусная теория происхождения ядра и полового размножения
| <<< Назад Роль вирусов в происхождении эукариот |
Вперед >>> Дальнейшая эволюция эукариот |
Вирусная теория происхождения ядра и полового размножения
К крупным ДНК-вирусам (LNCDV, Large Nucleo-Cytoplasmic DNA Viruses) относятся, например, поксвирусы (из них широко известен возбудитель оспы), мимивирусы (недавно открытая группа гигантских вирусов-паразитов амеб) и фикоднавирусы, поражающие водоросли. Они имеют крупную и сложную вирусную частицу, покрытую несколькими мембранами. Самая внешняя мембрана сливается с наружной мембраной клетки при заражении, и в цитоплазму попадает вирус, окруженный двумя внутренними мембранами. Эти мембраны местами сливаются между собой, образуя некое подобие ядерных пор. Они выстланы изнутри белками капсида (вирусной оболочки), аналогичными белкам ядерной оболочки. В такой форме вирус долго существует в цитоплазме, в нем происходят транскрипция, кэпирование и полиаденилирование РНК, экспорт зрелых РНК в цитоплазму через поры вирусной частицы. Вирусы оспы раньше называли «мини-ядрами», а вирион мимивируса по размеру почти не уступает ядру клетки-хозяина.
Сходство крупных ДНК-вирусов с ядром эукариот наблюдается по многим признакам:
• генетический материал ограничен двумя липидными мембранами с белковым каркасом между ними;
• транскрипция и трансляция разделены в пространстве (транскрипция идет внутри вируса, трансляция – в цитоплазме клетки-хозяина);
• мРНК активно экспортируется через поры в мембранной оболочке;
• геном состоит из линейных молекул ДНК с тандемными повторами на концах;
• расхождение дочерних молекул ДНК при делении может сопровождаться исчезновением оболочки.
Геном таких вирусов представлен линейной двухцепочечной ДНК длиной до 200 000 пар нуклеотидов у поксвирусов и более 1 млн – у мимивирусов, что сравнимо с размером самых малых бактериальных геномов. Открытые в 2013 году пандоравирусы имеют геном размером до 2,5 млн пар нуклеотидов, что соответствует среднему геному свободноживущей бактерии. Для репликации ДНК эти вирусы разбирают вирусную частицу (она называется «вирион»). По мере накопления вирусной ДНК в цитоплазме клетки собираются новые вирионы, которые окружаются впячиваниями эндоплазматического ретикулума и плазматической мембраны. Кэпирование, полиаденилирование, а часто и подготовка дезоксирибонуклеотидов при размножении этих вирусов осуществляют их собственные ферменты, без участия клеточных белков.
По предложенному Беллом сценарию вирус, ставший предком ядра, паразитировал на метаногенной архее с клетками разветвленной формы, не имевшей клеточной стенки (Bell, 2006). Такие археи есть и сейчас, например, Methanoplasma elizabethii; разветвленная форма позволяет им плотнее контактировать с выделяющими водород бактериями-ацетогенами. Как и у многих современных крупных ДНК-вирусов, зрелые частицы этого вируса были покрыты тремя мембранами. Внешняя из трех мембран сливалась с наружной мембраной заражаемой клетки, а две внутренние имели поры, пропускавшие РНК и другие молекулы из вируса в цитоплазму клетки и обратно. Такие оболочки современных вирусов строятся из мембран эндоплазматического ретикулума клетки-хозяина, а у археи, не имевшей внутренних мембран, для их построения использовалась внешняя мембрана клетки. От мембраны клетки-хозяина «отшнуровывались» круглые пузырьки, которые затем складывались в двухслойное полушарие, окружали новые копии вирусной ДНК и выходили из клетки, покрываясь при этом третьей мембраной (рис. 18.14). Подобным образом одеваются мембранами частицы бактериофага PRD1, и в его случае все манипуляции с мембранами производят только вирусные белки.
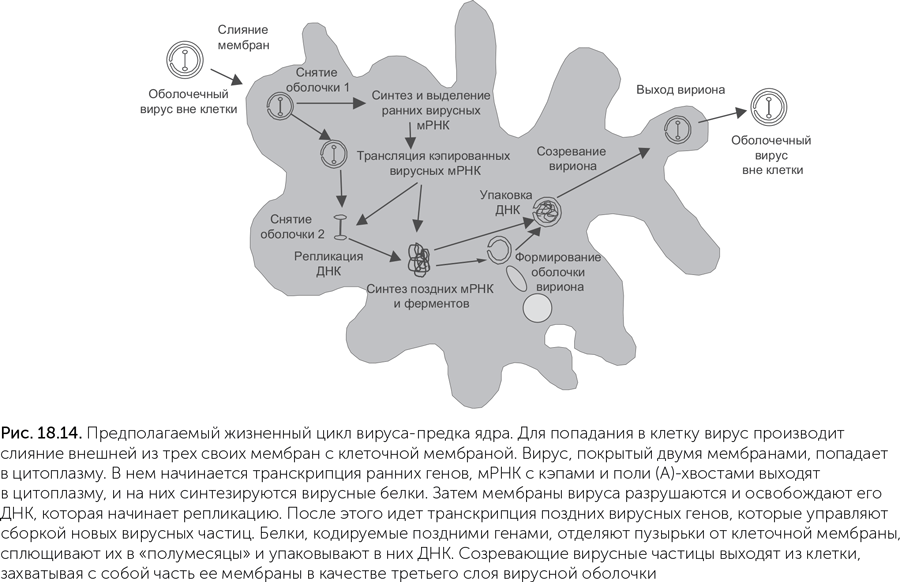
Ключевым моментом превращения вируса в ядро должен был стать, как мы уже упоминали, переход такого вируса в лизогенное состояние. Многие вирусы способны переключаться между литическим жизненным циклом (быстрое размножение с гибелью клеток хозяина) и лизогенным существованием – скрытой инфекцией, практически не влияющей на жизнеспособность хозяина. Лизогенное состояние достигается двумя способами: можно вставить свой геном в геном хозяина и пользоваться хозяйскими системами репликации или же, переключив активность вирусных генов, постоянно существовать в цитоплазме. В этом случае вирус временно превращается в плазмиду – автономную молекулу ДНК. Он тоже может пользоваться хозяйской системой репликации, но ему нужны собственные механизмы контроля количества копий. Если он будет отставать в репликации от генома хозяина, то деления хозяина будут часто порождать незараженные клетки, а если репликация вируса будет слишком активной, то он будет снижать жизнеспособность хозяина.
Большинство лизогенных бактериофагов и крупные плазмиды поддерживают минимальное число своих копий и используют специальную систему разделения копий по дочерним клеткам, похожую на ту, которая разделяет хромосомы в клетках современных эукариот. Эта система обычно включает в себя белок, способный собираться в нити, специальные участки ДНК (центромеры) и второй белок, связывающий центромеры с нитями первого белка. Центромеры – это части молекулы ДНК (хромосомы или плазмиды), которые не содержат генов и состоят из многочисленных коротких повторов. К ним прикрепляются нити веретена деления и через них же соединяются сестринские хромосомы до того, как разойтись по разным клеткам. В расхождении хромосом при делении клеток животных, которое описано во вставке в начале этой главы, веретено деления имеет два центра организации на полюсах, и хромосомы растаскиваются к этим полюсам. Гораздо более простые системы разделения копий плазмид имеют один центр организации веретена – соединенные центромеры двух копий плазмиды. Короткие нити веретена прикрепляются одним концом к одной копии плазмиды, другим – к другой. Удлинение нитей толкает две копии плазмиды в разные стороны. У ряда одноклеточных эукариот (эвглены, динофлагелляты и др.) при митозе ядерная оболочка сохраняется, веретено деления образуется внутри ядра, а механизм движения хромосом похож на таковой у плазмид.
У некоторых плазмид, например R1, белок нитей похож на актин, у других встречаются родственники тубулина. Плазмиды, не способные образовывать вирусные частицы, имеют другой путь заражения новых клеток – конъюгацию, т. е. образование специальных контактов между бактериальными клетками, по которым передается плазмидная ДНК.
И плазмиды, использующие конъюгацию, и лизогенные вирусы обычно способны отличить уже зараженные их собратьями клетки от «чистых», чтобы предотвратить бесполезное повторное заражение. Такое распознавание работает только в пределах близких видов вирусов, поэтому клетка может быть заражена одновременно несколькими разными лизогенными вирусами. Однако стабильная лизогенная инфекция несколькими вирусами требует, чтобы они использовали разные, несовместимые системы разделения копий по дочерним клеткам, иначе первое же деление клетки разносит разные лизогены по разным линиям потомков.
Лизогенные вирусы, такие как N15, и плазмиды, как R1, уже имеют цикл размножения, напоминающий митоз эукариот: они реплицируются один раз, после чего две копии остаются связанными в центромерном регионе. Дальнейшая репликация блокируется до тех пор, пока полимеризация нитей не растащит две копии далеко друг от друга. Гигантский вирус – предок ядра, в отличие от N15 и R1, имел оболочку вириона. Поэтому ему приходилось разбирать оболочку на время репликации и деления и восстанавливать ее для транскрипции генов, что еще ближе к митозу.
Следующим шагом от вируса к ядру стала потеря литического пути размножения, т. е. выхода новых вирусных частиц с гибелью хозяина. Вирус оказался «в одной лодке» с хозяином, и теперь требовалось, во-первых, по возможности снизить вред, наносимый хозяину, а во-вторых, создать механизм конъюгации для заражения новых хозяев. Второе было очень просто, так как вирус уже обладал белками, вызывающими слияние мембран. Достаточно было перенести их с оболочки вириона на клеточную мембрану, чтобы получить возможность слияния клеток зараженного хозяина с незараженным. Этот же белок на внешней мембране улучшил способности хозяина к фагоцитозу за счет слияния двух его собственных ложноножек вокруг добычи. На этой стадии использование кэпов и eIF4E для подавления трансляции генов хозяина стало опасным, и многие жизненно важные гены хозяина были перенесены в геном вируса под его управление. Современные мимивирусы содержат сотни генов, недавно перенесенных из генома хозяина, так что сценарий не выглядит нереальным. Затем кэпы пригодились для того, чтобы ограничить и поставить под контроль транскрипцию огромного количества генов, проникавших в цитоплазму из перевариваемых клеток с переходом к фагоцитозу. Поглощенные чужеродные ДНК могли транскрибироваться в цитоплазме, но получаемые при этом мРНК не имели кэпов и не узнавались рибосомами протоэукариотной клетки, оснащенными белком eIF4E. Необходимые митохондриальные гены переносились в ядро под контроль его систем регуляции. В итоге кольцевой геном архейного предка исчез совсем, а митохондриальные геномы сократились до считаных десятков генов.
Происхождение мейоза и полового размножения требует взаимодействия между разными штаммами такого лизогенного вируса. Два штамма, достаточно разных, чтобы опознавать друг друга как «чужих», но еще с одинаковой системой сегрегации, могли вызывать слияние мембран своих клеток с последующей репликацией обоих вирусных геномов. Однотипные центромеры и центромер-связывающие белки приводили к тому, что все четыре генома оказывались склеенными вместе по центромерам. Рекомбинационные белки, необходимые для достройки концов линейной вирусной ДНК, могли в этот момент вызывать рекомбинации между геномами разных штаммов, аналогичные кроссинговеру. Деление хозяйской клетки приводило к разделению вирусных геномов по два в каждую дочернюю клетку, они оставались связанными по центромере и не реплицировались. Второе деление клетки-хозяина окончательно разделяло вирусные геномы и разрешало их репликацию. Естественный отбор мог закрепить такое поведение, потому что рекомбинация между двумя вирусными геномами в одной клетке позволяет им избавиться от вредных мутаций. Нечто подобное показано для вирусов с ультрафиолетовыми повреждениями после дезинфекции: при заражении одной клетки несколькими поврежденными вирусами одного вида из их геномов собирается один работоспособный, и происходит его успешное размножение (Barry, 1961).
Итак, вирусная теория происхождения ядра лучше других объясняет такие особенности эукариот, как кэпирование мРНК, отсутствие оперонов и митоз. Она объясняет также происхождение систем слияния мембран и отшнуровки мембранных пузырьков. Серьезными доказательствами в ее пользу могут стать:
• обнаружение среди вирусов архей близких родственников крупных ДНК-вирусов эукариот;
• обнаружение у архейных вирусов системы кэпов;
• находка родственных белков мейоза у вирусов.
К сожалению, архейные вирусы пока изучены очень слабо.
Участие вируса в симбиозе, давшем начало эукариотам, снимает многие проблемы взаимодействия архейного и бактериального геномов в одной клетке и защиты от попадания чужеродной ДНК при фагоцитозе. Вирусы, и особенно крупные ДНК-вирусы, обладают изощренными механизмами для манипуляции чужими генетическими системами. Благодаря транскрипции внутри вирусной частицы и наличию кэпов матричных РНК вирус мог поддерживать функционирование зараженной клетки, несмотря на мощный поток чужих генов из фагоцитированных бактерий.
К сожалению, мы не знаем, как примирить вирусную теорию с другими версиями происхождения ядра. В рамках вирусной теории, например, с одной стороны, трудно объяснить, почему синтез инозитол-фосфатов происходит в ядре, или связь митохондрий с ЭР. С другой стороны, кэпы матричных РНК, распад оперонов и происхождение новых ДНК-полимераз трудно объяснить без участия вирусов. Скорее всего, со временем будет создан сценарий появления эукариот, который объединит сильные стороны этих теорий.
| <<< Назад Роль вирусов в происхождении эукариот |
Вперед >>> Дальнейшая эволюция эукариот |
- Клетки с ядром – новый уровень сложности жизни
- Химерное происхождение эукариот
- Другие возможные источники генов эукариот
- Архейный предок эукариот
- Причины и механизмы появления эукариот
- Гипотезы о происхождении ядра
- Роль вирусов в происхождении эукариот
- Вирусная теория происхождения ядра и полового размножения
- Дальнейшая эволюция эукариот
- 17. Гипотезы происхождения человека
- Новая история происхождения жизни на Земле
- Глава 1 Два пола – идеальная комбинация для совершенного размножения
- Чувство юмора и щедрость — результаты полового отбора?
- § 49. Формы размножения организмов
- Экваториальный пояс лесов и причины его происхождения
- 4.17. Гипотезы происхождения человека
- Долгожительство зависит от размера, размножения и еды
- 3.2. Воспроизведение организмов, его значение. Способы размножения, сходство и отличие полового и бесполого размножения....
- Глава 1. История происхождения человечества
- Величайшая загадка происхождения жизни
- Конкурирующие концепции происхождения и эволюции вирусов
