Книга: Три тайны жизни
Белки — основа жизни
| <<< Назад Клетка — элементарная основа организмов |
Вперед >>> Нуклеиновые кислоты |
Белки — основа жизни
О значении белка писал еще Ф. Энгельс: «Жизнь есть способ существования белковых тел… Повсюду, где мы встречали жизнь, мы находили, что она связана с каким-либо белковым телом, и повсюду, где мы встречаем какое-либо белковое тело, которое не находится в процессе разложения, мы без исключения встречаем и явления жизни»[7].
Белки в организме выполняют самые различные функции. Они составляют около половины всех органических веществ, содержащихся в протоплазме клеток. Поэтому белки являются основным строительным веществом в клетке. Они постоянно самообновляются. Это было установлено методом меченых аминокислот. Например, у человека половина белков всех тканей распадается и строится заново в среднем в течение восьмидесяти дней. Некоторые белки замещаются быстрее, другие медленнее. Так, белки печени и сыворотки крови обновляются наполовину каждые десять дней, белки мышц замещаются наполовину каждые сто восемьдесят дней.
Самообновление веществ в организме осуществляется с помощью ферментов, или энзимов, которые тоже являются белками. И. П. Павлов называл ферменты возбудителями жизни, так как они ускоряют многочисленные реакции, лежащие в основе обмена веществ в организме.
Каждый из ферментов способен ускорять только одно строго определенное химическое превращение. В протоплазме клеток содержатся сотни разнообразных ферментов.
Характерной чертой ферментов является то, что, возбуждая определенную химическую реакцию, они вступают лишь в кратковременную связь с реагирующими веществами и не входят в конечные продукты реакции. Поэтому небольшое количество молекул фермента может за короткое время способствовать вступлению в реакцию большого количества молекул реагирующего вещества. Так, один грамм фермента пепсина за два часа перерабатывает двадцать пять килограммов яичного альбумина.
Очень важная роль белков заключается и в том, что они являются переносчиками веществ в организме. Как известно, гемоглобин крови, например, доставляет кислород в клетки животных и человека, не подвергая его химическим изменениям.
Следующая функция белков — это механо-химическая, или двигательная. В ней участвуют специализированные белки, образуя различные сократительные системы, мышечные волокна и ткани. Такие белки участвуют в движении протоплазмы внутри клетки, а во время деления клетки нити ахроматинового веретена, сокращаясь, перетягивают хромосомы к полюсам делящейся клетки. Кроме того, многие одноклеточные и некоторые ткани многоклеточных организмов имеют специальные цитоплазматические образования — жгутики и реснички, которые тоже постоянно находятся в движении.
Белки стоят на страже здоровья организма. Если в организм животного или человека каким-либо путем попали чужеродные белки (чаще всего ими бывают ядовитые белковые вещества — токсины, выделенные болезнетворными бактериями), то в крови организма-хозяина вырабатываются особые белки — антитела, которые тут же вступают в бой с белками-чужаками до полной победы над пришельцами. После перенесения многих инфекционных болезней в организме вырабатываются защитные антитела. И до тех пор, пока у выздоровевшего сохранится способность к образованию данных антител, этой болезнью он вторично не болеет, то есть вырабатывается иммунитет. Эта физиологическая функция белка является активной.
Но белки животных выполняют еще и пассивную охранную функцию. Так, они входят в состав целого ряда защитных покровных тканей — керотина, элостина, феброина и др.
Белки принимают непосредственное участие в росте и развитии организма. Эти процессы осуществляются с помощью гормонов, многие из которых имеют белковую природу. Гормоны выделяются в кровь железами внутренней секреции. Они наряду с нервной системой управляют работой различных органов, передавая химические сигналы. Таким образом, белкам в любом организме принадлежит очень широкая «исполнительная власть».
Чем же объясняется такое многообразие биологических функций белков?
Ответ на этот вопрос можно найти в изучении самой природы белковых молекул. Многолетние кропотливые исследования показали, что в состав белковых молекул входят относительно простые вещества — аминокислоты, которые являются своеобразными «кирпичиками» этого сложного соединения. В настоящее время в различных белках живых организмов мы знаем около ста аминокислот, из которых двадцать являются важнейшими, незаменимыми аминокислотами, без коих организм не может существовать.
Аминокислоты являются как бы «двуликими» органическими соединениями: они проявляют в реакциях свойства как кислоты, так и основания за счет содержания аминогруппы NH2 и кислотных (карбоксильных) групп СООН. Все аминокислоты имеют сходное в принципе химическое строение:
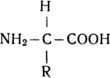
Различия их в основном заключаются в радикалах (R), которые тоже представляют собой сложные группы атомов.
В качестве примера приведем структурные формулы трех аминокислот, широко распространенных в различных белках: глицина, аланина и треонина.
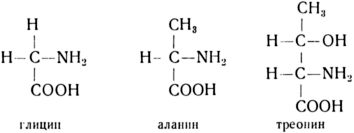
Аминокислоты соединяются между собой и образуют длинную пептидную цепочку, которая является первичной структурой белковой молекулы. Она определяет последовательность аминокислот в молекулах белков: a1 — а2 — а3… аn, где a1 означает какую-либо вполне определенную аминокислоту (например, аланин или серин), а2 — иную (а может быть, и ту же самую), но тоже вполне определенную аминокислоту (скажем, глицин) и т. д.
Молекулы белков состоят из нескольких пептидных цепей, способных сворачиваться в спирали и клубки, характерные уже для живой материи.
Главным различием молекул белков служит последовательность расположения в них аминокислот. Например: в одном белке в качестве первого мономера a1 фигурирует аминокислота серин, а в молекуле другого белка вместо серина в качестве первого мономера выступает, положим, фенилаланин, в качестве а2 — скажем, аргинин, а не лизин и т. д. Достаточно отличия хотя бы в одном номере, чтобы белок стал другим. Разумеется, белки могут различаться между собой и по общему числу мономеров в цепочке.
Выявление действительной последовательности расположения аминокислот в цепочке белковой молекулы (его первичной структуры) — одна из самых сложных задач современной биологии. Расшифровка строения белков дает возможность судить о различиях живых организмов на молекулярном уровне. Но что еще важнее — искусственно создавать белки для пищевых, кормовых и лечебных целей. Систематическое изучение последовательности аминокислотных остатков в полипептидных цепях было начато около десяти лет назад. Сейчас полностью воспроизведено строение рибонуклеазы — белка, построенного из ста двадцати четырех аминокислотных остатков, связанных между собой в форме общей полипептидной цепи[8].
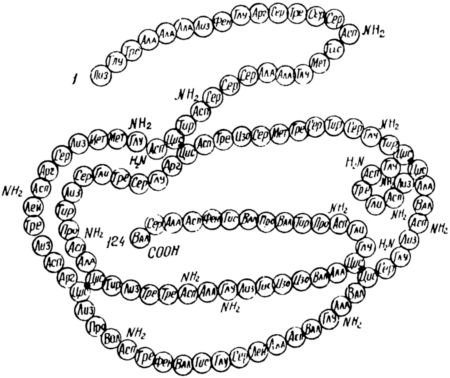
Большим достижением является полная расшифровка последовательности аминокислот в белке вируса табачной мозаики, состоящей из ста пятидесяти семи аминокислотных остатков. Недавно закончилась многолетняя работа по установлению последовательности аминокислот в белке лизоциме, содержащемся в слезах и яичном желтке. Установлено, что белковая цепь лизоцима построена из ста двадцати шести аминокислотных остатков.
В последние годы расшифровано строение ряда белковых гормонов со сравнительно простой молекулой, как, например, инсулина — гормона поджелудочной железы, недостаток которого порождает сахарную болезнь. Изучено строение гормона задней доли гипофиза — окситоцина и вазопрессина.
Современными методами рентгено-структурного анализа с использованием электронных вычислительных машин установлена общая форма молекулы белка. Она такова: цепочка аминокислот закручивается в спираль, витки которой очень близко примыкают друг к другу. В отдельных местах атомы спирали притягиваются между собой. Устойчивое спиральное строение называется вторичной структурой белка. Спираль белковой молекулы сворачивается в своего рода клубок и образует третичную структуру, которая всегда постоянна (специфична) для каждого данного белка.
В некоторых случаях молекулы белков присоединяют и другие молекулы и образуют еще более сложную, четвертичную, структуру.
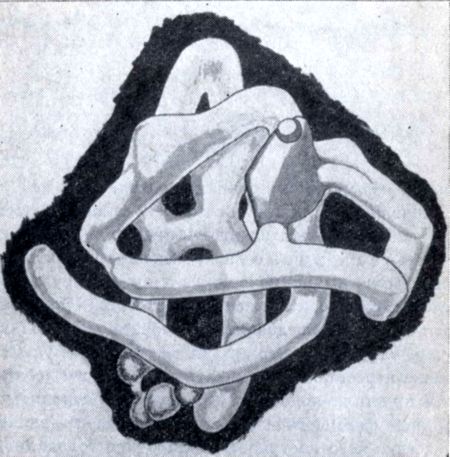
Строение молекулы простого белка миоглобина (третичная структура).
Если заменить хотя бы в одном месте белковой цепочки одну аминокислоту на другую, может произойти изменение свойств белка. Так, в ряде районов Африки и Средиземноморья, а также в странах Юго-Восточной Азии существует тяжелое наследственное заболевание крови — серповидноклеточная анемия. При ней красные кровяные шарики имеют форму серпов. В гемоглобине таких больных электрически заряженная глутаминовая кислота заменена на электрически нейтральную аминокислоту валин. В результате гемоглобин сильно изменяет свои свойства. Эритроциты крови с таким гемоглобином приобретают серповидную форму. Утратив электрический заряд, молекулы гемоглобина перестают отталкивать друг друга и «слипаются» в кристаллоподобные структуры. Эритроциты серповидной формы гораздо хуже переносят кислород, вследствие чего наступает кислородное голодание. Дети с этим врожденным недугом обычно не доживают и до двух лет.
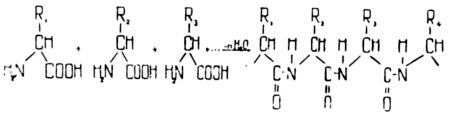
Образование цепи в белковой молекуле из отдельных аминокислот.
Создание искусственных белков является важнейшей проблемой современной науки. На пути искусственного синтеза белка перед учеными встали огромные препятствия. Чтобы соединить между собой две аминокислоты, надо преодолеть массу трудностей. Каждая аминокислота, как уже было сказано, имеет два химических лица: карбоксильную кислую группу на одном конце и аминную основную группу на другом. Если от карбоксильной группы одной аминокислоты отнять группу ОН, а от аминной группы другой — атом водорода, то образуется при этом простейший из пептидов — дипептид и отщепляется молекула воды. Повторяя эту операцию, можно наращивать количество аминокислот и длину белковой цепочки. Однако эта на первый взгляд несложная операция практически бывает очень трудно осуществимой: аминокислоты весьма неохотно соединяются друг с другом. Приходится их активировать химически и подогревать.
Вторая сложность заключается в том, что соединяться друг с другом могут не только остатки различных аминокислот, но и две молекулы одной кислоты. При этом строение синтезируемого пептида будет уже отличаться от желаемого. Более того, каждая аминокислота может иметь не две, а несколько боковых химически активных групп (радикалов), способных присоединять аминокислотные остатки.
Чтобы не дать реакции свернуть с заданного пути, необходимо закрыть на время осуществления реакции все реактивноспособные группировки аминокислот, кроме одной, присоединив к ней так называемые защитные группировки. Если этого не сделать, то цепь будет расти не только с обоих концов, но и в бок и аминокислоты уже не удастся соединить в заданной последовательности. А это значит, что не получится белковая молекула с определенными свойствами. Ученые нашли выход из положения: стали применять вещества, защищающие боковые реактивноспособные группировки от нежелательных реакций. Но существующие методы еще далеко не совершенны. Чтобы получить инсулин, необходимый больным диабетом, состоящий из пятидесяти одной аминокислоты, химикам потребовалось около трех лет напряженной работы, при этом было произведено двести двадцать три реакции, а желаемого вещества они получили лишь сотую долю процента. Но упорный труд ученых увенчался уже некоторым успехом. Большие достижения на пути синтеза белка получены советскими учеными.
Искусственное получение белка имеет первостепенное значение в проблеме создания синтетической белковой пищи для человечества и сельскохозяйственных животных. Это даст возможность получения всех необходимых при составлении пищевых рационов аминокислот, более дешевых, чем естественные белки.
Нужный белок можно получить с помощью живых организмов. Это один из более доступных способов синтеза необходимых белков. Неоценимую услугу в разрешении этой проблемы оказали одноклеточные организмы. В настоящее время уже начато промышленное получение белков микробиологическим путем. Все микроорганизмы имеют белковую плазму, и многие из них можно употреблять в пищу. Широко известны кормовые дрожжи, выращиваемые на сахаристых отходах сельского хозяйства. Имеются также многие виды микроорганизмов, развивающихся на углеводородах. Существуют микробы — пожиратели метана, парафинов и т. д. Французский ученый Шампанья предложил выращивать кормовые дрожжи на фракциях нефти и применять полученные таким образом белки в пищевом рационе, в частности в кондитерском производстве.
| <<< Назад Клетка — элементарная основа организмов |
Вперед >>> Нуклеиновые кислоты |
- 1. Муравей и муравейник
- Шмели и термиты
- А.Н. Никитин: «хожение за три моря»
- Что видел рассказчик в глазах Меченого?
- Глава IV Дисгармонии в устройстве пищеварительных органов человека
- Гениальность животных — не просто вымысел
- 63. Почему Плутон больше не рассматривается как планета?
- Сильное взаимодействие
- Открытый космос
- «Мат как пароль!»
- Иоганн Генрих Ламберт (1728–1777)
- Фазовая структура технологического пространства: стелс-технологии
