Книга: Геном человека
РЕМОНТ ГЕНОВ (генная терапия)
| <<< Назад ДНКовый ТЕКСТ ВМЕСТО ОТПЕЧАТКОВ ПАЛЬЦЕВ (генная дактилоскопия) |
Вперед >>> СМЕРТЬ И БЕССМЕРТИЕ — В НАШИХ ГЕНАХ (проблема долголетия) |
РЕМОНТ ГЕНОВ (генная терапия)
Человеческая природа составлена таким образом и допускает такие бесконечно многочисленные модификации, что ее формирование от дьявола до ангела позволяет ожидать появления всех ступеней совершенства.
Итак, генная диагностика «навела на след», показала врачу, с каким конкретным геном связана патология у обследуемого пациента. Хотя этот этап очень важный, но он только первый. Дальше надо приступать к лечению. И если для этого нет соответствующих средств, то правильному диагнозу грош цена. Время, когда болезнь лечили народными средствами, безвозвратно ушло в прошлое (ренессанс всевозможных целителей в России в последние годы говорит лишь об общей смутной экономической и психологической обстановке в стране). Традиционные методы фармакотерапии уже тоже вчерашний день. Современное лекарство — это молекулярная «пуля», которая бьет точно в «мишень», исправляя первопричину нарушений на молекулярном уровне. Такими «пулями» могут служить «здоровые» гены, выделенные из здоровых организмов. В последние годы на базе использования генов в практической медицине появилась совершенно новая технология, сравнимая с процессом ремонта генов, — генная терапия.
Когда клетки потеряли нормальную функцию того или иного гена, для их излечения нужно эту функцию восстановить. Тогда в клетку организма, которая страдает от потери функции, нужно доставить ген, способный компенсировать эту недостающую функцию. Ситуация здесь подобна той, которая возникает при работе компьютеров. Существуют специальные программы, которые позволяют обнаруживать грамматические ошибки в набранном тексте и исправлять их. Суть генной терапии и заключается в исправлении ошибок — искусственном создании необходимых количеств продуктов того или иного плохо работающего гена в организме больного, за счет введения в организм нормального гена, полученного от здоровых пациентов. Но это лишь одно из направлений генной терапии. Другое, не менее важное, связано с тем, что часто болезнь вызывается избыточной функцией некоторых генов, несвойственных нормальной клетке. Это происходит, например, при инфекциях или опухолевых трансформациях. Тогда генному терапевту следует озаботиться тем, чтобы эту излишнюю функцию подавить. Вот эти две стратегии можно считать истинно генно-терапевтическими. Обе они нацелены на коррекцию дефекта клетки генными модификациями этой же клетки. При этом основной ДНКовый текст генома продолжает содержать ошибки, но появляется дополнительный текст (приложение), который указывает читателю (в данном случае клетке) на существование таких ошибок. Это напоминает список типографических опечаток, который иногда встречается в конце книг.
Теоретически мишенью для генной терапии могут быть как клетки тела (соматические клетки), так и зародышевые клетки (яйцеклетки, сперма). Принципиально, что изменения, вызываемые с помощью генной терапии соматических клеток, не передаются следущему поколению. В случае наследственных заболеваний более подходящими для генной терапии могли бы быть зародышевые клетки, изменения в которых должны сохраняться и у потомства. Однако в практическом плане сейчас интерес представляет соматическая терапия, а генная терапия зародышевых клеток — это проблема будущего. Дело в том, что в действительности наследственные болезни можно было бы вылечить раз и навсегда, воздействуя именно на половые клетки или клетки эмбрионов на ранних стадиях развития. Введенный ген, попадая в результате искусственного переноса во множество интенсивно делящихся клеток, способен предотвратить развитие заболевания. Но этот вид генной терапии связан с целым рядом проблем как технических, так и, главным образом, этических. В частности, высказываются опасения, что такой подход можно будет использовать для производства нового поколения «детей на заказ». Теоретически существует опасность «засорения» генофонда человека в результате внедрения искусственных генных конструкций в половые клетки. По всем этим причинам пока используют лишь раннюю диагностику для предотвращения рождения «больных» детей (об этом речь шла выше), а не вмешательство в сам человеческий эмбрион. Реальностью в настоящее время представляется только генная терапия, направленная на соматические клетки взрослого организма.
«Днем рождения» генной терапии считают 14 сентября 1990 года. В этот день группа ученых из Независимого института здоровья США под руководством В. Андерсона начала лечение четырехлетней девочки по имени Ашанси ДеСильва, родившейся с редкой болезнью — наследственным иммунодефицитом — связанной с нарушением работы гена фермента аденозиндезаминазы (ADA). В чем заключалось процедура, использованная учеными? У больной девочки взяли определенные клетки иммунной системы. Эти клетки подвергли генетической модификации вне организма (такой прием получил название ex vivo) — в них добавили инактивированный вирус, содержащий нормальный человеческий ген ADA. Затем «исправленные» клетки вновь перенесли в организм маленькой пациентки. Клетки с новой генетической программой оказались «здоровыми» и обеспечивали синтез нормального белка-фермента ADA. Это привело к значительному улучшению состояния пациентки. Но процедуру пришлось повторять многократно, и окончательное излечение больной так и не произошло. Хотя поначалу успех был ограниченный, тем не менее он вдохновил ученых и медиков на дальнейшие поиски в этом направлении.
Общая схема генной терапии в большинстве случаев одинакова. Сначала клонируют (выделяют в чистом виде) тот ген, который нарушен у пациента, используя для этого клетки здорового человека. Затем этот «нормальный» ген в «голом» виде или в составе специального вектора-носителя вводят прямо в тот или иной орган, который содержат дефектный ген (или его вводят в «больные» клетки, выделенные из пациента). При этом решающую роль играет эффективность доставки гена в клетки и его длительная сохранность в них. Генотерапия сейчас ориентирована в первую очередь на получение генов и векторов, обеспечивающих перенос этих генов в клетки взрослого организма. Для этого используют несколько приемов. Один из них — простая инъекция в пораженный орган раствора, содержащего ген, с помощью шприца. Разработан также прием, называемый баллистической трансфекцией, который осуществляется с помощью «генного ружья» — специального устройства, обстреливающего орган или ткань микрочастицами тяжелых металлов (золото, вольфрам), покрытых генами. Наконец, иногда используют процедуру, называемую электропорацией — воздействуют на клетки электрическими импульсами, которые способствуют раскрытию пор на поверхности клетки и, следовательно, проникновению гена извне в клетки. Для лечения заболеваний легких применяют также аэрозольную генную терапию — больные вдыхают аэрозоль, в которой содержится необходимый «здоровый» ген.
Для повышения эффективности переноса генов широко используют природные свойства некоторых вирусов проникать в клетки. Конечно, вводя в клетки «лечебный» ген, нужно думать о возможных вредных последствиях одновременного переноса с ним вирусных генов. По этой причине для генной терапии берут вирусы, которые должны быть безвредны для человека; кроме того, для дополнительной подстраховки их структуру предварительно существенно изменяют. В результате такие видоизмененные вирусы не способны размножаться в клетках человека и тем самым вызвать в них какую-то дополнительную патологию. Например, для этих целей часто используют различные аденовирусы. В них встраивают «лечебный» ген, а потом такой вирус вводится непосредственно больному. Не обошлось здесь и без трагедии. В сентябре 1999 года в Аризоне умер восемнадцатилетний юноша, которого с помощью генной терапии лечили от недостаточности фермента орнитинтранскарбомилазы. Но этот по сути дела единичный трагический случай не остановил работы по генной терапии. Он всего лишь послужил предупреждением ученым о необходимости быть предельно осторожными при использовании этого подхода.
Из общего числа известных заболеваний человека (примерно 10 тысяч) около 40 % составляют генетические или наследственные болезни. Генная терапия применима в первую очередь для так называемых моногенных наследственных заболеваний, т. е. таких болезней, которые связаны с нарушениями всего в одном гене. Дело в том, что в тех случаях, когда лишь единичный ген отвечает за то или иное заболевание, процесс лечения сильно облегчается. В настоящее время, используя информацию о структуре генома человека и его отдельных генов, ученые осуществляют широкомасштабный поиск средств лечения многих традиционно считавшихся фатальными для человека наследственых и приобретенных болезней, для которых известен причинный ген и/или его продукт. В первую очередь это такие заболевания, как гемофилия, муковисцидоз, дефицит аденозиндезаминазы, миодистрофия Дюшенна, некоторые кардио-васкулярные патологии и др. Сейчас уже существуют данные о проведении предклинических и клинических испытаний на базе разных подходов генной терапии для более 30 моногенных, в первую очередь наследственных (т. е. генетических) заболеваний человека. И здесь уже достигнуты определенные успехи.
Ярким примером моногенного наследственного заболевания, которое сейчас активно пытаются лечить с помощью генной терапии, может служить миодистрофия Дюшенна. За этим медицинским термином скрывается смертельное заболевание, связанное с повреждением одного гена под именем дистрофин, который расположен на женской X-хромосоме. Поскольку у мужчин эта хромосома представлена всего одной копией, то они-то и страдают в основном от этого заболевания. Без продукта гена дистрофина мышцы не сокращаются. В результате наступает мышечное бессилие: не поднимается грудная клетка и больной не может дышать, плохо сокращается сердце, не работают ноги. Была получена модель этого заболевания — мыши, лишенные гена дистрофина. Когда таким животным разными способами переносили нормальный ген дистрофина, в результате в ряде случаев у них восстанавливалась нормальная функция значительной массы мышечных волокон (до 25 %). Однако при генной терапии миодистрофии у человека необходима генетическая модификация большинства (до 50 %) мышечных волокон, разбросанных по всему организму, что требует узконаправленного и высокоэффективного метода переноса генов, который пока еще не найден учеными.
С X-хромосомой человека связано и другое хорошо известное заболевание, так называемая царская болезнь или гемофилия. Этот неизлечимый недуг (кровотечение, которое нельзя остановить) знаком большинству людей в связи с болезнью царевича Алексея. Но и задолго до этого гемофилия была известна как «царская болезнь», поражающая, как правило, высокородных, высокопоставленных особ. Гемофилия обусловлена нарушениями в генах, продукты которых ответственны за свертывание крови. Гемофилия передавалась в царской семье по наследству по женской линии, но страдали ей только мужчины. Дело все в том, что отвечающий за свертываемость крови ген находится только в X-хромосоме, а у женщин их две (в отличие от мужчин): в результате у женщин одна хромосома способна как бы дублировать другую и болезнь не развивается. Подходы для лечения гемофилии первоначально отрабатывались на модельных объектах — мышах и собаках, которым вводили нормальные гены факторов свертывания крови, вставленные в состав вирусов как природных переносчиков генетического материала. Эксперименты на животных прошли успешно, и сейчас уже начаты клинические испытания по лечению гемофилии у человека.
Большое внимание уделялось за последние годы лечению муковисцедоза. Эта болезнь, поражающая примерно одного из 2500 новорожденных в Центральной Европе, вызывается наследственным дефектом гена, ответственного за перенос ионов через клеточную мембрану. При наличии «больного» гена на обеих хромосомах развивается хроническая легочная инфекция и нарушается процесс всасывания питательных веществ из пищеварительного тракта. Когда была найдена причина заболевания, сразу же приступили к разработке способов его лечения с помощью генной терапии. Сейчас пытаются вводить нормальный ген в составе вирусных векторов в легкие путем вдыхания пациентами водно-эмульсионного препарата рекомбинантной ДНК.
Сложнее обстоит дело с заболеваниями, обусловленными неправильной работой нескольких генов (мультигенные заболевания). Большой пробел в наших знаниях о генах, ответственных за такие патологии, пока не позволяет направленно применять генную терапию для эффективного лечения многих из этих заболеваний. При таких заболеваниях, как, например, рак или атеросклероз, недостаточно восстановить одну из нарушенных реакций в клетке с помощью определенного гена, а необходимо понять в целом всю сложную картину заболевания, выявить все гены, участвующие в этом, чтобы привести физиологическое состояние пациента к норме. В таких случаях исходят из того, что введенный в организм «лечебный ген» приводит к синтезу белка, который или сам по себе может оказать терапевтический эффект, или же он изменяет чувствительность больных клеток к действию определенных лекарственных препаратов. Так, среди наиболее распространенных приобретенных (ненаследственных) заболеваний в первую очередь внимание исследователей в области генной терапии приковано к такому заболеванию, как рак (наследственные формы рака по современным оценкам составляют всего около 1 % всех раковых патологий). На фоне весьма опасных для организма противораковых средств, используемых в настоящее время, таких, как сильное радиоактивное облучение, введение больших доз чрезвычайно токсичных химических веществ или хирургическое удаление жизненно важных органов, генная терапия представляется весьма «мягким» подходом. Сейчас в борьбе со злокачественными заболеваниями с помощью генной терапии наметилось несколько стратегических направлений. Это, в первую очередь, генетическая модификация клеток иммунной системы для усиления их противоопухолевой активности и подавление работы онкогенов. Но это далеко не все. В частности, один из эффективных подходов в генной терапии опухолей — повышение чувствительности опухолевых клеток к химиотерапевтическим препаратам. Часто для этой цели используют ген, кодирующий фермент тимидинкиназу вируса простого герпеса. Этот ген часто называют геном-самоубийцей или суицидным геном. Дело в том, что присутствие продукта этого гена в клетках приводит к их строго избирательной гибели при введении извне специфического химического агента, называемого ганцикловиром. Клетки, в которых синтезируется вирусная тимидинкиназа, превращают этот препарат в токсический продукт и в результате этого погибают. Отсюда и появилось название у гена тимидинкиназы вируса герпеса — суицидный. Этот и некоторые другие «суицидные» гены пытаются сейчас использовать для уничтожения раковых клеток. Данный метод генной терапии опухолей интенсивно развивается, проводятся широкие клинические испытания на пациентах, в частности, на больных с раком яичников и опухолью мозга глиобластомой. Сообщается, что уже получил одобрение протокол с использованием гена тимидинкиназы вируса герпеса для лечения рака предстательной железы. При этом в железу инъецируется генная конструкция, содержащая вирусный ген, а затем в кровь больного вводится ганцикловир. В результате происходит избирательная гибель раковых клеток, а нормальные клетки остаются неизменными.
Уже прошли успешные испытания на крысах генные аэрозоли, при вдыхании которых осуществляется перенос генов, способных предупреждать рак легких у курильщиков. Ученые использовали для этого в качестве вектора простудный вирус, который способствовал искусственному внедрению в опухолевые клетки мышей гена FHIT, нарушения в котором служат одной из основных причин рака легких. В результате появления в клетках нормального продукта этого гена у животных происходила гибель опухолевых клеток.
Заметные успехи в лечении рака были достигнуты российскими учеными под руководством академика Г. П. Георгиева. Ими обнаружен ген Tag7, продукт которого резко снижает развитие опухоли. В настоящее время рекомбинантные плазмиды с этим геном проходят клинические испытания.
Важным направлением генной терапии выступает и защита нормальных тканей от токсического эффекта химиотерапии и облучения. В этом направлении генная терапия использует, например, такой прием, как введение в стволовые клетки костного мозга гена, обеспечивающего множественную лекарственную устойчивость. Повышение устойчивости к радиоактивному облучению клеток нормальных тканей, находящихся рядом с опухолью, пытаются осуществить за счет сверхэкспрессии в них генов антиоксидантов (например, таких, как гены глутатион-синтетазы или трансферами).
Кроме рака, следует отметить определенные успехи генной терапии при лечении некоторых патологий сердечно-сосудистой системы. В частности, описаны попытки использования генной терапии для предотвращения тромбообразования. Здесь идут по пути генетической модификации клеток кровеносных сосудов, вводя в них гены, продукты которых могут предотвращать формирование тромбов. Активно проводятся работы по усилению процесса роста кровеносных сосудов, требующемуся, например, после инфаркта миокарда и при ишемии нижних конечностей. Для этих целей используется перенос целого ряда генов, продукты которых обладают способностью инициировать процесс сосудообразования (в первую очередь различные факторы роста). И уже появились сообщения о первых успехах на этом пути.
На хомяках уже получены впечатляющие результаты, которые позволяют думать, что в недалеком будущем генная терапия сможет заменить собой пересадку сердца. Эксперимент основывался на факте взаимосвязи между ослаблением сократительной функции сердца, ведущей к сердечной недостаточности, и повышенной экспрессией гена PLN, продукт которого блокирует работу канала для ионов кальция (последние чрезвычайно важны для сокращения сердечной мышцы). Различные факторы, которые считают причинами сердечной недостаточности, могут нарушать регуляцию экспрессии гена PLN, что и приводит зачастую к ослаблению работы сердца. Хомякам вводили вирусный вектор, содержащий мутантный ген PLN, продукт которого (в нем заменена одна аминокислота) имел эффект, обратный нормальному белку. В результате этого у животных, получавших экспериментальное лечение, удалось остановить дальнейшее развитие болезни сердца, в то время как у контрольных, которым ген не вводился, сердечная недостаточность прогрессировала до поздних стадий жизни.
Интерес представляют и исследования, проводимые по генной терапии заболеваний кожи (вернее, кожного эпителия). Прямое втирание раствора ДНК с рекомбинантным геном в волосяные фолликулы открывает эффективный и нетравматический путь для доставки в организм нужных для лечения генетических конструкций.
Ожидается, что в скором времени с помощью генной терапии можно будет даже вернуть зрение слепым. Эта надежда связана с недавними удачно проведенными экспериментами на собаках. Трое щенков, на которых проводился эксперимент, страдали врожденной слепотой Лебера (дегенерация сетчатки). Заболевание связано с отсутствием в клетках одного из ключевых белков. При этом заболевании животные или рождаются слепыми, или слепота наступает практически сразу же после их рождения. Введение больным животным с помощью рекомбинантного вируса нормального гена привело к появлению у них зрения. Ученые надеются, что вскоре начнутся подобные работы и на человеке, глаз которого по устройству похож на собачий.
С помощью генной терапии в экспериментах на крысах удалось добиться устранения у них алкогольной зависимости. Было известно, что важную роль в возникновении чувства удовольствия и алкогольной зависимости играет пептид дофамин. В определенную область мозга крыс, с которой связывают пристрастие к алкоголю, вводили ген, кодирующий рецептор к дофамину (DRD2), с которым дофамин связывается. В результате этого через три дня после введения гена у животных повысилось число рецепторов к дофамину, а содержание самого дофамина и, как следствие, доля спирта в общем объеме выпиваемой жидкости резко снизились.
В последнее время большое внимание в генной терапии привлек к себе ген, кодирующий уже упоминавшийся выше фермент теломеразу. Этот фермент осуществляет удлиннение концевых участков хромосом (теломер), которые в норме укорачиваются при каждом делении клеток. За счет постепенного укорочения хромосом клетки в конечном итоге погибают. Однако при наличии активного фермента теломеразы ситуация меняется. По крайней мере, некоторые типы клеток, в которые вводился ген теломеразы, приобретали способность делиться бесконечно долго. И вот появились сообщения об использовании гена теломеразы в генной терапии. В частности, ген теломеразы вводили мышам с экспериментальным циррозом печени. После этого у животных обнаруживалась теломеразная активность в клетках печени, хотя в норме ее там не было. По мнению авторов, «теломеризация» клеток печени может способствовать восстановлению нормального содержания гепатоцитов, а, следовательно, лечению цирроза. Еще один пример. Мышам с удаленными надпочечниками вводились «теломеризованные» клетки этого органа, что приводило к восстановлению их функции. Существует предположение, что использование «обессмерченных» клеток может быть полезным для создания искусственных органов, выращенных из клеток пациента и поэтому не отторгающихся при трансплантации.
Большое внимание уделяется сейчас использованию генной терапии для борьбы с всевозможными вирусными инфекциями. И здесь активно разрабатывают новую стратегию генотерапии, основанную на «выключении» вирусных генов, работа которых связана с развитием различных патологий. В частности, перед человечеством остро стоит проблема СПИДа. На ее решение направлены усилия огромного числа ученых и медиков. В литературе описано множество различных подходов борьбы с этим пока, к сожалению, полностью не излечимым заболеванием, вызываемым вирусом иммунодефицита человека (ВИЧ). Подключились к этой проблеме и генные терапевты. И уже можно говорить о первых, хотя пока еще скромных, успехах. В частности, на модельных системах показан терапевтический эффект ряда генных конструкций. Поскольку все эти варианты трудно перечислить, остановимся на одном из них. Так, было известно, что в геноме ВИЧ содержится некая последовательность (названная TAR), которая узнает специальный вирусный регуляторный белок. Только после взаимодействия этого белка с TAR-элементом вирус начинает размножаться. Для того, чтобы предотвратить этот процесс, было предложено вводить искусственно синтезированную TAR-последовательность в инфицированные клетки. Регуляторному белку все равно, с чем взаимодействовать — с вирусной последовательностью или с такой же точно последовательностью, искусственно внесенной в клетки. Добавленная в клетки ДНК обеспечивает в данном случае роль «ловушки»: когда в инфицированной клетке на ней синтезируется много РНК, регуляторный белок вируса связывается преимущественно с ними, а не с РНК вируса, и в результате этого вирус перестает размножаться.
Гены, вызывающие многочисленные тяжелые недуги и позволяющие вирусу размножаться, могут быть целенаправленно нейтрализованы с помощью механизма РНК-интерференции (мы уже упоминали о нем). В последнее время на модельных объектах установлено, что интерферирующая микроРНК (т. е. РНК, которая «выключает» действие строго определенного гена) может быть полезной при лечении ряда вирусных инфекций (например, при СПИДе и при полиомиелите), а также нейродегенеративных заболеваний, в частности, болезни Хангтингтона. Так, в результате использования специальных двунитевых микроРНК в экспериментах на мышах у них существенно замедлилось развитие заболевания, аналогичного болезни Хантингтона, а в ряде случаев наблюдалось даже полное восстановление нормального функционирования мозга.
С помощью генной терапии теперь осуществляют и иммунизацию (вакцинацию) организмов, что получило специальное название — ДНК-иммунизация. Процедура иммунизации против вирусных заболеваний с помощью их же собственных «нейтрализованных» белков (они называются антигенами) известна давно. При ДНК-иммунизации вместо белков-антигенов вводят определенные гены. Эти гены, работая в клетках, производят строго определенные белки-антигены, на которые в организме и вырабатывается иммунитет, т. е. образуются соответствующие антитела. Если после ДНК-иммунизации в организм попадет вирус, то имеющиеся антитела будут бороться с ним и уничтожать его. Метод ДНК-иммунизации был тщательно отработан опять же на животных и показал свою высокую эффективность, особенно в отношении таких вирусных инфекций, как клещевой энцефалит, ВИЧ, малярийный плазмодий. Констатируем лишь, что у ДНК-иммунизации имеется ряд существенных преимуществ по сравнению с традиционно используемыми приемами (однако детальное обсуждение этого вопроса есть назначение совсем другой книги).
В печати широко рекламируются первые успехи генной терапии в лечении людей. Отдельные успехи действительно позволяют с оптимизмом смотреть в будущее этого направления. В качестве примера приведем такой случай. У одного американца после операции шунтирования на сердце через некоторое время состояние снова ухудшилось. Новая операция шунтирования была уже бесполезна. И он решил рискнуть: принял участие в новом клиническом испытании на сердце. Прямо в сердце ему сделали укол раствора с геном, который вызывает рост кровеносных сосудов. Уже через 3 недели пациент почувствовал себя почти здоровым. Такой же эффект испытали на себе и 16 других больных, участвовавших в эксперименте. Это был успех!
Приведем другой пример. В 2000 году в США была предложена процедура введения гена, который кодирует образование одного из факторов свертывания крови. Внутримышечное введение такого гена больным гемофилией препятствовало возникновению кровотечений у пациентов. Результаты первых клинических исследований свидетельствуют о том, что после такого лечения пациенты с гемофилией более года не испытывают необходимости в дополнительных инъекциях фактора.
Сейчас уже ясно, что генная терапия может быть использована для лечения не только наследственных, но и для значительно более распространенных приобретенных болезней, таких как диабет, остеопороз, ревматоидный артрит, рак и вирусные инфекции (включая даже СПИД). В частности, нет сомнения, что генная терапия вирусных заболеваний позволит значительно сократить расходы на широко используемое в настоящее время противовирусное лечение, которое далеко не всегда эффективно и, кроме того, нередко сопровождается серьезными осложнениями.
Ученым и медикам предстоит еще решить массу непростых проблем, в частности, проблем, связанных с устойчивым переносом генов, со взаимодействием генетических препаратов с клетками, с опасностью аллергических реакций и т. д. В связи с этим, перспективным методом генотерапии сейчас считается уже упоминавшаяся технология ex vivo. Клеточный материал, взятый от пациента, подвергают in vitro, т. е. в пробирке, генетическим изменениям, а затем ретрансплантируют его снова в организм донора (рис. 35). И уже есть пример успешного лечения семейной формы гиперхолестеринемии с использованием такого подхода. Разработан генно-терапевтический подход, основанный на подсадке в кожу трансформированных in vitro клеток кожного эпителия (кератиноцитов).
Имеются хорошие заделы в плане использования технологии ex vivo для лечения заболеваний суставов (ревматоидных артритов). Ученые из Гарвардского университета в Бостоне предложили лечить пораженные суставы путем прямого введения в них генетически измененных клеток, способных вырабатывать белок, оказывающий противовоспалительное действие. Из пораженных суставов брали клетки и вносили в них ген, кодирующий антагонист рецепторов к белку интерлейкину–1. После нескольких недель выращивания in vitro клетки вводили в суставы. В результате у большей части испытуемых наблюдали значительное улучшение состояния.
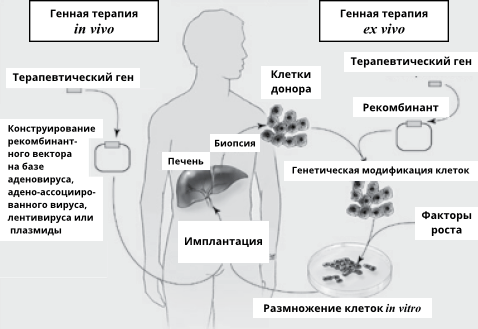
Рис. 35. Две основные стратегии, используемые при генной терапии: in vivo и ex vivo
Другой пример, но опять же пока на животных как на моделях. У мышей удаляли надпочечники и затем им вводили не ген, а генетически измененные ex vivo клетки надпочечника с активно работающим геном теломеразы. Это привело к тому, что функции надпочечников были полностью восстановлены.
Однако для широкого читателя очень важно отметить, что на современном этапе еще существует множество нерешенных проблем и поэтому генная терапия пока не получила широкого распространения. Несмотря на очевидные преимущества перед другими способами лечения, это направление пока не стало ведущим. Хотя большая армия ученых работает в области генной терапии свыше 10 лет, реальные успехи этого направления еще не столь велики, как этого хотелось бы. Причин тому несколько. В первую очередь — это отторжение чужеродных генов, вызванное иммунной реакцией организма и быстрым разрушением вводимых генов в клетках. В новой для него клетке ген чувствует себя чужаком. И клетка, не понимая своей выгоды, всячески старается от него избавиться. В результате перенесенный ген существует там, как правило, очень короткий интервал времени, порой не успевая наработать необходимое количество лекарственного продукта. По этим причинам чаще всего излечение получается временное и только у части клеток. Второе — невысокая эффективность современных методов переноса генов в клетки больных. Весьма трудно искусственно внести тот или иной ген во все клетки. Лучше всего было бы встраивать нормальные гены вместо «больных» генов в геном пациентов еще на стадии половых клеток. Такие подходы сегодня разработаны на животных, но для человека по ряду причин это сейчас практически невозможно применять.
Потребуется еще время и большие усилия ученых, чтобы сделать гены лекарствами. Сейчас еще нельзя посоветовать ни одному человеку пойти в аптеку и купить рекомбинантную плазмиду с геном, который его спасет, например, от диабета. Но уже созданы солидные теоретические и методические предпосылки для этого, достигнуты заметные успехи в экспериментах на животных, начаты предклинические и клинические испытания многих новых разработок на человеке. Так что в недалекой перспективе все эти проблемы, без сомнения, будут решены.
На конец 2001 года в мире существовало около пятисот протоколов процедур генной терапии, ряд из которых уже был испытан на 3500 больных (в основном в США). Десятки процедур находятся сейчас на последних стадиях клинических испытаний. Огромный масштаб работ свидетельствует о том, что генная терапия приближается к своему совершеннолетию. По оценкам специалистов, уже через двадцать лет генная терапия совершенно изменит облик практической медицины. На базе генной терапии можно в скором времени ожидать появления новых способов защиты человеческого организма от старения. Вот цитата из интервью с директором Института молекулярной генетики РАН академиком Е. Д. Свердловым (газета «Доктор Фом» за февраль 1999 г.): «Генная инженерия уже сейчас умеет исправлять «испорченные» гены. За считанные годы это умение вырастет тысячекратно. Для биологов уже нет сомнений, что в XXI веке генный аппарат каждого новорожденного будет тщательно проверяться, чтобы избавить человека от многих неприятностей, скажем, от самых страшных заболеваний — генных. И есть немалая вероятность, что одновременно можно будет убирать многие негативные черты характера, которые тоже определяются генами, — такие, как трусость, жадность, эгоизм. И усилить задатки других черт — той же гениальности, ген которой был открыт в прошлом году. А может быть, удастся пойти еще дальше: определив уже в родильном доме поведенческие реакции человека, дать ему и соответствующее воспитание, подготовив его к той нише бытия, в которой ему будет наиболее комфортно. И тогда, возможно, не станет людей, считающих, что их жизнь не удалась, а на Землю придет тот самый Золотой век, о котором человечество мечтает с самого начала своей истории». Хочется надеятся, что после всего вышесказанного читатель вместе с автором разделит оптимизм этих строк.
| <<< Назад ДНКовый ТЕКСТ ВМЕСТО ОТПЕЧАТКОВ ПАЛЬЦЕВ (генная дактилоскопия) |
Вперед >>> СМЕРТЬ И БЕССМЕРТИЕ — В НАШИХ ГЕНАХ (проблема долголетия) |
- КОРОЛЕВА УМЕРЛА — ДА ЗДРАВСТВУЕТ КОРОЛЕВА!
- ОТ СТРУКТУРЫ К ФУНКЦИИ (функциональная геномика)
- ОТ ГЕНА — К БЕЛКУ (протеомика)
- ОТ ГЕНА И БЕЛКА — К ЛЕЧЕНИЮ (медицинская геномика)
- РАК — ПРОБЛЕМА ПРОБЛЕМ (онкогеномика)
- ГЕНЫ И ПОВЕДЕНИЕ (психогеномика)
- ВСЕ ЛИ В НАС ЗАВИСИТ ОТ ГЕНОМА? (геном и окружающая среда)
- ПРАВИЛЬНЫЙ ДИАГНОЗ — ПОЛОВИНА ЛЕЧЕНИЯ (генная диагностика)
- ДНКовый ТЕКСТ ВМЕСТО ОТПЕЧАТКОВ ПАЛЬЦЕВ (генная дактилоскопия)
- РЕМОНТ ГЕНОВ (генная терапия)
- СМЕРТЬ И БЕССМЕРТИЕ — В НАШИХ ГЕНАХ (проблема долголетия)
- ИНДИВИДУАЛЬНАЯ ПИЛЮЛЯ (фармакогеномика)
- КОМПЬЮТЕР ВМЕСТО ПРОБИРКИ (геноинформатика)
- Чем полезен компьютер для изучения генома человека?
- Геноинформатика — быстрый путь от гена к лекарству
- Немного фактов на грани с фантастикой
- ВСЕ ПОЗНАЕТСЯ В СРАВНЕНИИ (сравнительная геномика)
- Межклеточное вещество
- 04. На что влияет нагрев планет звездами, звезд Ядрами Галактик, Ядер Галактик Ядрами Сверхгалактик
- Список литературы
- Разные человечества
- Красные тучи, закрывающие солнце
- Московская белая
- Муравей, семья, колония
- Примерные рационы для котят от месяца до пяти и старше
- Голосеменные растения завоевывают мир
- Пароль скрещенных антенн
- Позор страны
- Что такое водопад?
