Книга: Биохимия старения
Изменения коллагена, связанные с возрастом
| <<< Назад Синтез коллагена |
Вперед >>> Замедление связанных с возрастом изменении в коллагене |
Изменения коллагена, связанные с возрастом
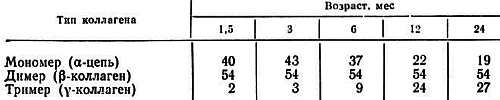
Отдельные цепи коллагена диссоциируют в щелочной или в кислой среде и в растворах мочевины, тиоцианата и гуанидин-гидрохлорида. При нагревании до 40 °C водородные связи между цепями рвутся. Количество коллагена, которое экстрагируется таким способом, велико у развивающихся животных, но быстро уменьшается с возрастом. Когда коллаген экстрагировали нейтральной солью из кожи крыс возрастом от. 1, 5 до 24 мес, было обнаружено, что у более старых животных экстрагируется меньше коллагена [36]. При этом количество экстрагирующихся одиночных ?-цепей быстро уменьшалось, а тримеров ?-цепей (?-коллаген) — увеличивалось (рис. 4.3 и 4.4; табл. 4.3). Для димеров ?-цепей (?-коллаген) изменений не наблюдалось.
Таблица 4.3.Соотношение различных типов коллагена из кожи крыс как функция возраста
Изучены изменения поперечных сшивок коллагена из бычьей кожи по мере развития животных [67]. В коже зародышей много сшивок типа ДДОЛНЛ, которые делают ее плохо растворимой. К рождению доля этих сшивок уменьшается примерно на одну треть. В возрасте 6 мес их практически нет, их заменяют диоксилизинонорлейцин (ДОЛНЛ) и фракция С. До 18 мес количество этих сшивок постепенно увеличивается и составляет около 95 % всех сшивок. В коже человека максимальное количество ДОЛНЛ и фракции С наблюдается в возрасте 17–20 лет.
В период развития коллаген постоянно обновляется. По-видимому, изменение характера поперечных сшивок и их соотношения в течение этого периода обусловлено появлением ?-цепей различных типов. Обмен коллагена постепенно замедляется, так как развитие сопровождается уменьшением скорости синтеза и разрушением коллагена. Показано, что потребление в коже крыс аскорбиновой кислоты, которая является кофактором и пролил- и лизилгидроксилазы, велико при рождении и быстро уменьшается по мере развития животных. В возрасте 6 мес потребление аскорбиновой кислоты составляет одну сотую от ее потребления при рождении. Вместе с тем аскорбиновая кислота в течение всей жизни поглощается костями и связками, правда после 12 нед ее поглощение падает. Очевидно, синтез коллагена в коже крыс в возрасте 6–8 нед практически прекращается, тогда как в костях и связках он продолжается всю жизнь. Следовательно, аскорбиновая кислота требуется млекопитающим в течение всей жизни для поддержания нормального состояния костей и связок. Описанные результаты позволяют предположить, что появление в старческом возрасте морщин на коже может быть связано не только с прекращением обмена коллагена в ткани, но также с увеличением числа поперечных сшивок между мономерами коллагена, отложившегося в коже на ранних стадиях развития. Сообщают, что число сшивок в коллагене сухожилия хвоста крысы увеличивается в возрастном интервале 3-100 нед от 1 на 500000 до 1 на 50000, т. е. в 10 раз [93]. Это может изменить не только физические свойства коллагена, но и его способность экстрагироваться солевым раствором [32].
Другим фактором, влияющим на обмен коллагена в течение жизни животного, является фермент коллагеназа. Этот фермент расщепляет в коллагене связь Gly — Leu [31]. Паратгормон стимулирует синтез коллагеназы и вызывает деминерализацию костей. В матке в период беременности синтез фермента усиливается, тогда как прогестерон ингибирует его синтез [30]. В коже человеческого эмбриона коллагеназы больше, чем у взрослого человека. Если кожу эмбриона и взрослого человека культивировать in vitro, то из первой выделяется в среду значительное количество латентной, неактивной, коллагеназы (зимогена), однако из последней латентная коллагеназа не выделяется [72]. Молекулярная масса латентной коллагеназы из кожи человека — 55000-60000, а активной коллагеназы — 45000-50000 [75]. Если латентный фермент пропустить через колонку с сефадексом G-50, обработанным предварительно NaI, то он активируется. Трипсин удаляет из молекулы фермента пептид с мол. массой 10000 и активирует его. Таким образом, фермент, по-видимому, инактивируется путем связывания с ингибитором, имеющим мол. массу 10000. Комплекс фермент — ингибитор (латентная коллагеназа) активируется тиолблокирующими агентами, например 4-аминофенилмеркуриацетатом [70]. Природу ингибитора еще предстоит установить, однако ясно, что активность коллагеназы может быть еще одним контрольным пунктом обмена коллагена и изменения его структуры при старении.
Согласно одной из теорий старения, основанной на образовании поперечных сшивок [90], увеличение числа таких сшивок в коллагене и других внеклеточных макромолекулах вызывает изменение физических и химических свойств соединительных тканей. Свидетельством в пользу этой теории служит то, что экстрагируемость коллагена из кожи и его расщепление коллагеназой с возрастом уменьшаются, а его термостабильность и сила сокращения при этом увеличиваются. Даже если увеличение числа сшивок и вызывает эти изменения и оказывает влияние на функционирование соединительных тканей при старении животного, старение других тканей, не имеющих большого количества внеклеточного матрикса и коллагена, должно иметь другие причины. Кроме того, образование поперечных сшивок происходит после модификации, осуществляемой с помощью лизилоксидазы. Изменение содержания этого фермента в соединительных тканях с возрастом также может быть причиной увеличения числа сшивок.
В ряде работ [5, 9] сообщается, что количество поперечных сшивок в коллагене при старении растет. Однако более поздние исследования не подтверждают это заключение. Когда измеряли число сшивок в сухожилии коров 3- и 12-летнего возраста после расщепления коллагена цианогенбромидом, никакой разницы в количестве ковалентных сшивок не обнаружили [15]. При определении числа сшивок, образованных пиридинолином в коллагене реберных связок и ахиллесова сухожилия крыс и человека [50], было показано, что у человека после 30 лет оно уменьшается, а у крыс после наступления зрелости растет. Основные типы сшивок — оксилизинонорлейцин (ОЛНЛ) и диоксилизинонорлейцин (ДОЛНЛ) с возрастом не меняются [81], т. е. образование поперечных сшивок в коллагене не является, по-видимому, первичной причиной старения [46]. Было высказано предположение, что уменьшение растворимости коллагена с возрастом может определяться стабилизацией лабильных сшивок. Для того чтобы установить, меняется ли количество поперечных сшивок с возрастом, необходимы дальнейшие исследования.
Особый интерес в связи с этим представляют три типа реакций. Первый — это реакции моносахаридов, глюкозы и галактозы, с альдегидами, образовавшимися из лизиновых и оксилизиновых остатков. В коже быка интенсивность этих реакций с возрастом увеличивается. Поскольку упомянутые здесь гексозильные соединения не могут образовывать связи с другими ?-цепями, в результате этих реакций уменьшается число потенциальных мест для образования сшивок. Роль происходящих изменений неясна, но, возможно, они ответственны за повышенную хрупкость кожи и костей в старческом возрасте.
Второй тип реакций — взаимодействие аллизина с оксилизином с образованием альдимина или взаимодействие оксиаллизина с оксилизином либо с лизином с образованием кетоаминов, более стабильных, чем альдимины. Доля таких поперечных сшивок в сухожилиях человека, быка и крысы в период их роста увеличивается, но затем уменьшается. Эти изменения могут регулироваться уровнем лизилгидроксилазы, который в свою очередь зависит от других факторов.
Третий тип реакций — определение сшивок путем восстановления 3Н-боргидридом. С возрастом количество включающегося трития уменьшается. Возможно, причиной этому служит уменьшение доли таких сшивок. Вместе с тем причиной уменьшения включения трития может быть то, что эти сшивки в старческом возрасте становятся более стабильными и поэтому не восстанавливаются.
В ранний период развития в тканях меняются не только число и стабильность поперечных сшивок, но также и типы коллагена. Как было показано ранее [19], в коже и, возможно, в других тканях изменяется соотношение коллагена типа I и III. Обычно в культуре in vitro хондроциты синтезируют коллаген типа II, но если их обработать бромдезоксиуридином, аналогом тимидина, то они синтезируют тип I и другой тип коллагена, которого в тканях в норме нет [45]. Коллаген типа I синтезируют также старые хондроциты. Если в связках обычно синтезируется коллаген типа II, то в связках суставов при остеоартрите появляется коллаген типа I [53]. Было бы существенно выяснить, по этой ли причине происходит уменьшение в старческом возрасте коллагенового матрикса при остеопорозе. Может ли произойти замена синтеза остеобластами коллагена типа I на синтез коллагена какого-либо другого типа? При врожденной болезни — osteogenesis imperfecta — при которой кости становятся очень хрупкими, фибробласты кожи в культуре синтезируют в большом количестве коллаген типа III. Некоторые связанные с коллагеном заболевания возникают из-за уменьшения уровня специфических ферментов, необходимых для его синтеза [42]. Происходит ли при этом сдвиг в синтезе или ингибирование синтеза коллагена типа I, неизвестно. Любое из этих изменений может повлиять на способность матрикса содействовать кристаллизации апатита, в результате чего кость может стать более хрупкой, так как известно, что все типы коллагена, кроме типа I, образуют аморфные волокна.
Структурные изменения коллагена при старении могут быть обусловлены несколькими факторами. Один из них, возможно, изменение в синтезе различных ?-цепей, кодируемых разными генами. В таком случае интересно выяснить, что является причиной включения гена ?-цепей одного типа и "выключения" гена ?-цепей другого типа? Вместе с тем с возрастом может меняться активность пролил- и лизилгидроксилазы, лизилоксидазы и гликозилтрансфераз, влияющих на образование поперечных сшивок, и это также может отражаться на возрастных структурных изменениях. Хорошо известно, что уровень этих ферментов с возрастом меняется. Тогда что определяет уровень их синтеза? Одним из определяющих факторов может быть обмен коллагена, который зависит от активности коллагеназы. Коллагеназа, когда в ней нет необходимости, существует в неактивной форме. Синтез этого фермента, а также синтез его ингибитора и активация неактивной коллагеназы могут определяться различными факторами, уровень которых в свою очередь может меняться с возрастом.
Таким образом, можно предположить, что структурные изменения коллагена, зависящие от возраста, происходят из-за изменения уровня некоторых ферментов и, следовательно, являются вторичными причинами старения. Какое-либо повреждение первичных центров, т. е. генома, в результате которого может измениться синтез ферментов, принимающих участие в синтезе ?-цепей, их деградации и модификации, может привести к нарушению структуры коллагена, а следовательно, и его функции. Отсюда вытекает необходимость изучения изменения в регуляции синтеза этих ферментов и разных типов ?-цепей на уровне генома; только тогда можно разобраться в молекулярных событиях, связанных с изменениями в структуре коллагена как функции возраста. Полиморфизм молекул коллагена и сдвиги в соотношениях типов коллагена в тканях, наблюдающиеся на протяжении жизни, похожи на те явления, которые имеют место для изоферментов лактатдегидрогеназы [4] и аланинаминотрансферазы [56]. Все это может объясняться разной активностью генов, кодирующих свойства ?-цепей разных типов. Активность генов может определяться факторами, уровень которых меняется на протяжении жизни. В пользу этой точки зрения свидетельствует тот факт, что синтез коллагена в период постэмбрионального развития свободно живущей нематоды Panagrellus silusiae имеет прерывистый характер, и каждая очередная его вспышка совпадает с увеличением уровня пролилгидроксилазы [43].
| <<< Назад Синтез коллагена |
Вперед >>> Замедление связанных с возрастом изменении в коллагене |
- Изменения регуляции генов
- 9.4.1. Циклические изменения
- Изменения активности генов
- Изменения белков
- РАЗДЕЛ 3. Вопросы, связанные с реинтродукцией
- Некоторые проблемы, связанные со стереоскопическим зрением
- Древние изменения большого материка восточного полушария
- Географическое распространение животных и изменения земной поверхности, на которые оно указывает
- Изменения белок-кодирующих генов
- Прежние взгляды на изменения материков
- Ошибки, связанные с непредсказуемостью окружающей среды и «недоброжелательностью»
- 7.3. Разнообразие экосистем (биогеоценозов). Саморазвитие и смена экосистем. Выявление причин устойчивости и смены экоси...
