Книга: Биохимия старения
Изменения в наборе изоферментов
| <<< Назад Изменения в содержании ферментов |
Вперед >>> Индукция ферментов |
Изменения в наборе изоферментов
Появление различных типов гемоглобинов в течение периода развития человека является примером изменения молекулярных форм одного и того же белка, коррелирующего с функциональными изменениями [116]. Гемоглобин является тетрамерным белком, состоящим из четырех глобиновых субъединиц, или полипептидных цепей. Гемоглобин 1-2-месячного зародыша относится к ?2?2-типу. В течение последующего периода беременности (от 2 до 10 мес) он заменяется на гемоглобин типа ?2?2 (HbF). Гемоглобин новорожденного относится к типу ?2?2 (HbA) и сохраняется до конца жизни (рис. 3.1). Субъединицы ?, ?, ? и ? кодируются отдельными генами. Следовательно, последовательное изменение типа гемоглобина происходит благодаря активации одних генов и одновременной репрессии других. В этом аспекте интересно следующее: а) ?-ген активен в течение всего периода жизни, тогда как ?-, ?- и ?-гены активируются один за другим в указанной последовательности; б) когда активируется ?-ген, репрессируется ?-ген; когда активируется ?-ген, репрессируется ?-ген; в) длительность активного состояния генов различна: ?-ген активен в течение всей жизни, в то время как ?-ген активен только 1 мес, ?-ген — 8 мес, а ?-ген — после рождения и в последующий период. Гемоглобин переносит в ткани кислород. Способность к связыванию кислорода у гемоглобинов разных типов различна. Например, зародышевый гемоглобин HbF имеет большую способность к связыванию кислорода, чем гемоглобин взрослого организма HbA. Известно также, что содержание кислорода в материнской крови, снабжающей зародыш, ниже, чем в легких. Следовательно, гемоглобин с более высокой способностью к связыванию кислорода предназначен для преимущественного развития зародыша. Неизвестно, играет ли роль уровень кислорода в материнской крови в экспрессии различных генов глобина.
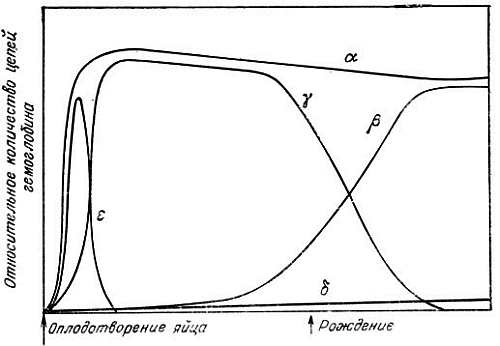
Рис. 3.1. Синтез цепей гемоглобина у плода человека [116]
Так же как ?2?2, ?2?2, ?2?2 являются различными молекулярными формами гемоглобина, изоферменты — это различные молекулярные формы одного и того же фермента. Изоферменты характерны для ферментов, состоящих из двух или более субъединиц. Досконально исследованным в этом отношении ферментом является лактатдегидрогеназа (ЛДГ), катализирующая обратимое превращение пирувата в лактат. В различных тканях крысы имеются пять изоферментов ЛДГ [110]. Они состоят из субъединиц двух типов, Н и М, которые соединяются в различных соотношениях и дают пять типов активных изоферментов: H4, Н3М1, Н2M2, Н1М3 и M4. Н- и М-субъединицы различаются по аминокислотной последовательности и кодируются двумя разными генами, что показано путем генетических исследований оленьей мыши [99]. Маркет и Мёллер [78] впервые показали, что тип изофермента ЛДГ не только специфичен относительно вида ткани, он изменяется также в одной и той же ткани в процессе развития (рис. 3.2). Было высказано предположение, что тип изофермента в ткани отражает степень дифференцировки ее клеток. На ранней зародышевой стадии животных в тканях преобладают типы М4 и H1М3, но в процессе развития наблюдается переход к изоферментам Н3М1 и Н4. Эта постепенная смена изоферментов указывает на переход к большей активности гена Н-субъединицы или к меньшей активности гена М-субъединицы.

Рис. 3.2. Электрофореграмма в крахмальном геле ЛДГ из тканей человека в период развития. Ткани взяты у 14-недельного эмбриона [75]
Следует отметить также, что Н4- и Н3М1-изоферменты присутствуют преимущественно в аэробных тканях, таких, как сердце, мозг и кора надпочечников, тогда как М4 и H1М3-изоферменты присутствуют преимущественно в анаэробных тканях, таких, как скелетные мышцы и печень [19, 79]. Эмбрион млекопитающего, растущий в анаэробном окружении, содержит большие количества М4- и Н1М3-изоферментов; с развитием эмбриона происходит переход к Н4- и Н3М1-рформам. Эмбрион птенца растет в аэробном окружении, и он содержит больше Н4 и Н3М1-форм. В процессе его развития происходит переход к М4- и Н1М3-изоферментам. Эти наблюдения подтверждают предположение о том, что соотношение изоферментов в тканях, по крайней мере частично, обусловлено давлением кислорода. Экспериментально на культурах тканей показано, что в анаэробных условиях клетки синтезируют больше М4-формы ЛДГ [41].
В свете вышесказанного существенны данные лаборатории Канунго по изменению соотношения изоферментов в тканях крысы в зависимости от возраста [55, 100], показывающие, что содержание М4-ЛДГ в сердце 96-недельной крысы значительно ниже, чем у 30-недельной (рис. 3.3). В скелетных мышцах (рис. 3.4) и в мозгу (рис. 3.5) содержание М4-ЛДГ также понижается. Относительное содержание Н4-ЛДГ у старых животных, наоборот, повышается. Эта смена форм изоферментов может иметь большое физиологическое значение для старого животного, поскольку она может вызвать изменения в функционировании органов.
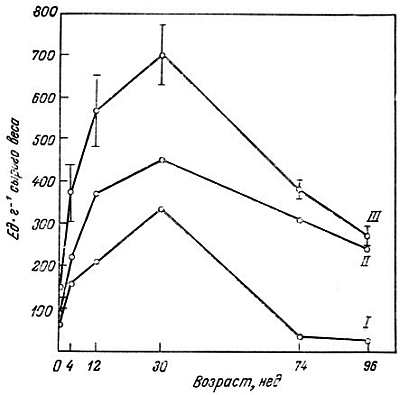
Рис. 3.3. Активность ЛДГ, выделенной из сердца крысы, в зависимости от возраста [100].
I — М-ЛДГ; II — Н-ЛДГ; III — (Н+М) — ЛДГ
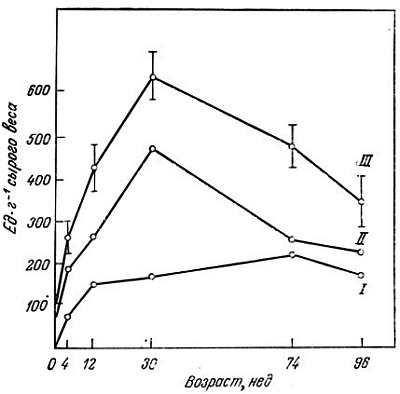
Рис. 3.4. Активность ЛДГ, выделенной из скелетных мышц, в зависимости от возраста [100].
I — М-ЛДГ; II — Н-ЛДГ; III — (Н+М) — ЛДГ
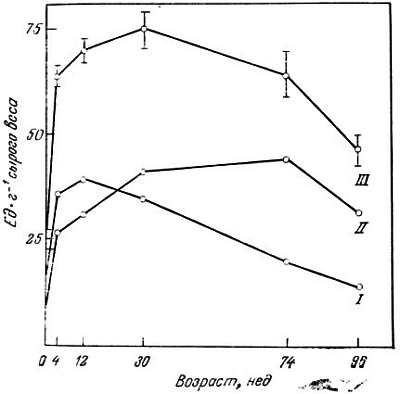
Рис. 3.5. Активность ЛДГ, выделенной из мозга крысы, в зависимости от возраста [100].
I — М-ЛДГ; II — Н-ЛДГ; III — (Н+М) — ЛДГ
Известно, что М4-ЛДГ катализирует превращение пирувата в лактат лучше, чем Н4-ЛДГ [26]. Следовательно, для тканей в анаэробных условиях, где источник кислорода отсутствует или не соответствует потребностям, большое количество М4-ЛДГ является преимуществом. Благодаря этому ферменту ткань способна производить энергию путем анаэробного гликолиза, превращая пируват в лактат. Уменьшение относительного содержания М4-ЛДГ, происходящее в старости, может снижать способность ткани приспосабливаться к анаэробным условиям. Следовательно, вероятность повреждения ткани в результате недостатка энергии в старости должна быть больше. Это хорошо коррелирует с более частыми случаями сердечной недостаточности у людей старческого возраста. Переход к ингибированию синтеза М-субъединиц в этих тканях в старческом возрасте может сделать ткани более аэробными и все более зависящими от цикла Кребса. Если бы переход к понижению относительного содержания М4- и М3Н1-форм после достижения зрелости мог быть прекращен, то энергетические соотношения в организме могли бы поддерживаться такими же, как в репродуктивном периоде. Было показано, что 17?-эстрадиол в матке незрелых крыс и кроликов усиливает преимущественно синтез М-субъединиц, в то время как он не влияет на синтез Н-субъединиц [40]. Повышение уровня М-субъединиц в таких тканях, как сердце и мозг, может быть полезным для старых животных.
Пируваткиназа (РК) катализирует превращение фосфоенолпирувата в пируват. Этот фермент имеет четыре изофермента: РК-1, 2, 3 и 4. В скелетных мышцах крысы в момент рождения изофермент РК-4 является доминирующей формой, но примерно на 14-й день он исчезает и заменяется изоферментом РК-3, который сохраняется до 52 нед [85]. Такие же изменения наблюдаются в сердечной мышце. Эти исследования не проводились на более старых животных, однако ясно, что, как и в случае изоферментов ЛДГ, изоферменты РК последовательно сменяют друг друга до позднего периода зрелости. У РК-3 Км для фосфоенолпирувата ниже (0,75·10-4 М), чем у РК-4 (4·10-4 М) [49]. Переход к изоферменту РК-3 в процессе развития, возможно, происходит из-за постепенного перехода ткани к аэробным условиям. В аэробных условиях окисление пировиноградной кислоты в тканях приобретает большее значение. Таким образом, переход к РК-3 коррелирует с переходом к Н4-ЛДГ, причем и в том и в другом случае по окончании репродуктивного периода ткань становится более аэробной и более зависящей от цикла Кребса.
Креатинкиназа катализирует синтез креатинфосфата из креатина и АТР. Она является димером и имеет три изофермента: ВВ, MB и ММ [108]. На начальной стадии роста зародыша в его скелетных мышцах, сердце и мозге присутствует только изофермент ВВ. Этот изофермент в скелетных мышцах замещается в процессе развития последовательно на MB и затем на ММ. В сердце происходит переход от ВВ-типа к типам MB и ММ, в то время как в мозгу перехода от ВВ-типа не наблюдается [28]. Таким образом, смена изоферментов является тканеспецифичным процессом и зависит от возраста.
Аденилаткиназа — еще один фермент, участвующий в переносе энергии. Она катализует превращение AMP и ADP в присутствии АТР и имеет три изофермента — I, II и III. Печень содержит только изоферменты II и III в соотношении, изменяющемся в ходе развития. Активность изофермента II в зародыше составляет только 2 Ед., а изофермента III — 20 Ед. Через две недели после рождения она повышается до 25 и 118 Ед. соответственно. Таким образом, наблюдается количественное изменение содержания двух изоферментов [31].
Другая интересная форма изменения наблюдается для субъединиц фермента альдолазы в скелетных мышцах кролика. Альдолаза — это тетрамерный фермент, состоящий из субъединиц двух типов — ? и ?; ее молекулярная структура ?2?2. Аминокислотный анализ фингерпринтов двух субъединиц после расщепления бромцианом показывает, что обе субъединицы почти идентичны; ?-цепь отличается от ?-цепи лишь несколькими модифицированными аминокислотами в области COOH-конца. По-видимому, обе субъединицы кодируются одним геном, но ?-цепь образуется в результате модификации после трансляции. На ранних стадиях развития, в течение примерно двух месяцев после рождения, преобладает ?-цепь. Однако по прошествии третьего месяца содержание обеих цепей становится одинаковым [72]. Причина повышения содержания ?-субъединицы на определенной стадии развития неизвестна, но, очевидно, это повышение обусловлено физиологическими потребностями, возникающими на этой стадии.
Происходят ли такая последовательная активация и репрессия генов и последовательные изменения в формах изоферментов только на ранней стадии жизненного периода или они распространяются также на старческий возраст? Некоторые исследования показывают, что подобные изменения происходят не только в раннем периоде, но и на протяжении всей жизни. Формы изоферментов некоторых ферментов как функция возраста были исследованы на Drosophila. Электрофорез в крахмальном геле гексозофосфат-изомеразы мужских и женских особей D. melanogaster показал, что из пяти изоферментов относительное содержание трех, медленно движущихся, в старости (67 дней) значительно выше. У женских особей два быстро движущихся изофермента, имеющиеся в молодости, в старости исчезают [45]. Таким образом, количество изоферментов зависит также от пола.
Содержание изоферментов эстеразы Drosophila также меняется с возрастом. Три медленно движущихся изофермента, отсутствующие в молодом возрасте, появляются в старости (49 дней) [45]. Из пяти изоферментов алкогольдегидрогеназы (АДГ) АДГ3 и АДГ5 присутствуют в течение всего периода зрелости, в то время как АДГ2 — только в первые 12 дней после вылета [27]. Возможно, что АДГ2 специфически необходима на ранней стадии развития. Все описанные здесь изменения являются суммарными для изоферментов, содержащихся во всех органах Drosophila. Поскольку в разных органах могут происходить различные изменения в какой-либо период жизненного цикла, из этих исследований нельзя сделать каких-либо общих заключений. Трудности изучения изоферментов в отдельных органах такого маленького организма, как Drosophila, очевидны, но факт возникновения или исчезновения определенных изоферментов в старости ясно говорит о репрессии и активации в этом возрасте определенных генов в одном или нескольких органах. Не исключено, что подобные изменения влияют на физиологическое состояние организма в старческом возрасте. В отличие от исследований форм изоферментов эстеразы на Drosophila, изоферменты эстеразы у пятидневного и пятимесячного таракана, Periplaneta americana, изучали в грудной мышце и мышцах конечностей. При разделении в геле были обнаружены восемь полос. В данном случае не нашли никаких различий в формах изоферментов ни как функции возраста, ни как функции пола. Не обнаружено также количественных различий в формах изоферментов в гемолимфе.
В исследованиях цитоплазматической аланинаминотрансферазы (цААТ) из печени крысы четко показано, что явление последовательной смены форм изоферментов распространяется и на старческий возраст [56, 87]. цААТ является димером, состоящим из субъединиц двух типов — А и В. Существуют два активных изофермента: цААТ-А и цААТ-В. Электрофорез очищенной цААТ из печени 5-, 52- и 100-недельных самок крыс в полиакриламидном геле показывает, что печень незрелых крыс содержит только цААТ-А, а старых — только цААТ-В. В печени зрелых крыс присутствуют оба изофермента, но уровень цААТ-А ниже (рис. 3.6). Две субъединицы, А и В, детерминируются двумя отдельными генами [24]. Очевидно, последовательное появление и исчезновение двух изоферментов цААТ на протяжении жизни указывает на последовательное активирование и репрессию генов, ответственных за их синтез. Какие факторы определяют активность этих генов — неизвестно, но возможно, что, как и в случае гемоглобина, активируют или репрессируют гены эндогенные факторы, возникающие в различные периоды жизни, и это приводит к появлению или исчезновению соответствующих полипептидных цепей.

Рис. 3.6. Электрофорез кристаллической растворимой аланинаминотрансферазы незрелых (5 нед), среднего возраста (52 нед) и старых (100 нед) крыс в 7,5 %-ном полиакриламидном геле (0,082 М трис-боратный буфер, рН 8,9). В каждом случае наносили 50 мг белка.
А — аланинаминотрансфераза А; В — аланинаминотрансфераза В [56]
Несмотря на то что к настоящему моменту накоплено еще мало информации, очевидно, исследования изоферментов имеют большое значение для понимания возрастных изменений, происходящих на генетическом уровне. Изоферменты различаются по Км для определенного субстрата, и тонкий контроль метаболических механизмов может осуществляться благодаря изменению соотношения изоферментов. В результате происходящих в различные периоды жизни изменений эндогенных и экзогенных факторов путем модуляции активности соответствующих генов может меняться их относительное содержание. Это в свою очередь может влиять на скорости метаболических реакций и, следовательно, на функциональные возможности организма.
| <<< Назад Изменения в содержании ферментов |
Вперед >>> Индукция ферментов |
- Изменения в содержании ферментов
- Изменения регуляции генов
- 9.4.1. Циклические изменения
- Изменения активности генов
- Изменения белков
- Древние изменения большого материка восточного полушария
- Географическое распространение животных и изменения земной поверхности, на которые оно указывает
- Изменения белок-кодирующих генов
- Прежние взгляды на изменения материков
- 7.3. Разнообразие экосистем (биогеоценозов). Саморазвитие и смена экосистем. Выявление причин устойчивости и смены экоси...
- 658. Как реагируют рыбы на сезонные изменения температуры?
- 698. Как влияют изменения температуры на промысел сардины?
