Книга: Рождение сложности. Эволюционная биология сегодня: неожиданные открытия и новые вопросы
Вирусы и мобильные генетические элементы
| <<< Назад Горизонтальный обмен генами |
Вперед >>> Эпигенетическое наследование |
Вирусы и мобильные генетические элементы
Один из способов горизонтального обмена генами, от которого не защищены даже многоклеточные, — это вирусный перенос. Известно, что ДНК вируса может встраиваться в геном клетки-хозяина, а потом снова отделяться от него и формировать новые вирусные частицы, которые могут заражать другие клетки. При этом вместе с собственной ДНК вирус может случайно прихватить и кусочек ДНК хозяина и таким образом перенести этот кусочек в другую клетку, в том числе и в клетку другого организма. В большинстве случаев вирусы, размножающиеся в клетках животных, все-таки не могут пробраться сквозь «барьер Вейсмана» и заразить половые клетки. Но все же иногда вирусная инфекция передается потомству. А ведь это не что иное, как наследование приобретенного признака! И неважно, что от такого признака обычно один только вред. Вирус ведь может прихватить с собой и какой- нибудь полезный кусочек ДНК, да и сами вирусные гены могут «пригодиться» хозяину.
—————
«Прирученные» вирусы — источник эволюционных новшеств. Хотя вероятность того, что встроившийся вирусный геном принесет хозяину пользу, невелика, целый ряд таких случаев уже известен. Например, гены вируса, встроившегося в геном предка узконосых обезьян свыше 40 млн лет назад, нашли себе несколько применений. Они работают у обезьян и человека в плаценте и выполняют там, по всей видимости, сразу три полезные функции. Первая из них — управление слиянием клеток в ходе формирования наружного слоя плаценты. Этот наружный слой состоит из слившихся клеток, и для его образования необходим какой-то способ нарушать целостность клеточных мембран, то есть протыкать их. Вирусные белки хорошо умеют это делать. Вторая функция — защита эмбриона от иммунной системы матери. Вирусные белки — отличные «специалисты» по подавлению активности иммунной системы. Наконец, третья функция состоит в защите эмбриона от «диких» вирусов. Белки «прирученного» вируса прикрепляются к тем поверхностным белкам человеческих клеток, за которые обычно «цепляются» дикие вирусы, чтобы проникнуть в клетку. В результате диким вирусам становится не за что «ухватиться», и они не могут заразить эмбрион.
Другой яркий пример «одомашнивания» вируса описан у наездников — паразитических насекомых, личинки которых развиваются в теле других насекомых, например гусениц. Около 100 млн лет назад предки наездников заразились вирусом и «приручили» его. Геном вируса встроился в геном наездника, и вирусные гены стали помогать насекомому-паразиту бороться с иммунной защитой своих жертв. Самки многих наездников впрыскивают в тело жертвы кроме своих яиц еще и особые «вирусоподобные частицы», внутри которых находятся гены белков, подавляющих иммунитет гусениц. Это позволяет личинкам наездника беспрепятственно развиваться в теле жертвы. Как выяснилось, «вирусоподобные частицы» образуются благодаря деятельности генов прирученного вируса, который давно уже стал неотъемлемой частью генома наездника.
—————
Чуть ли не половина генома человека состоит из мобильных генетических элементов (МГЭ) — транспозонов и ретротранспозонов. У других животных и растений дело обстоит примерно так же. У прокариот мобильных элементов меньше, но тоже очень много. Типичный мобильный элемент представляет собой по сути дела упрощенный вариант вируса. МГЭ обладают всеми характерными свойствами вирусов, кроме одного — инфекционности. Вирусы, как известно, могут свободно переходить из одной хозяйской клетки в другую и передаваться горизонтально, то есть заражать другие организмы. МГЭ более ограничены в своих передвижениях. Они могут активно размножаться и перемещаться в пределах генома — перепрыгивать с места на место, встраиваясь в хозяйские хромосомы в разных местах и влияя на работу близлежащих генов. Они, разумеется, передаются вертикально (от родителей к потомкам, то есть наследуются), а иногда и горизонтально — подобно полноценным вирусам.
Мобильные генетические элементы впервые были обнаружены Барбарой МакКлинток в 1951 году у кукурузы. Однако МГЭ слишком долго считались «генетической экзотикой», их распространенность и эволюционная роль недооценивались, и в результате свою заслуженную Нобелевскую премию за это открытие МакКлинток получила лишь в 1983 году, когда ей самой было уже за 80.
Поначалу эти подвижные вирусоподобные участки генома интерпретировали как «геномных паразитов», «эгоистическую» или «мусорную» ДНК. В последнее время все яснее становится огромная эволюционная роль этих элементов. Они придают геному свойство, которое в зависимости от субъективного восприятия называют либо «нестабильностью», либо «пластичностью». В первом случае подчеркивается потенциальный вред геномных перестроек, индуцируемых МГЭ, во втором — их потенциальная польза, создание материала для отбора, повышение полиморфизма и приспособляемости.
МГЭ придают геному нестабильность не только своими беспорядочными прыжками. Если какому-нибудь транспозону удастся как следует размножиться, это значит, что в геноме появится множество одинаковых фрагментов генетического «текста». А это резко повышает вероятность ошибок в ходе копирования ДНК и рекомбинации. Действительно, сложно не ошибиться при переписывании или редактировании текста, изобилующего повторами.
Но геномные перестройки, индуцируемые МГЭ, не являются хаотичными. Например, многие транспозоны способны встраиваться не в любое место генома, а только туда, где есть определенные «предпочтительные» для данного МГЭ последовательности нуклеотидов. Это делает их передвижения в известной мере предсказуемыми, закономерными. Распределение повторов по геному повышает вероятность не любых, а строго определенных перестроек. Например, участок генома, заключенный между двумя одинаковыми последовательностями (например, между двумя копиями транспозона), с большой вероятностью может быть «потерян» при репликации. Если такая потеря окажется выгодной, она будет поддержана отбором и закрепится в череде поколений, если нет, отбор будет ее отбраковывать, но тем не менее этот участок все равно будет выпадать из генома снова и снова (такое явление наблюдается, например, у возбудителя чумы Yersinia pestis)[95].
Как у бактерий, так и у высших организмов МГЭ могут служить своеобразными «рецепторами стресса», резко активизируя свои прыжки в критических для организма ситуациях и приводя к вспышкам мутагенеза. Это может способствовать приспособляемости видов. Когда условия жизни резко ухудшаются, то это по сути дела означает, что имеющийся у организма геном перестает соответствовать требованиям среды. В этой ситуации рост изменчивости может оказаться единственным возможным выходом (см. главу «Управляемые мутации»). Все это придает эволюционным изменениям, происходящим при участии МГЭ, не совсем случайный характер.
—————
Вирусы и мобильные элементы: кто от кого произошел? Родство вирусов и МГЭ не вызывает сомнений, однако не совсем ясно, кто из них появился раньше и кто от кого произошел. Не исключено, что началось все с мобильных элементов, которые могли просто самозародиться в геномах примитивных организмов, и произойти это могло еще на заре жизни. Постепенно усложняясь, МГЭ в дальнейшем превратились в настоящих вирусов. По крайней мере некоторые типы вирусов, скорее всего, возникли именно таким путем. Это прежде всего ретровирусы, к числу которых относится вирус ВИЧ. Ретровирусы отличаются от остальных вирусов тем, что встраивание в хозяйский геном является обязательной частью их жизненного цикла. Наследственный материал ретровируса хранится в форме РНК. Когда ретровирус попадает в клетку, ее рибосомы начинают синтезировать вирусные белки по «инструкциям», записанным в вирусной РНК. Одним из этих белков является фермент обратная транскриптаза (РНК-зависимая ДНК-полимераза), функция которой состоит в переписывании информации из РНК в ДНК. Этот процесс называется обратной транскрипцией; отсюда и «ретро» в названии вируса. Обратная транскриптаза осуществляет «переписывание» вирусного генома в хозяйские хромосомы.
Ближайшими родственниками ретровирусов являются ретро-транспозоны — мобильные генетические элементы, широко распространенные в геномах эукариот. Ретровирусы, встроившиеся в геном хозяина, и ретротранспозоны очень похожи друг на друга. Те и другие представляют собой фрагменты ДНК, содержащие более или менее стандартный комплект генов, необходимых для собственного копирования и встраивания в хозяйскую ДНК. Гены эти в большинстве своем сходны у ретровирусов и ретротранспозонов. Обе разновидности «ретроэлементов» размножаются при помощи обратной транскрипции, то есть переписывания информации с РНК на ДНК.
Большинство специалистов склоняется к тому, что исторически первыми появились ретротранспозоны, а не ретровирусы. Они проще устроены, и самые простые из них вполне могли «самозародиться» в геномах примитивных организмов в результате случайных мутаций. По-видимому, это произошло еще на уровне прокариот. Ретровирусы, скорее всего, являются результатом некоторого усложнения или, если угодно, «совершенствования» ретротранспозонов. В дальнейшем, конечно, имели место и обратные процессы — ведь ретровирус легко может снова превратиться в ретротранспозон, если потеряет инфекционность в результате какой-нибудь мутации.
—————
По-видимому, многие крупные прогрессивные преобразования в эволюции высших организмов были связаны с активностью МГЭ.
От «прирученного» ретротранспозона ведет свою родословную фермент теломераза, отвечающий за восстановление кончиков хромомосом, которые имеют обыкновение укорачиваться после каждой репликации. Теломераза играет важную роль в процессах старения и в образовании раковых опухолей. Старение связано с низкой активностью теломеразы, рак — со слишком высокой. Для восстановления кончиков хромосом теломераза использует РНК-матрицу и механизм обратной транскрипции. А это не что иное, как главное «ноу-хау» ретротранспозонов и ретровирусов. Теломеразная регуляция — важнейший механизм поддержания целостности сложного многоклеточного организма, в котором ни одна клетка не имеет права делиться, когда ей вздумается.
У мобильных элементов древние позвоночные позаимствовали также и фермент транспозазу, который умеет вырезать и перемещать участки ДНК. Потомки этой транспозазы — белки RAG. Эти белки собирают из кусочков гены антител, по-разному комбинируя фрагменты ДНК в зреющих лимфоцитах. Так достигается огромное разнообразие этих защитных белков при небольшом количестве имеющихся в геноме фрагментов-заготовок (см. главу «Управляемые мутации»). Великолепная иммунная система позвоночных была одной из главных предпосылок их эволюционного успеха. И она, как мы теперь понимаем, является щедрым даром ближайших родственников вирусов.
—————
Древние млекопитающие позаимствовали у ретротранспозона ген, необходимый для развития плаценты. Недавно обнаруженный ген Reg10 мог сыграть важную роль в появлении плацентарных млекопитающих. Об этом свидетельствуют результаты исследований сотрудников Токийского медицинского университета. Ученые показали, что у мышиных эмбрионов с выключенным геном Reg10 нарушается развитие плаценты, отчего эмбрион погибает через 10 дней после зачатия. Внешне плацента такого эмбриона выглядит почти нормально, однако в ней отсутствуют некоторые типы клеток, необходимые для эффективной работы органа.
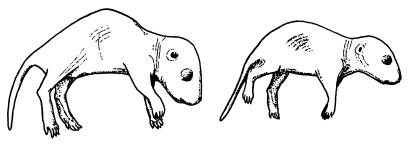
Обычный мышонок (слева) и мышонок с выключенным геном Reg10, которого удалось спасти от верной смерти при помощи пересадки тканей здорового эмбриона.
При помощи чрезвычайно сложных манипуляций, связанных с приживлением к дефектному зародышу эмбриональных клеток с нормально работающим геном Reg10, исследователям удалось спасти нескольких обреченных и вырастить из них взрослых мышей, способных к размножению. Правда, они заметно отставали в развитии. При этом ген Reg10 у них по-прежнему не работал. Тем самым было показано, что ген необходим в первую очередь именно для развития плаценты, хотя может выполнять и ряд других, менее важных функций.
Обнаружение гена, необходимого для развития плаценты, само по себе очень интересно. Появление плаценты позволило продлить внутриутробное развитие, что, в свою очередь, имело далеко идущие эволюционные последствия. Согласно одной из гипотез, именно плацентарность создала предпосылки для увеличения размеров мозга и быстрого «поумнения» млекопитающих, которое началось около 60 млн лет назад и затронуло только плацентарных. Сумчатые и однопроходные (к которым относятся утконос и ехидна), не имеющие плаценты, так и остались тугодумами.
Однако нет никаких оснований говорить, что ген Reg10 «кодирует плаценту». Плацента, хоть и бракованная, развивается и без его помощи. Появление нового эмбрионального органа потребовало согласованных изменений множества разных генов. Reg10 — только один из них.
Интересно другое. Ген Reg10 по своей структуре оказался чрезвычайно сходен с мобильным генетическим элементом — ретротранспозоном Sushi-ichi. По-видимому, предки плацентарных млекопитающих подхватили где-то ретротранспозон, который со временем был «приручен», утратил подвижность, а затем один из его генов был рекрутирован для выполнения новой функции — регуляции развития плаценты.
(Источник: Ono et al. Deletion of Reg10, an imprinted gene acquired from a retrotransposon, causes early embryonic lethality // Nature Genetics. 2006. V. 38. P. 101–106.)
—————
Простейший транспозон устроен еще проще, чем простейший ретротранспозон. Это короткий участок ДНК, на концах которого расположены так называемые обращенные повторы, а в середине имеется ген, кодирующий транспозазу — фермент, необходимый для «размножения» и перемещения мобильного элемента. Обращенные повторы — это последовательности нуклеотидов, комплементарные самим себе (мы помним, что нуклеотид А комплементарен нуклеотиду Т, нуклеотид Г — нуклеотиду Ц). Последовательности, комплементарные сами себе, называют также палиндромами, потому что они «читаются» при транскрипции одинаково в обе стороны. Вот пример генетического палиндрома: AAGCCCAA………TTGGGCTT. Если вместо многоточия «вписать» ген транспозазы, получим модель простейшего транспозона.
В отличие от ретротранспозонов обычные транспозоны не используют для самокопирования механизм обратной транскрипции, поэтому им не нужна обратная транскриптаза.
Чтобы транспозон совершил «прыжок», хозяйская клетка должна для начала прочитать ген транспозазы и синтезировать на его основе белок, то есть саму транспозазу. После этого транспозаза должна найти в хозяйской хромосоме свой транспозон, опознать его по концевым повторам, затем вырезать и вставить в какое-нибудь другое место генома.
Итак, транспозаза умеет делать две вещи: 1. узнавать определенные последовательности ДНК и прикрепляться к ним; 2. вырезать и перемещать фрагменты ДНК.
Оба «навыка» транспозазы могут быть использованы клеткой, когда ей удается приручить какой-нибудь транспозон, то есть сделать его неотъемлемой функциональной частью своего генома. Для подобных процессов даже придумали специальный термин — «молекулярное одомашнивание» (molecular domestication). Транспозон теряет подвижность просто за счет какой-нибудь мутационной «поломки» и начинает выполнять полезную для организма функцию. Мы уже упоминали о том, что способность прирученных транспозаз — RAG-белков — вырезать и перемещать фрагменты ДНК лежит в основе системы приобретенного иммунитета.
Еще больше эволюционных возможностей содержит в себе способность транспозаз распознавать определенные последовательности нуклеотидов ДНК. На специфическом распознавании белками нуклеотидных последовательностей основаны многие важнейшие процессы в живой клетке. Одним из таких процессов является регуляция активности генов при помощи специализированных регуляторных белков — транскрипционных факторов (ТФ). Транскрипционные факторы распознают определенные нуклеотидные последовательности, расположенные в регуляторной области тех или иных генов, присоединяются к ним и тем самым регулируют работу этих генов.
Чрезвычайно любопытно, что концевые обращенные повторы многих мобильных элементов, то есть участки ДНК, распознаваемые транспозазами, порой бывают удивительно похожи по последовательности нуклеотидов на сайты связывания ТФ (участки ДНК, распознаваемые транскрипционными факторами). Между прочим, в сайтах связывания ТФ часто встречаются палиндромные мотивы — последовательности ДНК, читающиеся одинаково в обе стороны.
Это позволяет предположить, что в ходе эволюции прирученные транспозазы могут иногда брать на себя роль транскрипционных факторов, а фрагменты концевых повторов транспозонов, наверное, могут иногда оказываться в таких позициях, где они способны функционировать в качестве сайтов связывания ТФ.
—————
Растения заимствуют гены-регуляторы у «геномных паразитов». В 2007 году был обнаружен первый реальный случай «превращения» прирученной транспозазы в транскрипционный фактор. Открытие было сделано в ходе изучения светочувствительных белков у арабидопсиса — растения из семейства крестоцветных. Как и другие цветковые растения, арабидопсис внимательно следит за освещенностью при помощи сложных молекулярных систем. Это помогает растению оптимизировать свой рост, обмен веществ, выращивать листья и соцветия в «правильное» время.
Важную роль в фоторецепции у цветковых играет белок фитохром А, реагирующий на свет с длиной волны 700–750 нм («дальний красный»). Под действием света фитохром А переходит в биологически активную форму и транспортируется из цитоплазмы в ядро клетки, где он «включает» целый ряд генов, регулирующих цветение и созревание семян. Предполагается, что фитохром А был уже у последнего общего предка цветковых растений и что формирование эффективной светочувствительной регуляторной системы способствовало быстрой экспансии цветковых в меловом периоде.
Светозависимый транспорт фитохрома А в ядро осуществляется при помощи белков FHY1 и FHL. Кроме того, были идентифицированы еще два белка — FHY3 и FAR1, без которых транспорт фитохрома А в ядро нарушается, однако конкретная функция этих белков была до сих пор неизвестна. Именно эти два белка и привлекли внимание исследователей.
Анализ нуклеотидных последовательностей генов FHY3 и FAR1 показал чрезвычайно высокое сходство с генами транспозаз, входящими в состав транспозонов Mutator и Jittery. Оба эти транспозона широко распространены в геномах цветковых растений. Сходство генов FHY3 и FAR1 странспозазами оказалось настолько большим, что говорить о случайности не приходится — это, несомненно, гены «прирученных» транспозаз.
Оказалось, что белки FHY3 и FAR1 необходимы для активации генов FHY1 и FHL. «Прирученные транспозазы» регулируют активность обоих генов не поодиночке, а совместными усилиями. Они проникают в ядро и прикрепляются непосредственно к регуляторной области (промотору) генов FHY1 и FHL, что приводит к резкому росту активности этих генов. Таким образом, «прирученные транспозазы» FHY3 и FAR1 работают как самые настоящие транскрипционные факторы.
Кроме того, исследователи установили, что активность самих генов «прирученных транспозаз» подавляется фитохромом А, поступающим в ядро. В результате образуется контур отрицательной обратной связи, благодаря которому сигнальная система срабатывает при определенной освещенности и затем отключается, а не работает постоянно, как пожарная сирена, пока освещенность не изменится.
Но главное значение этой работы, конечно, в том, что впервые удалось продемонстрировать превращение «прирученных транспозаз» в полноценные транскрипционные факторы. Авторы предполагают, что приручение одного или нескольких транспозонов произошло вскоре после появления цветковых растений (примерно в середине мелового периода, около 100 млн лет назад) и было связано с освоением первыми цветковыми разных широтных зон, то есть местообитаний с разной сезонной динамикой освещенности.
(Источник: Rongcheng Lin, Lei Ding, Claudio Casola, Daniel R. Ripoll, C?dric Feschotte, Haiyang Wang. Transposase-Derived Transcription Factors Regulate Light Signaling in Arabidopsis // Science. 2007. V. 318. P. 1302–1305.)
—————
Данные, указывающие на важную эволюционную роль МГЭ, стали стремительно накапливаться в последние несколько лет. Стало ясно, что многие важные генетические инновации — прежде всего новые регуляторные участки ДНК, управляющие работой соседних генов, — сформировались из фрагментов «прирученных» МГЭ. Но до самого последнего времени не удавалось получить сколько-нибудь точных количественных оценок вклада МГЭ в эволюцию. Поэтому ученые не могли сказать определенно, как все-таки следует относиться к обнаруженным фактам приручения МГЭ — как к типичному и массовому явлению, магистральному направлению эволюции, или все-таки как к экзотике.
Короткохвостый опоссум Monodelphis domestica. Этот маленький южноамериканский зверек стал первым сумчатым млекопитающим, чей геном удалось прочесть. Вторым, скорее всего, будет кенгуру.
Для получения количественных оценок необходим комплексный сравнительный анализ целых геномов. Как известно, в последние годы мировое научное сообщество прилагает огромные усилия для того, чтобы определить нуклеотидные последовательности геномов как можно большего числа живых организмов — от бактерий до млекопитающих. И эти усилия начинают приносить плоды. Первые количественные подтверждения того, что формирование новых регуляторных участков ДНК из фрагментов МГЭ является правилом, а не исключением, были получены в результате прочтения генома маленького южноамериканского сумчатого зверька — серого короткохвостого опоссума.
Геном опоссума был прочтен в мае 2007 года[96]. Этот зверек был выбран для геномных исследований не случайно — он является важным лабораторным объектом, на котором изучают, в частности, регенерацию и формирование злокачественных опухолей. Кроме того, предполагали, что сравнение с геномом сумчатого животного поможет лучше понять прочтенные ранее геномы плацентарных — человека, шимпанзе, макака-резуса, собаки, мыши, крысы. Эти надежды полностью оправдались.
Различия в наборе белок-кодирующих генов между опоссумом и человеком оказались очень невелики. Подавляющее большинство генов опоссума имеют бесспорные человеческие аналоги и наоборот.
В целом в белок-кодирующих областях геномов сумчатых и плацентарных за 180 миллионов лет, прошедших после разделения этих линий, возникло сравнительно мало эволюционных инноваций. По современным представлениям, ведущую роль в эволюции высших организмов должны были играть изменения регуляторных участков генома, которые сами не кодируют белков, но влияют на работу белок-кодирующих генов. Геном опоссума блестяще подтвердил эту теорию.
Сравнительный анализ геномов опоссума, плацентарных и курицы показал, что в эволюции плацентарных подавляющее большинство эволюционных инноваций было связано с появлением новых участков ДНК, которые не кодируют белков, но выполняют важные регуляторные функции. Из всех функционально важных кодирующих участков генома плацентарных лишь около одного процента появились после отделения плацентарных от общего предка с сумчатыми. Что же касается функционально важных некодирующих (то есть регуляторных) последовательностей, то из их числа целых 20% оказались уникальными для плацентарных. Иными словами, скорость появления новых регуляторных участков генома в эволюции плацентарных была в 20 раз выше, чем скорость появления новых кодирующих участков.
У читателя может возникнуть резонный вопрос, почему мы говорим об эволюции плацентарных в связи с прочтением генома опоссума — зверька, относящегося не к плацентарным, а к сумчатым. Дело в том, что только сравнение с геномом опоссума позволило ученым установить, какие из некодирующих последовательностей геномов плацентарных являются новыми, то есть появившимися после разделения эволюционных линий сумчатых и плацентарных. Для того чтобы понять эволюционную роль изменений в некодирующих последовательностях, нужно еще знать, какие из этих последовательностей являются функционально важными, а какие нет. Для плацентарных это можно сделать, сравнивая между собой геномы разных видов: если некодирующий участок сходен, например, у человека и собаки, значит, он, скорее всего, является важным (отбор отбраковывал слишком сильные изменения в этом участке). Для сумчатых этого сделать пока нельзя, поскольку прочтен геном только одного вида сумчатых. Именно поэтому геном опоссума позволил гораздо больше узнать об эволюции плацентарных, чем сумчатых.
Как и следовало ожидать, особенно много новых регуляторных последовательностей у плацентарных появилось в окрестностях генов, кодирующих ключевые регуляторы индивидуального развития, в том числе Hox-генов (см. главу 5). Сами эти гены отличаются повышенной консервативностью — они очень похожи у плацентарных, опоссума и даже курицы. Получается, что изменения в строении организма у плацентарных млекопитающих были обусловлены в основном добавлением новых регуляторов к генам — регуляторам онтогенеза.
Самый яркий результат исследователи получили в ходе изучения происхождения новых регуляторных последовательностей, возникших в ходе эволюции плацентарных. В принципе, эти последовательности могут появляться тремя способами: 1. в результате изменения «до неузнаваемости» каких-то старых, предковых регуляторных последовательностей; 2. в результате дупликации старых регуляторных последовательностей и последующего накопления различий между копиями; 3. заново, из последовательностей, которые у предков были нефункциональными, в том числе из «прирученных» мобильных элементов.
Ранее было выявлено несколько случаев, когда в эволюции позвоночных новые регуляторные последовательности формировались из мобильных генетических элементов. Как мы уже знаем, сама структура МГЭ делает их превосходными «заготовками» для создания новых регуляторных элементов в хозяйском геноме. МГЭ обычно имеют свои собственные регуляторные элементы, например, места прикрепления транспозаз — ферментов, осуществляющих перемещения МГЭ. Эти регуляторные элементы легко могут быть адаптированы для регуляции работы генов хозяйского генома. Однако до сих пор оставалось неясным, являются ли выявленные случаи удачного приручения транспозонов редкими исключениями или общим правилом. Теперь наконец можно с уверенностью сказать: это правило.
Оказалось, что в человеческом геноме как минимум 16% из числа важных регуляторных последовательностей, уникальных для плацентарных, представляют собой участки мобильных элементов. При создании новых регуляторных последовательностей у плацентарных в ход пошли все основные группы транспозонов и ретротранспозонов. Причем вышеупомянутые 16% — это, несомненно, сильно заниженная оценка. Дело в том, что «прирученный», утративший подвижность транспозон в результате накопления мутаций становится неузнаваемым примерно за 100–200 миллионов лет. Сохранится в целости лишь тот его фрагмент, который оказался полезен хозяйскому геному, но этого, скорее всего, будет недостаточно, чтобы распознать в таком фрагменте бывший транспозон. За время, прошедшее с момента обособления плацентарных, эта судьба должна была постигнуть значительную часть прирученных транспозонов.
Таким образом, «одомашнивание» мобильных генетических элементов играет крайне важную роль в эволюции млекопитающих. Скорее всего, это справедливо и для других живых организмов, но чтобы это доказать, необходимы дальнейшие исследования.
Но вернемся к наследованию приобретенных признаков. Связь МГЭ и вирусов с «ламарковскими» механизмами наследования может оказаться еще более тесной, чем принято считать. Можно предположить — пока лишь теоретически, — что при помощи МГЭ высшие организмы могут иногда передавать своему потомству вполне исчерпывающую и адекватную информацию о полезных адаптациях, выработанных ими в течение жизни. По сути дела, это и есть «ламарковское» наследование в чистом виде и без всяких оговорок, в том самом смысле, какой вкладывал в это понятие сам Ламарк.
Эта смелая гипотеза была предложена и подробно обоснована австралийским иммунологом Э. Стилом и его коллегами[97]. Мы помним из главы «Управляемые мутации», как лимфоциты млекопитающих производят гены новых защитных белков-антител в ходе выработки приобретенного иммунитета. Для этого исходные генетические заготовки сначала комбинируются разными способами, а затем подвергаются интенсивному мутированию и отбору. Таким образом формируется новый ген, обеспечивающий защиту против какой-нибудь инфекции — например, против новой болезнетворной бактерии. Выработка приобретенного иммунитета требует времени, и не всегда организм успевает справиться с этой задачей. Против некоторых самых опасных возбудителей было бы выгодно иметь врожденный иммунитет, а не приобретать его каждый раз заново при столкновении с инфекцией. Собственно говоря, именно этот «недостаток» нашей иммунной системы и пытается восполнить современная медицина, осуществляя вакцинацию людей и домашних животных. Если бы генетические изменения, возникающие в лимфоцитах при выработке приобретенного иммунитета, могли иногда передаваться потомству, это было бы аналогично естественной, природной вакцинации последующих поколений.
Но как такое может произойти? Ведь для этого новый вариант защитного гена, сформировавшийся в лимфоцитах, должен быть перенесен в половые клетки и встроен в их геном. Кто или что может служить переносчиком генов из лимфоцитов в половые клетки? По мнению Стила, на роль таких переносчиков идеально подходит одна из разновидностей МГЭ, которой буквально кишат геномы млекопитающих, — так называемые эндогенные ретровирусы. Это геномы ретровирусов, которым когда-то удалось встроиться в геном половых клеток, или «продвинутые» ретротранспозоны, способные к образованию вирусоподобных частиц. Грань между сложными ретротранспозонами и простыми ретровирусами весьма условна. Эндогенные ретровирусы, разумеется, передаются по наследству точно так же, как любые другие участки генома. При этом они сохраняют способность «оживать», то есть упаковывать свой геном в белковую оболочку (капсид) и переходить из клетки в клетку. Вместе со своими собственными генами обратной транскриптазы, интегразы, капсидного белка эндогенные ретровирусы могут прихватывать с собой и «чужие» молекулы РНК, считанные с каких-нибудь других генов. Например, с гена нового антитела, если дело происходит в лимфоците.
Покинув лимфоцит, такой эндогенный ретровирус в принципе может с током крови добраться до половых клеток и проникнуть в них. Здесь в соответствии с «инструкциями», записанными в вирусной РНК, будут синтезированы ферменты обратная транскриптаза и интеграза. Первая произведет ДНКовые копии вирусных генов, а заодно и гена нового антитела; вторая встроит эти фрагменты ДНК в геном половой клетки. Таким образом новый защитный ген будет передан потомству. При выполнении некоторых дополнительных условий это может привести к тому, что потомство будет с самого начала иметь повышенную устойчивость к какой-то инфекции.
Самое интересное, что если бы эта гипотеза оказалась верной и такой механизм наследования удалось бы продемонстрировать экспериментально, то тем самым была бы подтверждена «крамольная» и всеми позабытая дарвиновская теория пангенеза, о которой мы говорили в начале главы. Нетрудно заметить, что эндогенные ретровирусы, выступающие в роли переносчиков информации о приобретенных признаках в половые клетки, совершенно идентичны геммулам, или пангенам, о существовании которых говорил Дарвин.
Как от теоретических геммул перейти к реальным агентам приобретенного наследования? В этом нам помогут, например, ретропсевдогены, присутствующие в большом количестве в геномах эукариот. Ретропсевдоген — это последовательность нуклеотидов, идентичная кодирующей части какого-нибудь гена, обычно неактивная, неработающая, которая возникла в результате деятельности обратной транскриптазы. Ее нетрудно отличить от «настоящего» гена по отсутствию интронов — некодирующих вставок, которые есть в большинстве генов высших организмов.
Ретропсевдоген образуется так. Сначала с обычного гена «считывается» матричная РНК (мРНК). Считывается все подряд — и кодирующие участки (экзоны), и вставленные между ними интроны. Затем интроны удаляются, а кодирующие участки сшиваются друг с другом (этот процесс посттранскрипционной обработки РНК называется сплайсингом). В результате образуется «зрелая мРНК». На ее основе синтезируется белок.
Если же зрелая мРНК с удаленными интронами «попадется под руку» обратной транскриптазе, то она может синтезировать ДНКовую копию этой РНК и встроить ее в какую-нибудь хромосому. Так и возникают ретропсевдогены. Они обычно не работают, но не потому, что лишены интронов, а потому, что рядом с ними не оказывается подходящих регуляторных участков ДНК — промоторов. Если около гена нет промотора, ферменту РНК-полимеразе просто не к чему прикрепиться, и ген не может быть прочитан. Впрочем, иногда ретропсевдогену может «повезти», и он случайно окажется рядом с промотором в результате какой-нибудь геномной перестройки. Известен ряд случаев, когда ретропсевдогены становились работающими генами.
Существование ретропсевдогенов доказывает, что обратная транскриптаза действительно может «переписывать» в геном половых клеток информацию, содержащуюся в молекулах РНК, считанных с различных генов. Это означает, что у животных есть все составные части предполагаемого механизма «пангенеза». Теоретически дарвиновские геммулы имеют право на существование. Они вполне могли бы работать и обеспечивать наследование приобретенных признаков «по Ламарку». Загвоздка лишь в том, что они, по-видимому, в действительности делают это крайне редко. Почему? Скорее всего, просто потому, что это бесперспективно. От всех инфекционных агентов, которые существуют сейчас и могут появиться в будущем, все равно нельзя запастись готовыми, наследуемыми антителами. Любой организм сталкивается в течение жизни с тысячами и миллионами разных возбудителей, и если бы каждое новое антитело «переписывалось» в геном половых клеток, геном оказался бы неимоверно раздут, а это, как мы знаем, ведет к росту «непроизводительных расходов» для каждой клетки организма (см. раздел «Происхождение птиц» в главе 6). Развитие системы приобретенного иммунитета — способности вырабатывать любые антитела в течение жизни — было величайшим эволюционным достижением, а закрепление в геноме потомства каждого удачного антитела было бы тупиковым путем.
| <<< Назад Горизонтальный обмен генами |
Вперед >>> Эпигенетическое наследование |
- 16.3. Генетические допинги в спорте
- 4.8. ЭЛЕМЕНТЫ ВО ВСЕЛЕННОЙ
- Животные держат мобильные генетические элементы под контролем
- Генетические методы и проблемы разведения домашних животных
- Биогенные элементы в движении
- Эгоистичные гены, мусорная ДНК и мобильные элементы
- Лес жизни и почти универсальные филогенетические деревья
- 3.4. Генетика, ее задачи. Наследственность и изменчивость – свойства организмов. Основные генетические понятия
- Химические элементы и вещества
- 2. Элементы развития у одноклеточных
- 427. Какие химические элементы содержатся в морской воде в наибольших количествах?
- 433. Какие элементы содержатся в океане в больших количествах, чем на суше?
