Книга: От атомов к древу. Введение в современную науку о жизни
Знакомство с нуклеотидами
| <<< Назад Нуклеозиды |
Вперед >>> 8. Нуклеиновые кислоты |
Знакомство с нуклеотидами
Теперь отвлечемся на время от нуклеозидов и познакомимся поближе с одним важным понятием, которое мы, в общем-то, уже знаем.
Существует химическая реакция под названием фосфорилирование: присоединение фосфата к любому соединению, в котором есть гидроксильная группа, с образованием сложного эфира фосфорной кислоты. Мы уже встречались с этой реакцией, когда говорили о фосфолипидах: там фосфорилированию подвергался глицерин и получался глицерофосфат (см. главу 5). Фосфолипиды, из которых состоит клеточная мембрана, образуются как раз этим путем.
На самом деле объектами фосфорилирования бывают самые разнообразные молекулы, несущие гидроксильные группы. Это могут быть белки (особенно такие, где есть серин, треонин или тирозин — фосфат присоединяется именно к этим аминокислотным остаткам), могут быть спирты (например, тот же глицерин), а могут быть и сахара, благо уж в них-то гидроксильных групп сколько угодно. Фосфорилирование — это универсальный биохимический «оператор», способный предсказуемо менять свойства разных молекул. Есть специальная большая группа ферментов, занимающихся только фосфорилированием, — они называются киназами.
Напомним еще раз, что «фосфорная кислота» и «фосфат» — в биохимии практически одно и то же. Фосфорная кислота в водном растворе всегда диссоциирует, то есть отдает протоны, превращаясь в анион. Но в формулы ее часто вписывают в недиссоциированном виде — просто для удобства, чтобы не обозначать заряды. Кроме того, при реальном фосфорилировании, происходящем в живой клетке, остаток фосфата чаще всего не приходит в свободном виде из раствора, а передается от специального переносчика. Но в упрощенных записях реакций это может и не отображаться.
Нуклеозид, фосфорилированный по сахару, называется нуклеотидом (см. рис. 7.5). Фосфорилирование нуклеозидов, как правило, идет по пятому углеродному атому сахара, через присоединенную к этому атому гидроксильную группу. Итак, нуклеотид — это молекула, состоящая из азотистого основания, пятиуглеродного сахара (рибозы или дезоксирибозы) и фосфата.
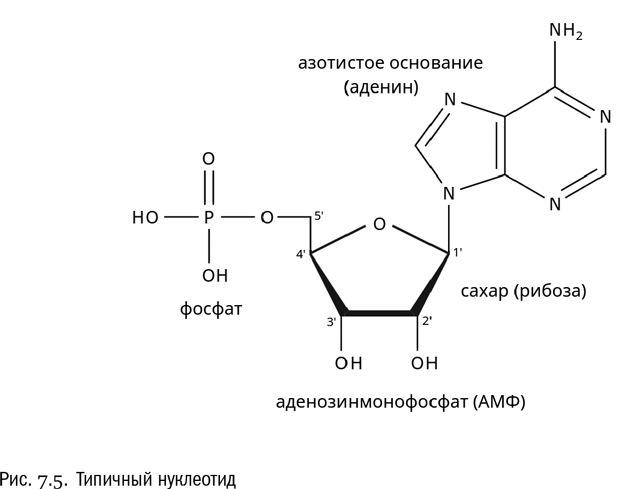
Правило образования названий нуклеотидов таково: название нуклеотида = название нуклеозида + числительное + фосфат. Числительное нужно обязательно, потому что к фосфату могут присоединяться еще фосфаты, как бы последовательно фосфорилирующие друг друга, — всего их бывает до трех штук. Если фосфат один, то числительное — «моно», если два — «ди», если три — соответственно «три». Например, если один раз фосфорилировать аденозин, то получится аденозинмонофосфат (АМФ). Кроме того, если входящий в состав нуклеотида сахар не рибоза, а дезоксирибоза, то ко всему названию добавляется приставка «дезокси».
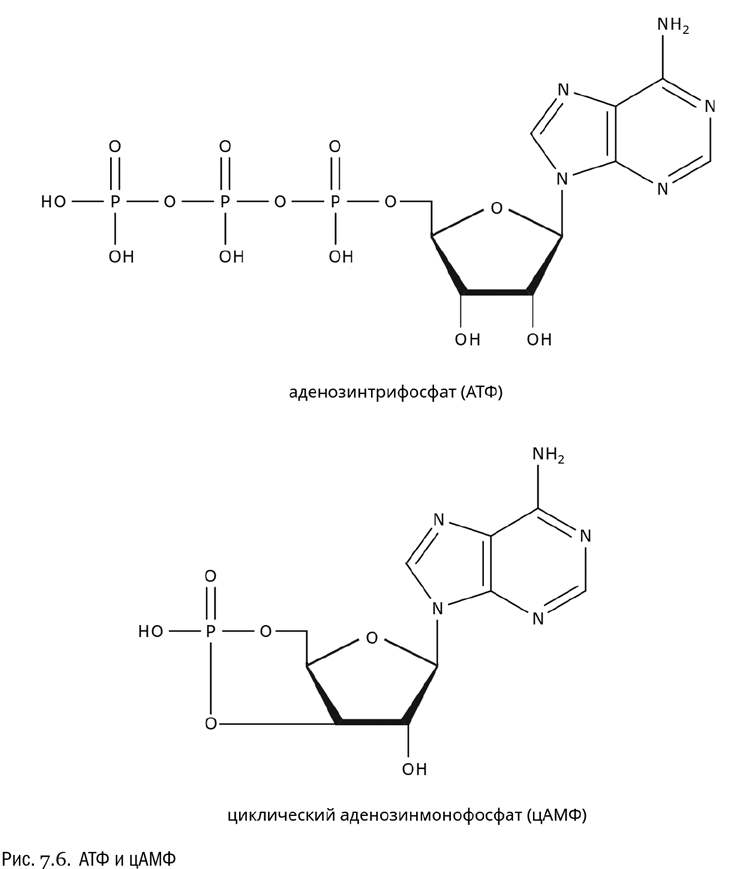
Один из самых интересных нуклеотидов — аденозинтрифосфат (АТФ, см. рис. 7.6). Иногда его называют аденозинтрифосфорной кислотой, но название «аденозинтрифосфат» используется чаще. В растворе, заполняющем клетку, АТФ находится в виде аниона, так что фактически это не кислота, а соль. Как видно из названия, эта молекула состоит из аденина, рибозы и трех остатков фосфата.
АТФ может распадаться с участием воды на аденозиндифосфат (АДФ) и обычную фосфорную кислоту. При этом высвобождается довольно много энергии, которая может быть использована для любых внутриклеточных процессов — таких, например, как синтез полимеров, транспорт веществ или мышечное сокращение. При превращении АДФ в АТФ энергия, наоборот, поглощается молекулой последнего и запасается в ней. В целом получается обратимая реакция, которую можно записать очень просто:
АТФ + H2O (вода) ? АДФ + H3PO4 (фосфат) + энергия
Это и есть простейшая схема оборота АТФ в живой клетке. И это — процесс, от которого напрямую зависит все наше существование.
Фермент, превращающий АДФ в АТФ и тем самым запасающий в молекуле АТФ энергию, называется АТФ-синтазой. Фермент, расщепляющий АТФ до АДФ и использующий высвобожденную энергию для какой-нибудь работы, называется АТФазой. Эти названия ни в коем случае не надо путать — они относятся к строго противоположным процессам. За сутки в организме человека синтезируется, по разным подсчетам, от 40 до 75 килограммов химически чистого АТФ. Но он не накапливается, а почти сразу расщепляется обратно до АДФ, расходуясь в качестве «топлива». Как запасное вещество АТФ не используется, потому что его слишком неудобно хранить. Среднее время жизни отдельно взятой молекулы АТФ — меньше одной минуты. С другой стороны, запаса АТФ, имеющегося в каждый данный момент, любой живой клетке хватит не больше чем на несколько секунд, так что он должен постоянно синтезироваться заново. Именно синтез АТФ является главным конечным результатом процессов получения энергии — таких, например, как дыхание.
В 1939 году известные биохимики Владимир Александрович Энгельгардт и Милица Николаевна Любимова совершили поразительное открытие. Их интересовала биохимия мышечного сокращения, и они сумели выделить из клеток мышечный белок — миозин, — конденсированный в виде нитей. Дальше оказалось, что если поместить эти нити в раствор АТФ, то происходят одновременно два процесса. Во-первых, АТФ расщепляется до АДФ и фосфата, надо полагать — под действием миозина. А во-вторых, нити миозина при этом… укорачиваются. Во всяком случае, существенно уменьшается максимальная длина, до которой их можно растянуть.
Так была открыта АТФазная активность миозина. И заодно было очень наглядно показано, что энергия, высвобожденная при расщеплении АТФ, может тут же «конвертироваться» в механическую работу. Правда, на самом деле чистого миозина для этого недостаточно, нужен как минимум еще один белок — актин. Но в принципе Энгельгардт и Любимова все поняли абсолютно верно. Их открытие, кстати, было сразу же оценено современниками: в 1943 году авторы получили за него высшую тогда в СССР награду — Сталинскую премию.
Любая АТФаза является белком, который, расщепляя АТФ, за счет высвобожденной при этом энергии одновременно совершает работу (не обязательно механическую: с тем же успехом это может быть перенос веществ через клеточную мембрану или какой-нибудь энергоемкий синтез). Если белки-АТФазы — аналоги маленьких двигателей, то АТФ служит для клетки самым настоящим топливом.
Иногда связи между остатками фосфата в формуле АТФ обозначают не прямой черточкой, как обычные ковалентные связи, а волнистой (~). Это предложенное немецким биохимиком Фрицем Липманом обозначение тех связей, при разрыве которых, собственно, и выделяется достаточно большая по биохимическим меркам энергия. Такие связи называются высокоэнергетическими или макроэргическими. АТФ — не единственное вещество с макроэргическими связями, но, безусловно, самое распространенное. Это энергетическая «разменная монета» живой клетки.
Во избежание недоразумений надо сказать, что количество энергии, высвобождаемое при разрыве макроэргической связи в АТФ, на самом деле вовсе не является каким-то потрясающе огромным. Как раз наоборот, по меркам обычной химии, особенно неорганической, оно скорее невелико. Это объясняется очень просто: слишком большую разовую порцию энергии клетке было бы труднее пустить в дело.
Фермент аденилатциклаза может превратить АТФ в другое интересное соединение — циклический аденозинмонофосфат (цАМФ). Это довольно странно выглядящая молекула, где один и тот же фосфат связан сразу с двумя гидроксилами рибозы (третьим и пятым). Ни для переноса энергии, ни для построения каких-либо более сложных соединений цАМФ не годится. Зато это важное сигнальное вещество, служащее посредником при передаче информации внутри клеток, а иногда и между клетками.
Например, цАМФ может через цепочку посредников запустить процесс распада нерастворимого гликогена до растворимой глюкозы — это существенно ускоряет обмен веществ (см. главу 6). Для того чтобы этот эффект не длился слишком долго, существует фермент фосфодиэстераза, который разрывает в молекуле цАМФ фосфатный мостик и превращает его в безобидный обычный АМФ, лишенный сигнальных функций. Благодаря этому ферменту молекулы цАМФ в клетках быстро расщепляются, и мы избегаем перерасхода энергии. А самым распространенным блокатором фосфодиэстеразы является не что иное, как уже знакомый нам кофеин. Это еще один способ, которым кофеин может действовать на организм. Тут мы имеем дело с типичным случаем конкурентного ингибирования, когда активный центр фермента «запирается» молекулой, близкой по структуре к нормальному субстрату этого фермента, но слегка отличающейся от него (см. главу 3). Именно такой молекулой кофеин и служит. Правда, на фосфодиэстеразу кофеин действует только в огромных концентрациях, которые в организме достигаются редко. Так что развенчивать кофеин, лишая его статуса психоактивного вещества, не стоит: в первую очередь он действует все-таки на аденозиновые рецепторы, которые сидят на нервных клетках.
| <<< Назад Нуклеозиды |
Вперед >>> 8. Нуклеиновые кислоты |
- Часть первая. Знакомство с микроорганизмами
- ПЕРВОЕ ЗНАКОМСТВО
- В обсерватории Знакомство с телескопом
- Глава 1 Знакомство с динозаврами
- Часть I Знакомство с пятым измерением
- Знакомство с анатомией скелета тираннозавров
- Первое знакомство
- Знакомство с Аристотелем
- Знакомство сугубо утилитарное
- Знакомство с Афганистаном
- Глава 1. Первое знакомство
- § 44. Строение клетки
