Книга: Популярная библиотека химических элементов. Книга первая. Водород — палладий
Зачем нужен хлор
| <<< Назад Как получают хлор |
Вперед >>> АРГОН |
Зачем нужен хлор
Все многообразие практического применения хлора можно без особой натяжки выразить одной фразой: хлор необходим для производства хлорпродуктов, т. е. веществ, содержащих «связанный» хлор. А вот говоря об этих самых хлорпродуктах, одной фразой не отделаешься. Они очень разные — и по свойствам, и по назначению.
Рассказать обо всех соединениях хлора не позволяет ограниченный объем нашей статьи, но без рассказа хотя бы о некоторых веществах, для получения которых нужен хлор, наш «портрет» элемента № 17 был бы неполным и неубедительным.
Как это ни странно, много хлора тратится на производство хлоридов, хотя именно из хлорида — каменной соли — получается сам хлор. Но хлорид хлориду рознь. Многие хлориды — натрия, калия, магния, кальция, меди, серебра, ртути и т. д. — существуют в природе. Но не всегда в тех формах и в том количестве, которые нужны современной промышленности. Другие же приходится получать, воздействуя хлором на соединения соответствующих элементов ради того, чтобы таким обходным путем выделить из сырья и полупродуктов чрезвычайно важные для современной техники цветные металлы и полупроводниковые материалы.
Большинство хлоридов — твердые кристаллические вещества, а вот хлориды фосфора PCl3, кремния SiCl4, германия GeCl4 — жидкости. Последние два очень важны для производства полупроводниковых кремния и германия. Тетрахлорид титана TiCl4 — тоже жидкость — служит исходным продуктом для получения металлического титана, а насколько важен сейчас этот металл, вряд ли нужно объяснять.
Много хлора идет и на нужды промышленности основного органического синтеза. Широко применяются хлорированные углеводороды, не утратили значения хлорорганические инсектициды.
Если попросить любого школьника перечислить известные ему пластики, он одним из первых назовет поливинилхлорид (иначе, винипласт). С точки зрения химика, ПВХ (так часто поливинилхлорид обозначают в литературе) — это полимер, в молекуле которого на цепочку углеродных атомов «нанизаны» атомы водорода и хлора:
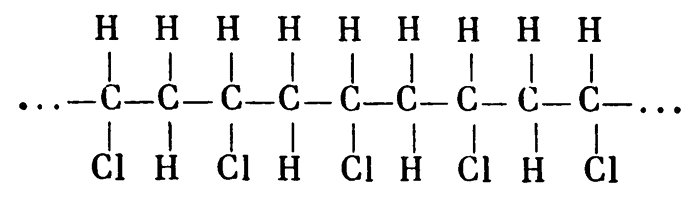
В этой цепочке может быть несколько тысяч звеньев.
А с потребительской точки зрения ПВХ — это изоляция для проводов и плащи-дождевики, линолеум и граммпластинки, защитные лаки и упаковочные материалы, химическая аппаратура и пенопласты, игрушки и детали приборов.
Поливинилхлорид образуется при полимеризации винилхлорида, который чаще всего получают, обрабатывая ацетилен хлористым водородом: HC?CH + HCl ? CH2=CHCl. Существует и другой способ получения винилхлорида — термический крекинг дихлорэтана: CH2Cl—CH2Cl ? СН2=СHCl + HCl. Представляет интерес сочетание двух этих методов, когда в производстве винилхлорида по ацетиленовому способу используют HCl, выделяющийся при крекинге дихлорэтана.
Хлористый винил — бесцветный газ с приятным, несколько пьянящим эфирным запахом, легко полимеризуется. Для получения полимера жидкий винилхлорид под давлением нагнетают в теплую воду, где он дробится на мельчайшие капельки. Чтобы они не сливались, в воду добавляют немного желатины или поливинилового спирта, а чтобы начала развиваться реакция полимеризации, туда же вводят инициатор полимеризации — перекись бензоила. Через несколько часов капельки затвердевают, и образуется суспензия полимера в воде. Порошок полимера отделяют на фильтре или на центрифуге.
Полимеризация обычно происходит при температуре от 40 до 60°С, причем, чем ниже температура полимеризации, тем длиннее образующиеся полимерные молекулы.
* * *
Мы рассказали только о двух веществах, для получения которых необходим элемент № 17. Только о двух из многих сотен. Подобных примеров можно привести очень много. И все они говорят о том, что хлор — это не только ядовитый и опасный газ, но очень важный, очень полезный элемент.
ЭЛЕМЕНТАРНЫЙ РАСЧЕТ. При получении хлора электролизом раствора поваренной соли одновременно получаются водород и едкий натр: 2NaCl + 2H2O = H2 + Cl2 + 2NaOH. Конечно, водород — очень важный химический продукт, но есть более дешевые и удобные способы производства этого вещества, например конверсия природного газа… А вот едкий натр получают почти исключительно электролизом растворов поваренной соли — на долю других методов приходится меньше 10%. Поскольку производства хлора и NaOH полностью взаимосвязаны (как следует из уравнения реакции, получение одной грамм-молекулы — 71 г хлора — неизменно сопровождается получением двух грамм-молекул — 80 г электролитической щелочи), зная производительность цеха (или завода, или государства) по щелочи, можно легко рассчитать, сколько хлора он производит. Каждой тонне NaOH «сопутствуют» 890 кг хлора.
НУ И СМАЗКА! Концентрированная серная кислота — практически единственная жидкость, не взаимодействующая с хлором. Поэтому для сжатия и перекачивания хлора на заводах используют насосы, в которых роль рабочего тела и одновременно смазки выполняет серная кислота.
ПСЕВДОНИМ ФРИДРИХА ВЕЛЕРА. Исследуя взаимодействие органических веществ с хлором, французский химик XIX в. Жан Дюма сделал поразительное открытие: хлор способен замещать водород в молекулах органических соединений. Например, при хлорировании уксусной кислоты сначала один водород метильной группы замещается на хлор, затем другой, третий… Но самым поразительным было то, что по химическим свойствам хлоруксусные кислоты мало чем отличались от самой уксусной кислоты. Обнаруженный Дюма класс реакций был совершенно необъясним господствовавшими в то время электрохимической гипотезой и теорией радикалов Берцелиуса[9]. Берцелиус, его ученики и последователи бурно оспаривали правильность работ Дюма. В немецком журнале «Annalen der Chemie und Pharmacie» появилось издевательское письмо знаменитого немецкого химика Фридриха Вёлера под псевдонимом S. С. Н. Windler (по-немецки «Schwindler» значит «лжец», «обманщик»). В нем сообщалось, что автору удалось заместить в клетчатке (C6H10O5), все атомы углерода, водорода и кислорода на хлор, причем свойства клетчатки при этом не изменились. И что теперь в Лондоне делают теплые набрюшники из ваты, состоящей… из чистого хлора:
ХЛОР И ВОДА. Хлор заметно растворяется в воде. При 20°С в одном объеме воды растворяется 2,3 объема хлора. Водные растворы хлора (хлорная вода) — желтого цвета. Но со временем, особенно при хранении на свету, они постепенно обесцвечиваются. Объясняется это тем, что растворенный хлор частично взаимодействует с водой, образуются соляная и хлорноватистая кислоты: Cl2 + H2O ? HCl + HOCl. Последняя неустойчива и постепенно распадается на HCl и кислород. Поэтому раствор хлора в воде постепенно превращается в раствор соляной кислоты.
Но при низких температурах хлор и иода образуют кристаллогидрат необычного состава — Cl2?53/4H2O. Эти зеленовато-желтые кристаллы (устойчивые только при температурах ниже 10°С) можно получить, пропуская хлор через воду со льдом. Необычная формула объясняется структурой кристаллогидрата, а она определяется в первую очередь структурой льда. В кристаллической решетке льда молекулы H2O могут располагаться таким образом, что между ними появляются закономерно расположенные пустоты. Элементарная кубическая ячейка содержит 46 молекул воды, между которыми есть восемь микроскопических пустот. В этих пустотах и оседают молекулы хлора. Точная формула кристаллогидрата хлора поэтому должна быть записана так: 8Сl2?46Н2O.
ОТРАВЛЕНИЕ ХЛОРОМ. Присутствие в воздухе уже около 0,0001% хлора раздражающе действует на слизистые оболочки. Постоянное пребывание в такой атмосфере может привести к заболеванию бронхов, резко ухудшает аппетит, придает зеленоватый оттенок коже. Если содержание хлора в воздухе составляет 0,1%, то может наступить острое отравление, первый признак которого — приступы сильнейшего кашля. При отравлении хлором необходим абсолютный покой; полезно вдыхать кислород или аммиак (нюхая нашатырный спирт), или пары спирта с эфиром. По существующим санитарным нормам содержание хлора в воздухе производственных помещений не должно превышать 0,001 мг/л, т. е. 0,00003%.
HE ТОЛЬКО ЯД. «Что волки жадны, всякий знает». Что хлор ядовит — тоже. Однако в небольших дозах ядовитый хлор иногда может служить и противоядием. Так, пострадавшим от сероводорода дают нюхать нестойкую хлорную известь. Взаимодействуя, два яда взаимно нейтрализуются.
АНАЛИЗ НА ХЛОР. Для определения содержания хлора пробу воздуха пропускают через поглотители с подкисленным раствором иодистого калия. (Хлор вытесняет под, количество последнего легко определяется фильтрованием с помощью раствора Na2S2O3.) Для определения микроколичеств хлора в воздухе часто применяется колориметрический метод, основанный на резком изменении окраски некоторых соединений (бензидина, ортотолуидина, метилоранжа) при окислении их хлором. Например, бесцветный подкисленный раствор бензидина приобретает желтый цвет, а нейтральный — синий. Интенсивность окраски пропорциональна количеству хлора.
| <<< Назад Как получают хлор |
Вперед >>> АРГОН |
- Межклеточное вещество
- 04. На что влияет нагрев планет звездами, звезд Ядрами Галактик, Ядер Галактик Ядрами Сверхгалактик
- Список литературы
- Разные человечества
- Красные тучи, закрывающие солнце
- Московская белая
- Муравей, семья, колония
- Примерные рационы для котят от месяца до пяти и старше
- Голосеменные растения завоевывают мир
- Пароль скрещенных антенн
- Позор страны
- Что такое водопад?
