Книга: Мусорная ДНК. Путешествие в темную материю генома
Может ли нас спасти мусорная ДНК?
| <<< Назад Глава 19. Иногда лекарства все-таки действуют |
Вперед >>> Иногда все кончается хорошо |
Может ли нас спасти мусорная ДНК?
Вот почему поиск новых подходов к медикаментозному лечению вызывает такой большой интерес. Вот почему так важно все больше узнавать о мусорной ДНК. Используя длинные некодирующие РНК или малые РНК, теоретически возможно избирательно воздействовать на биологические пути, на которые нельзя повлиять с помощью традиционных препаратов, где основой служат малые молекулы или антитела. И неважно, что мишени воздействия таятся внутри клеток и имеют обширные плоские поверхности. Неважно, что нам понадобится — усиливать экспрессию или менять особенности функционирования белка или гена. Можно применить этот новый подход для работы с любым типом клеточных мишеней.
Теоретически.
В том-то и дело. Теоретически. Идеи встречаются часто, а вот их успешное воплощение — куда реже. Так что имеет смысл хорошенько разобраться в реальном положении вещей, прежде чем все мы начнем вкладывать свои сбережения в какую-нибудь новомодную биотехнологическую компанию, орудующую в этой сфере. Уже сейчас здесь происходит очень много всего2, поэтому сосредоточимся на некоторых наиболее выдающихся примерах.
Печень вырабатывает белок, отвечающий за распространение по организму ряда других молекул. Во всем мире живет около 50 тысяч человек, унаследовавших мутацию гена, кодирующего этот белок. Собственно, встречается масса разновидностей такой мутации, но все они, судя по всему, дают схожий эффект — изменяют особенности функционирования белка, да так, что он начинает служить переносчиком не тех молекул[74],3.
Когда такое происходит, в тканях постепенно скапливаются отложения, состоящие из смеси нормального и мутантного белка. Больные страдают от целого ряда симптомов — в зависимости от того, какие ткани затронуты. Примерно в 80% известных случаев сильнее всего затронуто сердце, что приводит к потенциально летальным сердечным дефектам. В остальных 20% случаев отложения часто скапливаются в нервах и спинном мозге. Это может приводить к нарушению функционирования самых разных органов — в частности, к возникновению аномальных и болезненных реакций на слабые раздражители.
Компания Alnylam создала на основе малой РНК, прикрепленной к молекулам из группы сахаров, средство, которое можно вводить пациентам при помощи инъекций. Малая РНК связывается с нетранслируемой областью на конце информационной РНК, кодирующей белок, который мутирует при данном заболевании. Это обрекает данную информационную РНК на уничтожение.
В 2013 году компания обнародовала сведения о второй стадии клинических испытаний своего препарата. После введения средства у пациентов наблюдалось резкое падение уровня циркуляции мутантной и нормальной версий белка, причем этот пониженный уровень долгое время оставался неизменным4. Обнадеживает. Но пока нельзя считать, что новое средство исцеляет от данной болезни. Есть предположения, что такое резкое снижение уровня циркуляции белка приведет к тому, что отложения в тканях будут накапливаться медленнее, что должно привести по крайней мере к замедлению развития заболевания. Но мы пока не знаем, так ли это на самом деле. Требуются более масштабные испытания, в ходе которых будут отслеживаться реальные симптомы и реальное развитие болезни. Только если окажется, что новое лекарство влияет и на то, и на другое, препарат можно будет считать эффективным.
Еще одна компания, Mirna Therapeutics, создала малую РНК, которая подражает действию другой, играющей важную роль в онкологических процессах. Эндогенная малая РНК, естественным путем вырабатываемая в организме, подавляет развитие злокачественных опухолей. Ее функция состоит в том, чтобы сдерживать размножение клеток. Она добивается этого, ослабляя экспрессию по меньшей мере 20 других генов, пытающихся заставить клетку делиться. Экспрессия этой малой РНК часто ослаблена у больных раком (или вообще сведена к нулю), что снимает тормоза с процессов клеточного деления. Исследователи надеются, что при введении аналога этой РНК в клетки больных удастся восстановить нормальную картину генетической регуляции, и раковые клетки перестанут размножаться так стремительно.
Компания испытала свою РНК на больных раком печени. Пока проводятся лишь испытания, цель которых — показать, какие дозы лекарства пациент способен перенести. Пройдет еще некоторое время, прежде чем мы узнаем, принесет ли эта методика положительные клинические результаты5.
В препаратах, разрабатываемых компаниями Alnylam и Mirna Therapeutics, кроется одна хитроумная идея. Среди проблем, с которыми прежде сталкивались фармацевтические фирмы, пытаясь разработать лекарства на основе нуклеиновых кислот, едва ли не самой большой проблемой считалась детоксикационная способность самого организма. Впрочем, с традиционными лекарствами часто та же история. Упрощенно говоря, когда в организм попадает новое вещество любого типа, весьма вероятно, что оно отправится в печень. Одна из главных задач этого чрезвычайно энергичного органа — проводить детоксикацию всего, чей вид ему не нравится. На протяжении всей нашей эволюционной истории этот процесс нам очень помогал, защищая нас от токсинов, которые могут содержаться в пище. Однако проблема в том, что печень не обладает инструментами, позволяющими ей отличать яды, которых мы хотели бы избежать, от лекарств, которые мы пытаемся использовать. Печень просто затащит их в себя и попытается уничтожить — вне зависимости от того, с ядом или с лекарством она имеет дело.
Alnylam и Mirna Therapeutics, если использовать старинное изречение, обратили неизбежность в доблесть[75]. Alnylam таргетирует экспрессию белка, который вырабатывается в печени. Mirna Therapeutics разрабатывает средства для лечения рака печени. В том и в другом случае молекулы лекарств будут захватываться как раз тем органом, в который их и хотят ввести. Компании подбирают особенности структуры и упаковки этих молекул так, чтобы после попадания в печень молекулы просуществовали достаточно долго и успели выполнить свою работу. Для ряда других заболеваний также предлагались методики лечения, связанные с малыми РНК. Предварительные эксперименты, которые проводятся на выращиваемых в лаборатории клетках или на животных, часто демонстрируют обнадеживающие результаты. Но для заболеваний, при которых нуклеиновые кислоты должны избегать печени и сразу захватываться мозгом (например, при боковом амиотрофическом склерозе6), пока не совсем понятно, сумеет ли медицина успешно применить такую технологию на практике.
В главе 17 мы видели, как померкли надежды на успешное внедрение многообещающего метода лечения мышечной дистрофии Дюшенна после того, как неожиданно окончились неудачей клинические испытания, проводившиеся на пациентах, чья болезнь достигла поздней стадии. При разработке этого подхода использовали особую разновидность мусорной ДНК — антисмысловую.
Мусорные антисмысловые РНК, вероятно, распространены в нашем геноме очень широко, и причина здесь — в двунитевом строении ДНК. Мы уже затрагивали этот вопрос в главе 7, где обсуждали Xist и его антисмыслового двойника — Tsix. (Мы использовали аналогию со словом ТОРГ, которое можно прочесть задом наперед, получив слово ГРОТ.) Все зависит от того, как ферменты, делающие РНК-копии на основе ДНК, будут вести считывание: будут они считывать определенную нить слева направо или противоположную ей нить справа налево.
Однако большинство слов нельзя читать в обоих направлениях, оба раза получая что-то осмысленное. К примеру, слово БИОЛОГИЯ, прочитанное задом наперед, дает бессмысленное ЯИГОЛОИБ. Точно так же и информационная РНК, считанная с генома в одном направлении, может кодировать белок, но копирование того же участка ДНК задом наперед может породить какую-то мусорную РНК, которую нельзя транслировать в белок. Иногда это приводит к образованию саморегулирующихся петель в наших клетках. Такие петли ограничивают экспрессию определенных генов (см. пример на рис. 19.2).
По оценкам ряда ученых, примерно треть генов, кодирующих белки, также производят мусорную РНК на основе своей антисмысловой цепи. Однако антисмысловые молекулы обычно вырабатываются в меньших объемах, чем смысловая РНК: зачастую их не более 10% от ее общего количества7. Иногда антисмысловая область — просто короткая внутренняя секция гена. Иногда смысловая и антисмысловая области могут начинаться и кончаться в разных местах, так что они хоть и перекрываются, но и имеют свои уникальные участки. Иногда клеточная аппаратура, копирующая смысловую нить ДНК в смысловую РНК, врезается в аппаратуру, которая движется в противоположном направлении и создает антисмысловую РНК. Оба набора белков сваливаются с ДНК, и обе строящиеся молекулы РНК оказываются заброшенными. Существуют даже антисмысловые нити для некоторых длинных некодирующих РНК.
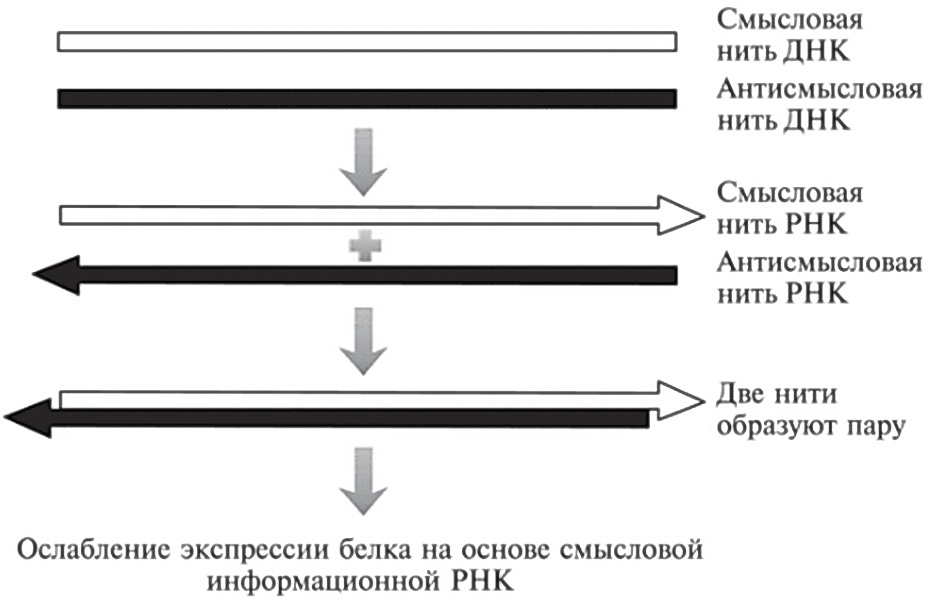
Рис. 19.2. В некоторых частях генома обе цепочки ДНК могут копироваться в РНК — при их считывании в противоположных направлениях. Нити, кодирующие белковые последовательности, называются смысловыми. Нити, не кодирующие белковые последовательности, называются антисмысловыми. Молекула антисмысловой РНК может соединяться с молекулой смысловой РНК, влияя на ее функционирование. В данном примере она ингибирует экспрессию белка, синтезируемого на основе матрицы смысловой информационной РНК.
Связывание антисмысловой РНК с ее смысловым РНК-партнером может приводить к весьма разнообразным последствиям. На рис. 19.2 показан случай, когда это связывание мешает трансляции смысловой информационной РНК в белок. Возможны и ситуации, при которых такое связывание стабилизирует информационную РНК, в конечном счете приводя к повышению уровня экспрессии белка8.
В рамках экспериментов с дюшенновской мышечной дистрофией, поначалу казавшихся столь перспективными, пациентам вводили антисмысловую молекулу, которая способна распознавать информационную РНК, кодирующую дистрофин, и соединяться с ней. Антисмысловую молекулу химически модифицировали, чтобы в организме она не распадалась слишком быстро. Соединяясь с информационной РНК, кодирующей дистрофин, она не позволяла сплайсинговой аппаратуре клетки осуществлять нормальное связывание. Это, в свою очередь, приводило к изменениям в сплайсинге данной информационной РНК. Ее кодирующие участки соединялись иначе, нежели при нормальном сплайсинге. В итоге удавалось избавиться от участка, который вызывал основные проблемы при выработке мутантного белка.
| <<< Назад Глава 19. Иногда лекарства все-таки действуют |
Вперед >>> Иногда все кончается хорошо |
- Мусорная ДНК. Путешествие в темную материю генома
- Количество имеет значение
- Отсекая бессмыслицу
- Глава 7. Рисование мусором
- Вязание с помощью ДНК
- Эгоистичные гены, мусорная ДНК и мобильные элементы
- Глава 18. Маленькие, но могучие
- Глава 15. Обезглавленные королевы, странные коты, жирные мыши
- Эпигенетика и экспансия
- Глава 16. Потеряно без перевода
- Как провести импринтинг заново
- Вариации на тему
