Книга: Мусорная ДНК. Путешествие в темную материю генома
Эпигенетика и энхансеры: интенсивное общение
| <<< Назад Управляя плавно меняющимся откликом |
Вперед >>> Преодолевая расстояния |
Эпигенетика и энхансеры: интенсивное общение
Итак, гены могут сохранять память даже после исчезновения стимула. Каким образом? В частности, благодаря эпигенетике. Эпигенетические модификации способны облегчить последующую активацию генов, поддерживая их в сравнительно «неподавленном» состоянии. Это как с врачом, который не уехал в отпуск, а дежурит и ждет вызова. В вышеописанном исследовании ученые показали, что определенные гистонные модификации оставались на «новых» энхансерах и после исчезновения воспалительного стимула, тем самым поддерживая эти энхансеры в состоянии боевой готовности.
Вообще говоря, мы начинаем чуть больше продвигаться в идентификации энхансеров по эпигенетическим модификациям, которые не зависят от соответствующих ДНК-последова-тельностей. Эти модификации могут использоваться как функциональные маркеры, показывающие, как клетки определенного типа используют данный фрагмент ДНК. Удалось показать также, что эти модификации порой меняются при онкологических заболеваниях, создавая различные картины генетической экспрессии, а те могут вносить свой вклад в клеточные трансформации, которые, в свою очередь, как раз и приводят к раковым процессам5.
Но даже если нам все-таки удается найти эпигенетический «автограф», который указывает, что мы, возможно, имеем дело с энхансером, нам все равно мешает еще одна проблема. Мы не знаем, на какой ген, кодирующий белок, он влияет. Это можно попытаться выяснить лишь одним способом — разрушая энхансер при помощи генетических манипуляций и затем оценивая, на какие гены воздействует такая перемена. Дело в том, что энхансеры функционируют не так, как промоторы. Энхансеры работают независимо от своей ориентации. Иными словами, неважно, в какую сторону они «указывают». Есть и еще более резкое различие: энхансеры могут располагаться очень далеко от того кодирующего белок гена, на экспрессию которого они влияют.
Кроме того, энхансеров гораздо больше, чем мы могли бы ожидать. В ходе недавнего широкомасштабного исследования изучались картины гистонной модификации примерно в 150 человеческих клетках. При поиске рисунков модификаций, похожих на энхансерные, оказалось возможным выявить около 400 тысяч кандидатов на роль областей-энхансеров6. Это гораздо больше, чем требовалось бы в случае существования взаимно однозначного соответствия между энхансерами и генами, кодирующими белки. И даже если мы предположим, что длинные некодирующие РНК тоже обладают энхансерами, это число все равно окажется слишком большим.
Не все энхансеры обнаружились в каждом типе клеток. Это вполне согласуется с моделью, в которой один и тот же фрагмент ДНК может обладать разными функциями в разных типах клеток, в зависимости от своих эпигенетических модификаций.
Сегодня нет четких моделей функицонирования энхансеров. Ученые предполагают, что во многих случаях они очень сильно зависят от генетического мусора иного типа — от длинных некодирующих РНК. Собственно, некоторые классы длинных некодирующих РНК могут экспрессироваться на самих энхансерах7. Многие длинные некодирующие РНК участвуют в процессах подавления экспрессии генов. Но теперь немало ученых считают, что существует и обширный класс длинных некодирующих РНК, усиливающих экспрессию генов. Впервые такую гипотезу высказали применительно к длинным некодирующим РНК, которые регулируют соседствующие с ними гены. В ходе ряда экспериментов искусственное усиление экспрессии длинной некодирующей РНК приводило к усилению экспрессии ближайшего к ней гена, кодирующего белок. И наоборот, искусственное подавление экспрессии длинной некодирующей РНК приводило к снижению экспрессии гена, кодирующего белок8.
Дальнейшие подтверждения этой гипотезы удалось получить, анализируя временной характер включения/выключения длинных некодирующих РНК и информационных РНК, которые ими регулируются (как считали ученые). Исследователи подвергали клетки воздействию стимула, который, как они уже знали, вызывает экспрессию определенного гена. Как выяснилось, усиливающая («энхансерная») длинная некодирующая РНК включалась раньше, чем информационная РНК близлежащего гена, кодирующего белок9,10. Это отвечает модели, согласно которой длинная некодирующая РНК, расположенная в области-энхансере, включается в ответ на стимул, а затем, в свою очередь, помогает усилить экспрессию гена, кодирующего белок (или включить этот ген).
Длинная некодирующая РНК способствует такому усилению не сама по себе. Для успешного осуществления процесса необходимо присутствие большого комплекса белков. Такой комплекс называется медиатором. Длинная некодирующая РНК связывается с медиатором, направляя его деятельность на близлежащий ген. Один из белков медиатора способен пристраивать эпигенетические модификации к соседствующему с ним гену, кодирующему белок[36]. Это помогает рекрутировать фермент, создающий копии информационной РНК. Затем эти копии используются как матрицы для производства белка.
Существует неизменная взаимосвязь между медиатором и длинной некодирующей РНК. Искусственно вызванные понижения уровня экспрессии длинной некодирующей РНК или какого-то белка, входящего в состав медиатора, всякий раз приводили к понижению уровня экспрессии ближайшего гена11.
Важность физического взаимодействия между длинными некодирующими РНК и медиатором показали на примере одного из генетических заболеваний человека. Речь идет о синдроме Опица-Каведжиа. Дети, родившиеся с этим недугом, испытывают трудности при обучении, у них пониженный мышечный тонус и непропорционально большая голова12. Они наследуют мутацию одного-единственного гена. Этот ген кодирует белок медиатора, взаимодействующего с молекулами длинной некодирующей РНК[37].
Чем больше ученые анализировали деятельность медиатора, тем интереснее им становились эти исследования. Одной из причин такого интереса явилось то, что медиатор отвечает за действия группы энхансеров, обладающих необычными способностями. Это так называемые суперэнхансеры. Они играют особенно важную роль в эмбриональных стволовых клетках (ЭС-клетках), плюрипотентных клетках человеческого организма, которые способны стать клетками практически любого типа13.
Суперэнхансеры — кластеры энхансеров, действующих сообща. По размерам эти кластеры примерно вдесятеро больше обычных энхансеров, а потому могут связываться с огромным количеством белковых молекул. В этом они значительно превосходят обыкновенные энхансеры. Суперэнхансеры способны резко усиливать экспрессию регулируемых ими генов. Но дело не только в числе белков, с которыми они связываются. Ученых больше интересует, что это за белки.
Как мы уже видели (глава 8), ЭС-клетки не остаются плюрипотентными по каким-то случайным причинам или просто в силу своей пассивности. Чтобы ЭС-клетки сохраняли свой потенциал, они должны очень тщательно регулировать собственные гены. Даже сравнительно малые возмущения в генетической экспрессии могут толкнуть ЭС-клетку по пути, который превратит ее в клетку специализированную. Представьте себе известную игрушку — гибкую шагающую пружину «слинки». Установим ее на верхней ступеньке длинного лестничного пролета. Малейшего толчка в нужную сторону достаточно, чтобы «слинки» начала свое весьма долгое путешествие. Может быть, лучше представить себе «слинки», которую удерживает от спуска по ступенькам небольшой грузик, прикрепленный к ее верхнему концу. Уберите груз — и пружина зашагает вниз.
Существует целый набор белков, абсолютно необходимых для поддержания плюрипотентности ЭС-клеток. Эти белки называются главными регуляторами (master regulators). Их можно уподобить грузику на верхнем конце «слинки». Уровень экспрессии главных регуляторов в ЭС-клетках очень высок, однако в специализированных клетках он гораздо, гораздо ниже.
Важную роль этих белков недвусмысленно продемонстрировали в 2006 году. Японские ученые искусственно экспрессировали комбинацию из четырех таких главных регуляторов в клетках, уже прошедших дифференциацию, обеспечив при этом очень высокие уровни экспрессии. Как ни поразительно, это породило целую череду молекулярных событий, кульминацией которых стало создание клеток, по своему действию почти идентичных ЭС-клеткам14. Это как если бы «слинки» вдруг прошагала с нижней ступеньки обратно на верхнюю. Клетки, созданные таким способом[38], в организме могут превращаться в человеческие клетки практически любого типа. Замечательная работа. Изыскания, которые за ней последовали, вызвали большое воодушевление. Ведь теперь в принципе оказалось возможным выращивать клетки-заменители для лечения огромного числа заболеваний — от слепоты и диабета первого типа до болезни Паркинсона и сердечной недостаточности.
До развития этой новой технологии ученые испытывали огромные трудности при создании нужных клеток для лечения тех или иных болезней человека. Дело в том, что клетки, взятые у одного человека, обычно не удается спокойно имплантировать другому. Иммунная система распознает донорские клетки как чужеродные и уничтожает их, как если бы они являлись организмом-захватчиком. Однако, как показано на рис. 12.1, теперь мы в принципе имеем возможность производить клетки, идеально подходящие конкретному пациенту.
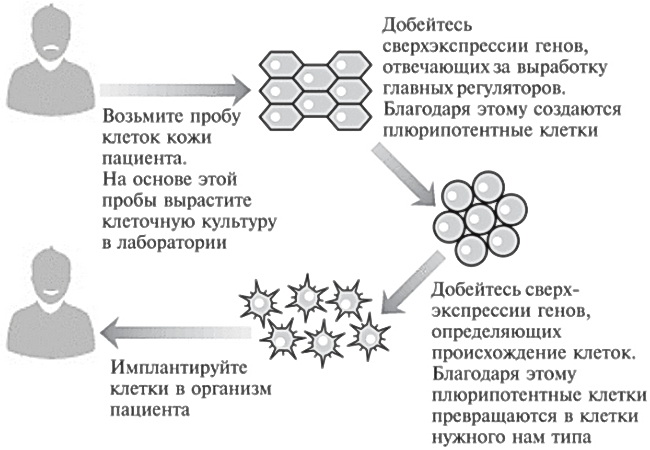
Рис. 12.1. Теория, в принципе позволяющая использовать клетки, выращенные на основе биоматериала пациента, для лечения этого конкретного пациента.Имплантируйте клетки в организм пациента.
На основе этой работы 2006 года возникла целая отрасль промышленности, потенциальный оборот которой составляет миллиарды долларов. Кроме того, исследователи получили одну из самых «быстрых» Нобелевских премий по физиологии и медицине: им присудили ее всего через 6 лет после первой публикации15.
В нормальных ЭС-клетках некоторые белки, являющиеся главными регуляторами, при соединении с суперэнхансерами дают очень высокую плотность белков в зоне связывания. Сами же суперэнхансеры регулируют некоторые ключевые гены, поддерживающие плюрипотентное состояние клеток. В тех же местах очень высока концентрация комплекса-медиатора. Подавление экспрессии одного из главных регуляторов или медиатора оказывает весьма схожее воздействие на экспрессию этих ключевых генов. Уровни экспрессии падают, и увеличивается вероятность того, что ЭС-клетки начнут дифференцироваться, превращаясь в клетки специализированные.
Поскольку плюрипотентное состояние ЭС-клеток во многом определяется высокими уровнями экспрессии главных регуляторов, неудивительно, что сами главные регуляторы контролируются суперэнхансерами. Это создает систему с положительной обратной связью (см. рис. 12.2).
Циклы с положительной обратной связью сравнительно редко встречаются в биологии — главным образом из-за того, что в том случае, если они начнут вести себя как-то не так, их трудно будет снова обуздать. По счастью, кодирующие белок гены, регулируемые суперэнхансерами, весьма чувствительны к малейшим изменениям связывания главных регуляторов и к целому ряду других факторов. А значит, не исключено, что даже небольшого изменения в балансе этих факторов может оказаться достаточно для прерывания этого цикла с положительной обратной связью, что позволит клеткам не оставаться плюрипотентными, а начать дифференциацию. В конце концов, обычно не требуется больших усилий, чтобы столкнуть пружину «слинки» с лестницы.
Сообщалось также о наличии суперэнхансеров в клетках злокачественных опухолей. Вероятно, там они взаимодействуют с генами, оказывающими ключевое воздействие на размножение клеток и развитие раковых процессов16. Один из генов, регулируемых таким суперэнхансером, порождает лимфому Бёркитта (мы уже упоминали этот ген в данной главе). В кое-каких нормальных специализированных клетках тоже имеются суперэнхансеры. Они связываются с белками, специфическими для клеток данного типа и определяющими особенности клетки.
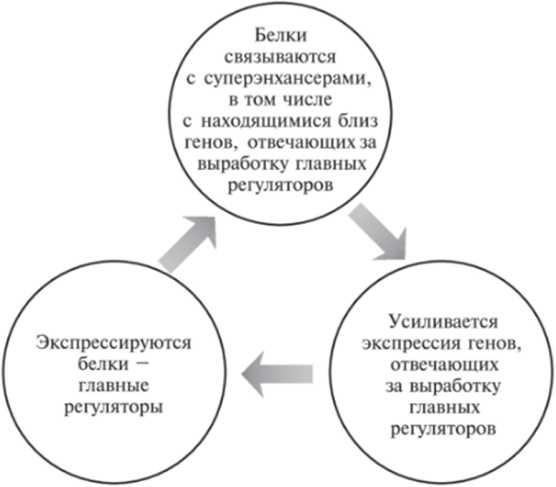
Рис. 12.2. Цикл с положительной обратной связью, поддерживающий высокий уровень экспрессии генов, которые отвечают за выработку главных регуляторов.
| <<< Назад Управляя плавно меняющимся откликом |
Вперед >>> Преодолевая расстояния |
