Книга: Эволюция. Классические идеи в свете новых открытий
Помехоустойчивость и избыточность
| <<< Назад Неустранимая случайность |
Вперед >>> Избыточность и эволюционная пластичность |
Помехоустойчивость и избыточность
Если онтогенез по умолчанию нестабилен, возникает вопрос, почему же у реальных организмов мы видим, как правило, довольно точное соответствие между генотипом и фенотипом. Многим фенотипическим различиям между особями соответствуют вполне определенные генетические различия (напомним, что это явление называется наследственной изменчивостью). Правда, соответствие не абсолютное, а вероятностное. При одном и том же генотипе фенотип может получиться разным из-за различающихся условий развития. Например, если один брат-близнец будет заниматься спортом, а другой нет, то у первого будет лучше развита мускулатура. Это называют модификационной изменчивостью. Но даже и в одинаковых условиях братья все равно будут чуть-чуть отличаться. Это уже стохастическая изменчивость, как у четырех- и пятилепестковых цветочков на одной и той же ветке сирени.
Стохастическая изменчивость обычно настолько мала, что совсем не бросается в глаза и часто игнорируется биологами. Особенно ничтожна она у животных: у растений стохастическая изменчивость проявляется сильнее, как показывает пример с сиренью. Подавление стохастической изменчивости происходит из-за того, что реальные генетические программы развития буквально до отказа набиты стабилизирующими регуляторными контурами, основанными на обратных связях. Адаптивный смысл этих генно-регуляторных сетей как раз в том и состоит, чтобы свести элемент случайности к минимуму и сделать развитие максимально стабильным (помехоустойчивым)[94].
Попытки спроектировать какое-нибудь интересное существо в программе EvoDevo поначалу всегда приводят к нестабильному результату. Первый успешный набор правил (генотип) создает нужное нам существо не всегда, а лишь изредка. При этом даже лучший из вариантов фенотипа, как правило, будет далек от того идеала, к которому мы стремились, а остальные и вовсе получатся уродцами. Чтобы улучшить результат, т. е. уменьшить стохастичность онтогенеза и стабилизировать нужный вариант фенотипа, приходится вносить в генотип стабилизирующие правила, основанные на отрицательных обратных связях и дополнительных регуляторах. Эти дополнения на первый взгляд могут показаться «избыточными». Но без них не обойтись. Например, если клетки при таких-то условиях начинают выделять морфоген, даже не рассчитывайте, что его количество будет одним и тем же всякий раз при запуске развития зиготы. Если для нормального развития необходимо, чтобы количество морфогена было постоянным, придется добавить в генотип специальные стабилизирующие правила, примерно такие: если концентрация морфогена А больше 0,5, уменьшить производство морфогена А на 10 %. Это и есть отрицательная обратная связь: если чего-то стало слишком много, нужно принять меры, чтобы его стало меньше. Увеличение показателя должно стимулировать его уменьшение. Иначе все пойдет вкривь и вкось.
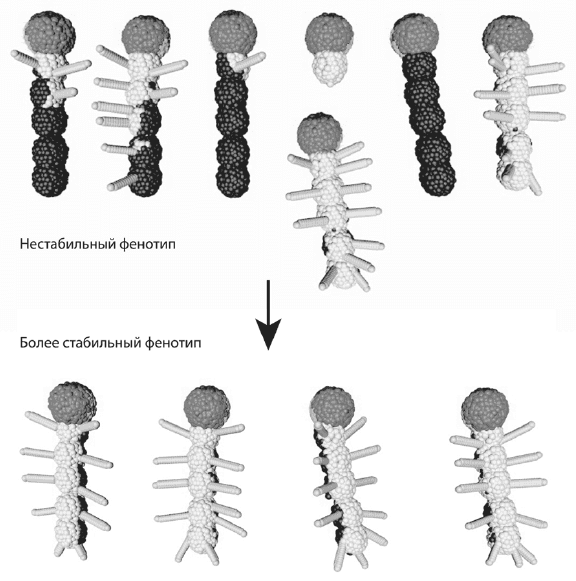
Пример «онтогенетической стохастики» в программе EvoDevo. Генотипы, содержащие недостаточное количество стабилизирующих обратных связей, дают нестабильный результат. При этом желаемый («хорошо приспособленный») фенотип будет получаться лишь изредка. Чтобы перейти от нестабильного фенотипа (вверху) к более стабильному (внизу), нам пришлось усложнить генотип (программу развития) на 50 %.
Чтобы стабилизировать развитие «правильного» признака — в модели это признак, который нам нравится, а в природе это признак, повышающий приспособленность, — приходится усложнять программу развития. Например, чтобы перейти от нестабильного фенотипа, показанного на рисунке сверху, к более стабильному, показанному внизу, нам пришлось увеличить количество правил, составляющих генотип, на 50 %. В программе EvoDevo это делаем мы, пользователи. В природе этим занимается дарвиновский эволюционный механизм, основанный на мутациях и отборе. Адаптивное преимущество получают те генотипы, которые производят оптимальный (хорошо приспособленный) фенотип с наибольшей вероятностью и с наименьшей зависимостью от всякого рода случайностей — внешних или внутренних. Генотип, обеспечивающий развитие оптимального фенотипа лишь при температуре от 20 до 21 °C, проиграет в конкуренции генотипу, генерирующему такой же фенотип в более широком диапазоне температур (если только эволюция идет не в термостате). Вместо температуры можно сюда подставить любые факторы внешней или внутренней среды и вообще любые «помехи», в том числе связанные с изначально присущей онтогенезу стохастикой, о которой говорилось выше.
Введение дополнительного правила в генотип модельного существа аналогично появлению в ходе эволюции нового сайта связывания ТФ, ставящего активность одного из генов — регуляторов развития в зависимость от какого-нибудь нового фактора. Например, от концентрации морфогена, который ранее не влиял на этот ген. Это все равно что добавить дополнительное условие в оператор условного перехода (команду «если… то…») в компьютерной программе.
—————
Избыточность и обратные связи в работе шпемановского организатора
Главная функция организатора Шпемана состоит в создании стабильной дорзовентральной (спинно-брюшной) разметки эмбриона. Там, где концентрация активных белков из группы BMP (bone morphogenetic proteins) минимальна, клетки наружного слоя зародыша превращаются в нервные. Формируется нервная пластинка — зачаток центральной нервной системы. Там будет спинная сторона. Нервная пластинка в свою очередь индуцирует развитие других органов и структур. Остальные клетки наружного слоя под действием морфогенов BMP — а их больше на будущей брюшной стороне зародыша — становятся клетками эпителия. Спинной (шпемановский) организатор производит белок-морфоген хордин, который блокирует действие BMP. Там, где много хордина, мало активных молекул BMP, в результате в этой области зародыша формируется спина.
Казалось бы, вот и хорошо: система из двух взаимодействующих морфогенов, BMP и chordin, вполне достаточна для дорзовентральной разметки зародыша. Какие-то дополнительные ухищрения здесь, наверное, не нужны. Не тут-то было!
Как выяснилось, помимо основного регуляторного взаимодействия «хордин блокирует BMP» в создании дорзовентральной полярности у позвоночных участвует целый ряд морфогенов и связей между ними. Спинной организатор «общается» с брюшным организующим центром посредством белков-морфогенов, выделяемых в межклеточное пространство. Все эти морфогены тем или иным способом влияют на дорзовентральный градиент BMP, усиливая или ослабляя его. Отрицательные обратные связи, которыми изобилует эта регуляторная сеть, делают градиент BMP устойчивым к разнообразным помехам и нарушениям. Например, если производство BMP по какой-то причине увеличивается, это приводит к росту экспресии белка Sizzled, который подавляет активность белка Tolloid, который в свою очередь выводит из строя хордин, инактивирующий BMP (см. рисунок ниже). Получается типичный регуляторный контур, основанный на отрицательной обратной связи: больше BMP ? больше Sizzled ? меньше Tolloid ? больше Chordin ? меньше BMP.
Благодаря наличию нескольких таких контуров градиент BMP оказывается на редкость устойчивым. Генно-инженерные эксперименты показали, что для того, чтобы серьезно нарушить этот градиент — и получить, например, полностью «дорзализованный» эмбрион, у которого весь наружный слой клеток превращается в нервную ткань, или полностью «вентрализованный» эмбрион вообще без нервной пластинки, — недостаточно вывести из строя какой-то ключевой ген-регулятор. Даже без хордина, даже без BMP4 дорзовентральный градиент все равно худо-бедно формируется за счет дополнительных регуляторных контуров и морфогенов-«дублеров». Нужно выключить сразу 3–4 гена, чтобы нарушения развития стали действительно катастрофическими (De Robertis, 2009). Вот что значит настоящая помехоустойчивость!
Разумеется, естественный отбор не стал бы создавать столь поразительный запас прочности только на случай прихода любопытных биологов, которые начнут отключать в эмбрионах гены. В природе и без нас хватает неприятных неожиданностей: перемены климата и химического состава среды, мутации, неудачные комбинации родительских генов… Все это может нарушить работу тех или иных генных систем. Поэтому в общем случае генотипы, обеспечивающие более помехоустойчивое развитие, получают преимущество над генотипами, срабатывающими только в тепличных условиях. Ну а если жизнь становится более предсказуемой — как, например, у внутриклеточных паразитов — может произойти редукция стабилизирующих систем и упрощение генетической программы развития.
—————
Изменения регуляторных участков генов — регуляторов развития играют важнейшую роль в эволюции многоклеточных. С несколькими примерами мы познакомились в главе 5. Но до сих пор мы исходили из негласной презумпции однозначного соответствия между генотипом и фенотипом: изменился геном — изменился признак.
Пора внести важное уточнение. Мы должны помнить, что само это соответствие не с неба падает. По умолчанию оно вовсе не однозначно, а для того, чтобы оно стало таковым, необходимы специальные стабилизирующие адаптации, которые должны постепенно развиваться в ходе эволюции.
Это согласуется с идеей о творческой роли стабилизирующего отбора, которую развивал великий советский биолог И. И. Шмальгаузен (1884–1963). Отбор на стабильность должен вести к усложнению программы развития. Отбор, просто отсеивающий уродцев (отклонения от «нормы», т. е. от оптимального в данных условиях фенотипа), в перспективе способствует развитию новых генно-регуляторных контуров, повышающих стабильность воспроизведения «нормального» фенотипа.
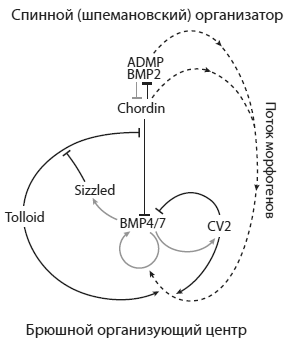
Регуляторная сеть, обеспечивающая дорзовентральную (спиннобрюшную) разметку эмбриона шпорцевой лягушки Xenopus. Из De Robertis, 2009.
Генотип определяет не фенотип как таковой, а норму реакции, т. е. диапазон возможных фенотипов, которые могут быть реализованы при данном генотипе. «Выбор» конкретного фенотипа часто зависит от условий, в которых происходит развитие. Но даже генетически идентичные особи, развивающиеся в одинаковых условиях, все равно будут хоть немного, но разными. И чем хуже у них работают стабилизирующие генно-регуляторные контуры, тем сильнее будет случайная вариабельность.
Наличие стохастической составляющей в генетической программе развития ярко проявляется в неполной пенетрантности многих мутаций. Суть этого явления, замеченного еще в 1925 году выдающимися генетиками Н. В. Тимофеевым-Ресовским (1900–1981) и Д. Д. Ромашовым (1899–1963), состоит в том, что одна и та же мутация у одних особей проявляется в фенотипе, а у других нет. Это зависит от условий среды и «генетического контекста», т. е. от других генов в геноме (что неудивительно), но даже с поправкой на оба эти фактора многие мутации все равно имеют нестабильный фенотипический эффект.
О молекулярных механизмах неполной пенетрантности известно немного. Их изучение осложняется тем, что генные сети, управляющие развитием, обычно крайне громоздки и на первый взгляд избыточны. Входящие в их состав гены связаны сложнейшей сетью взаимодействий, содержащей многочисленные петли положительных и отрицательных обратных связей, так что трудно понять, где именно в этой паутине возникает непредсказуемость.
Идеальный объект для таких исследований — наш старый знакомец червь Caenorhabditis elegans, у которого генетическая регуляция развития предельно упрощена, как, впрочем, и само развитие[95].
Биологам из Массачусетского технологического института и Принстонского университета (США) удалось выяснить причины неполной пенетрантности нескольких мутаций гена skn-1 (Raj et al., 2010). Эти мутации приводят (или не приводят, так как пенетрантность неполная) к тому, что потомки бластомера (зародышевой клетки) E, которые должны стать клетками кишечника, остаются недифференцированными, и кишечник у эмбриона не формируется.
Роль главного «переключателя» в развитии кишечника играет ген elt-2. Он активирует сотни других генов, необходимых для превращения бластомеров в кишечные клетки. Чтобы сам elt-2 своевременно включился, требуется работа генов end-3 и end-1. Они в свою очередь активируются геном skn-1, причем активация осуществляется как напрямую, так и опосредованно, через ген med-1/2.
Известно несколько мутаций гена skn-1, нарушающих развитие кишечных клеток. Все эти мутации в гомозиготном состоянии летальны, и в этом смысле пенетрантность у них стопроцентная. Однако у некоторых мутантных эмбрионов перед смертью формируется нормальный кишечник, а у других — нет. В этом отношении пенетрантность неполная.
Чтобы выяснить причины неполной пенетрантности, авторы воспользовались новым методом флюоресцентной окраски молекул РНК, который они сами и изобрели. Метод позволяет увидеть и даже подсчитать молекулы матричной РНК (мРНК), считанные с определенного гена. Каждая отдельная молекула мРНК становится видна как светящаяся точка. Это дает уникальную возможность определять уровень активности гена в индивидуальных клетках.
Оказалось, что у эмбрионов с мутантным геном skn-1 в клетках, которые должны стать кишечником, med-1/2 не включается вовсе, а end-3 работает очень слабо. Что касается гена end-1, то его активность становится непредсказуемой. В норме этот ген на определенной стадии развития эмбриона начинает работать в клетках, которые должны стать кишечником, причем уровень его активности во всех этих клетках примерно одинаков. У мутантных эмбрионов end-1 начинает работать в разных клетках с разной силой, а в некоторых не включается вовсе, так что общая картина получается хаотичной.
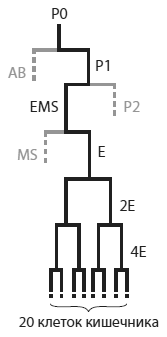
«Родословная» клеток кишечника в развитии эмбриона C. elegans. Кишечник взрослого червя состоит из 20 клеток. Все они являются потомками бластомера E, который происходит от бластомера EMS, а тот — от P1. Бластомер P1 образуется в результате первого деления оплодотворенной яйцеклетки (P0). «Братом» бластомера EMS является бластомер P2 — организатор, формирующий передне-заднюю полярность зародыша при помощи морфогена Wnt. Из Raj et al., 2010.
Этот хаос на следующем этапе регуляторного каскада приводит к одному из двух альтернативных результатов: либо ген elt-2 включается, и тогда клетки превращаются в кишечник, либо elt-2 остается выключенным, и тогда кишечник не формируется. Как выяснилось, выбор одного из двух исходов зависит от того, достигнет ли активность end-1 определенного порогового уровня. Однако и тут сохраняется доля неопределенности. Если активность end-1 ниже пороговой, elt-2 точно не включится и кишечника не будет. Если же активность end-1 выше пороговой, то это еще не гарантирует включения elt-2: он либо включится, либо нет. Раз включившись, elt-2 уже будет работать нормально сколько ему положено, потому что этот ген активирует сам себя.
Хаос, возникающий в работе гена end-1, объясняется отсутствием должной регуляции со стороны end-3. Если вывести из строя end-3, то результаты получаются примерно такие же, как и при мутациях skn-1, т. е. ген end-1 начинает работать хаотично, а ген elt-2 либо включается, либо нет. Если же вывести из строя end-1, то при нормально работающих skn-1 и end-3 никакой неполной пенетрантности не возникает и кишечник формируется у всех эмбрионов.
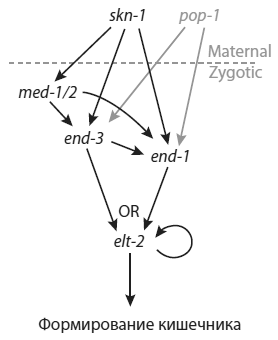
Регуляторный каскад, приводящий к включению гена elt-2 в клетках будущего кишечника. Ген skn-1 (точнее, белковый продукт этого гена) активирует гены med-1/2, end-3 и end-1. Два последних гена активируют ген elt-2, который включает сразу сотни генов, необходимых для превращения бластомеров в клетки кишечника. Несмотря на крайнюю простоту этого регуляторного каскада (по сравнению с тем, что наблюдается у других животных), в нем много «избыточности»: активация одного и того же гена осуществляется не одним, а несколькими параллельными путями. Из Raj et al., 2010.
Таким образом, в норме elt-2 включается благодаря согласованному действию двух регуляторов: end-3 и end-1, причем эти регуляторы отчасти взаимозаменимы. Если выйдет из строя end-1, то нормально работающий end-3 справится с задачей самостоятельно и включит elt-2 в положенное время. Если же забарахлит end-3, то работа end-1 дестабилизируется, но все же он сумеет включить elt-2 хотя бы у некоторых эмбрионов.
Подобные факты указывают на то, что кажущаяся «избыточность», характерная для большинства генно-регуляторных каскадов, управляющих развитием эмбриона, обеспечивает стабильность (помехоустойчивость) развития. Благодаря этой избыточности выход из строя отдельных регуляторов (в результате мутаций или неблагоприятных условий среды) может быть скомпенсирован оставшимися элементами регуляторного каскада по крайней мере у некоторых зародышей. «Случайный шум», который может при этом возникнуть в работе каскада, позволяет одним зародышам развиваться нормально, в то время как другие зародыши с точно таким же геномом могут приобрести какие-то новые фенотипические признаки. Скорее всего, это будут несовместимые с жизнью уродства, но вероятность появления полезных отклонений тоже ненулевая. В таком случае естественный отбор в дальнейшем будет закреплять у потомков этих «перспективных уродов» такие мутации, которые сделают новый путь развития более стабильным. В итоге этот новый путь окажется вписан в геном и станет вполне наследственным.
—————
Зачем нужны «ненужные» гены
Похоже, это общее правило: когда мы сталкиваемся с кажущейся избыточностью живых систем (а природа прямо-таки переполнена примерами «избыточности»), при ближайшем рассмотрении выясняется, что мы имеем дело с адаптациями, развившимися под действием отбора для повышения помехоустойчивости.
Например, именно к такому выводу пришли биологи, изучавшие «лишние» гены у дрожжей.
Чтобы узнать, зачем нужен тот или иной ген, проще всего испортить его мутацией или вовсе отключить и посмотреть, как это отразится на фенотипе. Можно двигаться и в обратном направлении: обнаружив измененный (мутантный) фенотип, пытаться выяснить, изменения какого гена (или генов) привели к таким последствиям. Раньше генетики почти всегда шли вторым путем, а в последнее время в связи с развитием генной инженерии и других современных методик все чаще используется первый путь.
При этом на удивление часто обнаруживается, что тот или иной ген (или некодирующий участок ДНК) как будто ни для чего и не нужен: его удаление не приводит ни к каким видимым последствиям и не снижает жизнеспособность организма.
Например, недавно выяснилось, что отключение гена SREB2, активно работающего в клетках мозга, не только не вредит здоровью мышей, но даже приводит к небольшому увеличению размера мозга и улучшает память (Matsumoto et al., 2008). Между тем этот ген является ультраконсервативным: белок, им кодируемый, у всех млекопитающих абсолютно одинаковый — за всю историю класса млекопитающих в нем не изменилась ни одна аминокислота. Мелкие изменения в некодирующих участках (интронах) этого гена у человека ассоциируются со склонностью к шизофрении, а небольшое увеличение экспрессии этого гена у тех же мышей вызвало у них серьезные психические отклонения, напоминающие вышеупомянутое душевное заболевание. Все косвенные признаки, казалось бы, говорят о том, что ген должен быть жизненно важным, — однако мыши с отключенным геном SREB2 чувствуют себя превосходно и даже обучаются разным мышиным премудростям быстрее своих немутантных товарок.
Как объяснить такие странные результаты? Неужели многочисленные «ненужные» гены, найденные в ходе подобных экспериментов, действительно совсем не нужны их обладателям? Но если ген становится ненужным, то он, по идее, должен быстро выходить из строя и разрушаться под действием случайных мутаций, не отсеиваемых отбором. Как тогда объяснить высокую консервативность, т. е. эволюционную устойчивость многих из этих генов, что проявляется в высоком уровне их сходства у далеких друг от друга видов?
Самый очевидный (а во многих случаях и единственно возможный) ответ состоит в следующем. Вероятно, эти гены зачем-то все же нужны, но не в тепличных условиях лаборатории, а в природе, где живым существам приходится иметь дело с переменчивыми и малопредсказуемыми факторами среды. Логично предположить, что чем постояннее и предсказуемее условия обитания, тем сильнее может упроститься генетическая программа поведения клетки (или многоклеточного организма). Именно этим объясняют, например, радикальное сокращение геномов у внутриклеточных симбиотических бактерий. Условия, в которых живут лабораторные организмы, предельно стандартизованы (стандартные среды, корма, клетки, освещенность и т. д.), что делает их существование с эволюционной точки зрения мало отличающимся от жизни внутриклеточных паразитов.
Это рассуждение, однако, хорошо бы проверить экспериментально. Именно это и проделали генетики из США и Канады, изучившие «ненужные гены» у дрожжей Saccharomyces cerevisiae (Hillenmeyer et al., 2008). У этого вида грибов можно удалить или отключить 2/3 генов без всякого снижения жизнеспособности. Правда, с одним маленьким уточнением: речь идет о жизнеспособности в стандартных «богатых» лабораторных средах, насыщенных всеми необходимыми веществами.
Авторы использовали коллекции дрожжей-мутантов, где каждый штамм содержит одну делецию (один удаленный ген) в гомозиготном или в гетерозиготном состоянии (т. е. удалены либо обе копии данного гена, либо только одна). Дрожжи, как мы помним из главы з, могут размножаться и половым путем, и бесполым (почкованием), причем способ размножения зависит от условий среды. Поэтому гетерозиготные штаммы можно долго размножать бесполым путем, не опасаясь, что они перестанут быть чисто гетерозиготными.
Использованные коллекции включают около 6 тыс. гетерозиготных штаммов — именно столько генов содержится в геноме дрожжей. В каждом из штаммов на одной из хромосом удален один ген (по одному в каждом штамме). Число гомозиготных штаммов, т. е. таких, у которых тот или иной ген удален на обеих хромосомах, меньше — около 5 тыс. Их на тысячу меньше, потому что именно столько генов — 1 тыс. — являются абсолютно необходимыми. Их удаление на обеих хромосомах смертельно для дрожжей даже при выращивании в самой благоприятной среде.
Каждый из этих штаммов тестировался в разнообразных нестандартных условиях. В среду добавляли всевозможные химические вещества, в том числе лекарства, подавляющие рост микроорганизмов, или удаляли из среды какие-нибудь важные компоненты (аминокислоты, витамины). Каждый гетерозиготный штамм был испытан в 726 различных средах, каждый гомозиготный — в 418.
Ученые проделали поистине титаническую работу: общее количество выполненных тестов превысило 6 млн! В каждом опыте рост дрожжей в нестандартной среде сравнивался с ростом того же штамма в обычных лабораторных условиях.
Ранее было известно, что гомозиготные делеции 19 % генов являются летальными (это та самая «жизненно необходимая тысяча»); еще 15 % генов повышают приспособленность в стандартной богатой среде (иными словами, их делеция в гомозиготном состоянии снижает приспособленность). Оставалось еще 66 % генов, непонятно зачем нужных.
Оказалось, что подавляющее большинство этих «ненужных» генов оказываются полезными (повышают приспособленность) хотя бы в одной из протестированных сред. Только 205 генов (3 % от общего числа) так и не раскрыли своего секрета: среди испробованных условий не нашлось таких, где наличие этих генов оказалось бы полезным. Многие гены, как выяснилось, повышают устойчивость дрожжей к различным ядам, в том числе к лекарствам, применяемым для борьбы с патогенными микробами. Обнаружилась в том числе и обширная группа многофункциональных генов, которые обеспечивают дрожжам защиту сразу от многих ядов. Изучение этих генов поможет лучше понять механизмы устойчивости микроорганизмов к лекарствам.
Любопытная ситуация сложилась с транскрипционными факторами. В геноме дрожжей около 160 генов ТФ, однако лишь пять из них являются жизненно необходимыми при росте в идеальных условиях. Практически все ТФ оказались полезными в тех или иных нестандартных условиях, а 16 из них вошли в число многофункциональных «защитников», повышающих устойчивость дрожжей сразу ко многим отравляющим веществам. ТФ — основа системы реагирования клетки на внешние стимулы. Вместе с другими сигнальными и регуляторными белками их можно уподобить органам чувств и нервной системе животных. Чем меньше транскрипционных факторов, тем «глупее» клетка. Вполне естественно, что в тепличных условиях сложные системы реагирования становятся ненужными — на этом принципе основана и быстрая редукция генов ТФ у внутриклеточных бактерий, и закономерное уменьшение размеров мозга и снижение умственных способностей у домашних животных по сравнению с их дикими предками.
Исследование, таким образом, подтвердило теоретические ожидания, основанные на классическом дарвинистском принципе: если ген существует, значит, он зачем-то нужен. Число якобы «ненужных» генов в геноме дрожжей теперь сократилось с 66 % до 3 %, да и эти оставшиеся гены с неизвестной функцией, скорее всего, тоже для чего-нибудь нужны дрожжам в естественных условиях. Те же из них, которые действительно стали ненужными, могут находиться в той или иной стадии деградации. И действительно, более трети из этих 205 генов уже не функционируют (не экспрессируются).
—————
| <<< Назад Неустранимая случайность |
Вперед >>> Избыточность и эволюционная пластичность |
- Чудо самоорганизации
- Неустранимая случайность
- Помехоустойчивость и избыточность
- Избыточность и эволюционная пластичность
- Чтобы построить новое, нужно расшатать старое
- Маски и их прототипы в пьесе EvoDevo
- Все муравьи могут воспитать себе «боевиков»
- Стресс помогает справиться с вредными мутациями
- Надзор за надзирателями: кто присматривает за регуляцией развития
- Hox-гены обрели свободу — и змеи потеряли ноги
