Книга: Наука воскрешения видов. Как клонировать мамонта
Возрождение вымерших видов с точки зрения CRISPR
| <<< Назад Молекулярные ножницы и ферментный клей |
Вперед >>> Глава 7. Воссоздадим часть генома |
Возрождение вымерших видов с точки зрения CRISPR
Почти одновременно с нашей встречей в Гарварде появился новый экземпляр в наборе инструментов для редактирования генома. Этот новый инструмент, называемый системой CRISPR-Cas9, был открыт, когда ученые обнаружили его роль в формировании иммунитета у бактерий: вначале система считывает последовательность ДНК патогенного организма, а затем обнаруживает эту последовательность и уничтожает ее. Использование той же системы для редактирования генома имеет два ключевых преимущества по сравнению с ZFN и TALEN. Во-первых, программирование механизма происходит намного быстрее – у нас больше нет нужды соединять в цепочки «цинковые пальцы» и TALE методом проб и ошибок. Во-вторых, можно использовать намного более длинные последовательности, что существенным образом повышает их специфичность. Относительная простота, с которой можно редактировать геном при помощи этой системы, позволяет предположить, что в скором будущем биологию ожидает еще одна революция, подобная той, которая разразилась после изобретения ПЦР.
Вот как это работает. Когда болезнетворный микроорганизм проникает в клетку бактерии или простейшего, его геном опознается клеткой и разрезается на мелкие кусочки. Некоторые из них захватываются в качестве «спейсеров» молекулой, называемой CRISPR (clustered regularly interspaced short palindromic repeats – короткие палиндромные повторы, регулярно расположенные группами). Таким образом эти фрагменты патогенных микроорганизмов встраиваются в бактериальный геном и сохраняются для использования в будущем. Чтобы защитить себя от проникающих в нее патогенов, клетка транскрибирует CRISPR и разрезает ее в местах повторов, высвобождая спейсеры, которые, как мы помним, представляют собой участки ДНК болезнетворного микроорганизма. Транскрибированные спейсеры захватываются белками Cas9, которые затем ищут внутри клетки фрагменты ДНК, соответствующие спейсерам, чтобы обнаружить и уничтожить проникшие в клетку патогены.
Чтобы понять, как систему CRISPR-Cas9 можно использовать для редактирования генома, представьте, что, вместо того чтобы захватывать кусочки ДНК патогена и искать с их помощью болезнетворные микроорганизмы, которые могли проникнуть в клетку, молекулы Cas9 связываются с созданным нами участком ДНК и ищут с его помощью ту часть генома, которую мы хотим отредактировать (рис. 11). Этот способ определения специфических участков генома становится все более эффективным и точным. Мы проектируем и синтезируем молекулы CRISPR РНК (или cгРНК), которые представляют собой аналоги соединенных вместе «цинковых пальцев» или TALE, для поиска нужного нам участка генома. Когда cгРНК находит этот участок, Cas9, аналог молекулярных ножниц в ZFN и TALEN, разрезает нить ДНК. После этого начинаются стандартные процессы репарации ДНК и (мы надеемся) наши правки встраиваются в геномную последовательность.
Помимо выигрыша в скорости и специфичности, система CRISPR-Cas9 также позволяет увеличить эффективность процесса, если мы хотим внести множество изменений за один раз. Белок Cas9 и синтезированные cгРНК не связаны между собой физически, и это означает, что в клетку можно доставить сразу много различных cгРНК. Каждая из них будет захвачена белком Cas9 и использована для обнаружения (и разрыва) разных участков генома.
Группа Джорджа Чёрча из Института Висса – одна из лидирующих исследовательских групп, занимающихся усовершенствованием системы CRISPR-Cas9 для использования в геномной инженерии. Большинство людей в его лаборатории обдумывают применение CRISPR в персонализированной медицине или работают над усовершенствованием технологии таким образом, чтобы можно было как вводить в клетку более длинные фрагменты ДНК, так и производить множественные изменения в различных участках генома за один раз.
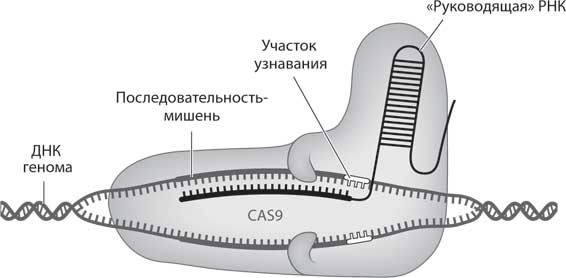
Рис. 11. CRISPR-Cas9. Ученые синтезируют длинные нити ДНК, соответствующие участку генома, который нужно отредактировать, и с их помощью создают cгРНК (темные цепочки ДНК). Затем их доставляют в клетку вместе с белком Cas9. Попав внутрь клетки, Cas9 захватывает cгРНК, которая направляет весь комплекс к нужному участку генома (светлые цепочки ДНК), а затем Cas9 вырезает его
Но в дальнем темном углу его лаборатории (так это представляется моему воображению) сидит маленькая группа постдоков, чья цель по размеру не уступает мамонту: сами они называют себя воскресителями мамонта. Каждый месяц лаборатории, сотрудничающие с организацией Revive & Restore, проводят телеконференции, чтобы поделиться достижениями активных проектов в области возрождения вымерших видов. Воскресители мамонта с завидным постоянством укладывают всех остальных на обе лопатки. Мы все еще занимаемся сборкой генома странствующего голубя и пытаемся определить, что нам может понадобиться изменить в нем. Они же решили не ждать, когда будет собран геном мамонта, и сразу дали себе команду «полный вперед». Начав с нескольких мутаций, о которых нам уже было известно (а именно с различий в гемоглобине мамонта и слона), и нескольких хороших предположений, они начали прокладывать свой путь к мамонту, орудуя «ножницами» и «клеем».
Текущие планы воскресителей мамонта сравнительно скромны. Когда они начинали работу, у них не было клеток индийского слона, так что они взялись редактировать геном африканского слона внутри клеток африканского слона. Кроме того, пока что они работают с разновидностью клеток кожи (фибробластами), а не со стволовыми клетками, снова же из-за того, что только эти клетки были им доступны. Отдельное направление их исследований посвящено созданию стволовых клеток из фибробластов слона, пока что оно увенчались ограниченным успехом. Из полученных стволовых клеток они собираются создавать клетки различных типов, а затем с их помощью проверять, удалось ли отредактировать геном. Никто еще не обсуждает всерьез возможность на самом деле превратить эти клетки в живого мамонта. Пока что цель заключается в том, чтобы отредактировать геном слона и вырастить клетки, содержащие его измененную версию, в крошечных пластиковых лабораторных планшетах.
Ученые из группы Джорджа Чёрча надеются отредактировать геном африканского слона таким образом, чтобы получить два специфических изменения фенотипа. Во-первых, они внесут все четыре изменения, касающиеся известных нам генов, кодирующих гемоглобин, которые отличаются у мамонта и слона. В результате должны получиться клетки, способные вырабатывать гемоглобин, подобный тому, который содержался в крови мамонта. Если им удастся произвести эти изменения в кроветворных стволовых клетках (тех, которые дифференцируются в различные типы клеток крови), они смогут напрямую измерить способность получившихся эритроцитов к переносу кислорода и выяснить, удалось ли добиться успеха. Они также надеются создать клетки, из которых сможет вырасти «самая густая и роскошная мамонтовая шерсть», как выражается Джордж. Но это более трудная задача, поскольку никто не знает наверняка, какие гены ответственны за густую и роскошную шерсть мамонта и сколько их было. Пока что Джордж довольствуется догадками, основанными на том, какие гены отвечают за шерстяной покров у других видов.
Разумеется, это только начало. Теперь, когда мы выяснили, что исчезнувшие фенотипы можно восстановить путем редактирования генома, используя клетки живущих видов, процесс возрождения вымерших видов начнет набирать обороты. Но какое именно животное получится у нас в результате? Сколько изменений нам придется внести, чтобы мы смогли назвать слона мамонтом? Возможно ли устранить все различия между их геномами? А если нет, то какие изменения нам следует внести?
| <<< Назад Молекулярные ножницы и ферментный клей |
Вперед >>> Глава 7. Воссоздадим часть генома |
- Глава 6. Воссоздадим геном
- 27. Биология и возрождение психоанализа
- Системы антивирусного иммунитета CRISPR-Cas у прокариот: демонстрация аутентичног омеханизма по Ламарку
- Другие (квази)ламарковские системы, функционирующие по принципу CRISPR
- Возрождение
- Возрождение села
- ГУМАНИЗМ И ВОЗРОЖДЕНИЕ
- Возрождение теории Калуцы – Клейна
- Претворяем в жизнь возрождение вымерших видов
- «Правильные» основания для восстановления вымерших видов
- Научный взгляд на возрождение вымерших видов животных
- Возрождение вымерших видов несправедливо по отношению к живым
