Книга: Медицинская микробиология, иммунология и вирусология
Микробиология туберкулеза
| <<< Назад Глава 65 Микобактериозы |
Вперед >>> Микробиология лепры |
Микробиология туберкулеза
Туберкулез (лат. tuberculum – бугорок) – инфекционное заболевание человека и животных с наклонностью к хроническому течению, характеризующееся образованием специфических воспалительных изменений, часто имеющих вид маленьких бугорков, с преимущественной локализацией в легких и лимфатических узлах. Туберкулез распространен повсеместно. В заболеваемости туберкулезом и его распространении решающее значение имеют социально-бытовые условия жизни, так как и врожденная устойчивость, и приобретенный к нему иммунитет определяются этими условиями.
Возбудитель туберкулеза – Mycobacterium tuberculosis – был открыт в 1882 г. Р. Кохом. Он относится к роду Mycobacterium семейства Mycobacteriaceae. Микобактерии широко распространены в природе: они встречаются в почве, воде, в организме теплокровных и холоднокровных животных. Морфологически характеризуются способностью образовывать нитевидные и ветвящиеся формы, особенно в старых культурах. Кроме того, они отличаются от других микроорганизмов более высокой устойчивостью к кислотам, щелочам и спирту, что связано с особенностями химического состава их клеток.
M. tuberculosis имеет форму тонких, стройных, коротких или длинных, прямых или искривленных палочек, длиной 1,0 – 4,0 мкм и диаметром 0,3 – 0,6 мкм; неподвижны; спор, капсул не образуют, грамположительны; обладают большим полиморфизмом. В старых культурах наблюдаются нитевидные, ветвящиеся формы, нередко зернистые формы (зерна Муха), как в виде свободно лежащих зерен, так и в виде зерен, содержащихся внутриклеточно. В организме больных под влиянием химиопрепаратов часто образуются ультрамалые формы, способные проходить через мелкопористые бактериальные фильтры («фильтрующиеся формы»). M. tuberculosis – аэроб, оптимальная температура для роста 37 °C, оптимальная рН – в пределах 6,4 – 7,0. Содержание Г + Ц в ДНК – 62 – 70 мол % (для рода). Рост при температуре 37 °C стимулируется инкубацией в воздухе, содержащем 5 – 10 % CO2, и добавлением к среде 0,5 % глицерина. Микобактерии туберкулеза способны синтезировать ниацин; каталазная активность относительно слабая и утрачивается при 68 °C. Многие биологические свойства микобактерий объясняются высоким содержанием липидов, составляющих до 40 % сухого остатка клеток. Обнаружены три фракции липидов: фосфатидная (растворимая в эфире), жировая (растворимая в эфире и ацетоне) и восковая (растворимая в эфире и хлороформе). В составе липидов имеются различные кислотоустойчивые жирные кислоты, в том числе туберкулостеариновая, фтиоидная, миколовая и др. Высокое содержание липидов определяет следующие свойства туберкулезных палочек.
1. Устойчивость к кислотам, щелочам и спирту.
2. Трудная окрашиваемость красителями. Для их окрашивания применяют интенсивные методы. Например, по способу Циля – Нильсена окрашивают концентрированным раствором карболового фуксина при подогревании. Восприняв окраску, туберкулезные бактерии, в отличие от других клеток, не обесцвечиваются ни спиртом, ни кислотой, ни щелочью, поэтому при докрашивании метиленовым синим в мазке все бактерии, клеточные элементы и слизь окрашиваются в синий цвет, а туберкулезные палочки сохраняют исходную красную окраску (см. цв. вкл., рис. 107.1). Этот метод позволяет дифференцировать их от некоторых непатогенных микобактерий, например M. smegmatis, содержащихся на слизистой оболочке уретры, но обесцвечивающихся спиртом. Вместе с тем необходимо иметь в виду, что встречаются и кислотоподатливые («синие» при окрашивании по Цилю – Нильсену) формы туберкулезных бактерий (в том числе палочковидные, нитевидные и зернистые).
3. Относительно высокая устойчивость к высушиванию и действию солнечных лучей. Рассеянный солнечный свет убивает их лишь через 8 – 10 сут. В мокроте при кипячении гибель наступает через 5 – 7 мин. В высохшей мокроте жизнеспособность сохраняется в течение многих недель.
4. Устойчивость к действию обычных дезинфицирующих веществ: 5 % раствор фенола при добавлении в равном объеме к мокроте вызывает гибель туберкулезных палочек через 6 ч, однако 0,05 % раствор бензилхлорфенола убивает через 15 мин.
5. Высокая гидрофобность, которая находит свое отражение в культуральных свойствах: на глицериновом бульоне рост в виде пленки желтоватого цвета, которая постепенно утолщается, становится ломкой и приобретает бугристо-морщинистый вид, при этом бульон остается прозрачным. На глицериновом агаре через 7 – 10 дней образуется сухой чешуйчатый налет, постепенно переходящий в грубые бородавчатые образования (см. цв. вкл., рис. 107.2 и см. рис. 107.3). На щелочном альбуминате (или на стекле, помещенном в цитратную лизированную кровь) рост туберкулезных бактерий, содержащих поверхностный гликолипид – корд-фактор, змеевидный: размножающиеся клетки располагаются, образуя структуру, напоминающую змею, жгут, веревку или женскую косу.
6. С высоким содержанием липидов связана и патогенность туберкулезных бактерий. Содержащиеся в липидах фтиоидная, миколовая и другие жирные кислоты оказывают своеобразное токсическое действие на клетки тканей. Например, фосфатидная фракция, наиболее активная из всех липидов, обладает способностью вызывать в нормальном организме специфическую тканевую реакцию с образованием эпителиоидных клеток, жировая фракция – туберкулоидной ткани. Эти свойства указанных липидных фракций связаны с наличием в их составе фтиоидной кислоты. Восковая фракция, содержащая миколовую кислоту, вызывает реакции с образованием многочисленных гигантских клеток. Таким образом, с липидами, состоящими из нейтральных жиров, восков, стеринов, фосфатидов, сульфатидов и содержащими такие жирные кислоты, как фтиоидная, миколовая, туберкулостеариновая, пальмитиновая и др., связаны патогенные свойства туберкулезной палочки и те биологические реакции, которыми ткани отвечают на их внедрение. Главным фактором патогенности является токсический гликолипид (корд-фактор), который располагается на поверхности и в толще клеточной стенки. По химической природе он представляет собой полимер, состоящий из одной молекулы дисахарида трегалозы и связанных с ней в эквивалентных соотношениях миколовой и миколиновой высокомолекулярных жирных кислот, – трегалоза-6,6'-димиколат (С186Н366О117). Корд-фактор не только оказывает токсическое действие на ткани, но и защищает туберкулезные палочки от фагоцитоза, блокируя окислительное фосфорилирование в митохондриях макрофагов. Будучи поглощенными фагоцитами, они размножаются в них и вызывают их гибель. Корд-фактор обладает двумя характерными свойствами, указывающими на его важную роль как основного фактора патогенности.
1. При внутрибрюшинном заражении белых мышей он вызывает их гибель (после нескольких повторных инъекций по 0,005 мг) через 1 – 2 нед. после первой инъекции с явлениями распространенной легочной гиперемии. Подобным действием не обладает ни одна другая фракция туберкулезной палочки.
2. Он подавляет миграцию лейкоцитов больного туберкулезом человека (in vivo и in vitro).
M. tuberculosis, лишенные корд-фактора, являются непатогенными или слабопатогенными для человека и морских свинок. С необычным химическим составом туберкулезных клеток связана также способность их вызывать характерную для туберкулеза реакцию гиперчувствительности замедленного типа, выявляемую с помощью туберкулиновой пробы.
Помимо M. tuberculosis, заболевания людей могут вызывать M. bovis – возбудитель туберкулеза крупного рогатого скота, и M. avium – возбудитель туберкулеза птиц.
M. bovis – короткие и умеренно длинные толстые палочки. M. avium отличаются большим полиморфизмом (короткие и длинные палочки, иногда нити), оптимальная температура для их роста 42 – 43 °C.
Основное отличие M. bovis от M. tuberculosis заключается в их высокой патогенности для кроликов и других млекопитающих. При внутривенном заражении M. bovis в дозах 0,1 и 0,01 мг культуры кролики погибают от генерализованного туберкулеза через 3 – 6 нед. Заражение кроликов M. tuberculosis даже в дозе 0,1 мг не вызывает их гибели, у них развиваются местные доброкачественные, непрогрессирующие очаги в легких. При внутривенном заражении кроликов M. avium животные погибают через 1,5 – 2 нед. от септикопиемии.
Род Mycobacterium включает более 40 видов. Как оказалось, многие из них нередко выделяются в различных странах мира от людей, теплокровных и холоднокровных животных, страдающих заболеваниями легких, кожи, мягких тканей и лимфатических узлов. Эти заболевания получили название микобактериозов. Различают три типа микобактериозов, зависящих от вида микобактерий и иммунного статуса организма.
I. Генерализованные инфекции с развитием видимых невооруженным глазом патологических изменений, внешне напоминающих туберкулезные, но гистологически несколько отличающиеся от них.
II. Локализованные инфекции, характеризующиеся наличием макро– и микроскопических поражений, выявляемых в определенных участках тела.
III. Инфекции, протекающие без развития видимых поражений; возбудитель обнаруживается в лимфатических узлах внутриклеточно или внеклеточно.
По патогенным свойствам род Mycobacterium подразделяют на две группы: 1) патогенные и условно-патогенные (потенциально патогенные) и 2) сапрофиты. Для их ускоренной предварительной дифференциации учитывают прежде всего три признака: а) скорость и условия роста; б) способность к пигментообразованию; в) способность синтезировать никотиновую кислоту (ниацин).
По скорости роста род Mycobacterium подразделяют на три группы:
1. Быстрорастущие – крупные видимые колонии появляются ранее 7-го дня инкубации (18 видов).
2. Медленнорастущие – крупные видимые колонии появляются после 7 и более дней инкубации (20 видов).
3. Микобактерии, которые требуют специальных условий для роста или не растут на искусственных питательных средах. К этой группе относятся два вида: M. leprae и M. lepraemurium.
Дифференциация видов микобактерий среди быстро– и медленнорастущих проводится с учетом ряда их биохимических признаков: восстановление нитратов, теллурита; наличие каталазы, уреазы, никотин– и пиразинамидазы, способность синтезировать ниацин; а также пигментообразование (см. табл. 46).
По способности к пигментообразованию микобактерии также делят на 3 группы:
1. Фотохромогенные – образуют пигмент лимонно-желтого цвета при росте на свету.
2. Скотохромогенные – образуют пигмент оранжево-желтого цвета при инкубировании в темноте.
3. Нефотохромогенные – пигмента не образуют (независимо от наличия света), иногда культуры имеют светло-желтоватую окраску.
К патогенным и потенциально патогенным относится 24 вида.
1. Медленнорастущие:

3. Не растущие внеклеточно или требующие специальных условий для роста:

К наиболее частым возбудителям туберкулеза и микобактериозов относятся:
M. tuberculosis M. bovis M. ulcerans

Все они медленнорастущие, нефотохромогенные (кроме M. kansasii) микобактерии. Основные различия между ними указаны в табл. 49.
В России главную роль в этиологии и эпидемиологии туберкулеза играет M. tuberculosis, на долю M. bovis приходится 2 – 3 % (в мире на долю этого возбудителя приходилось 4 – 20 %) заболеваний. Однако в африканских странах, США и ряде других стран микобактериозы, вызванные иными видами, составляют до 30 % всех заболеваний, относимых к туберкулезным.
Таблица 49
Дифференциальные признаки некоторых медленнорастущих видов рода Mycobacterium
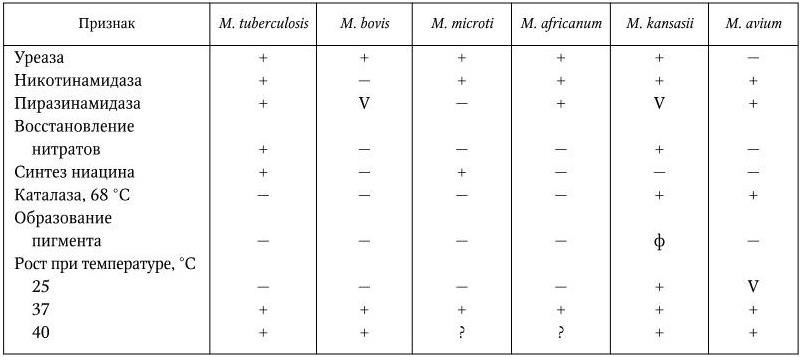
Примечание. (+) – признак положительный; V – признак непостоянный; ( – ) – признак отрицательный; ф – фотохромогенный.
Для культивирования туберкулезных бактерий предложены различные питательные среды: глицериновые, картофельные с желчью, яичные, полусинтетические и синтетические. Наилучшей считается яичная среда Левенштейна – Иенсена. Кроме того, предложена специальная полужидкая среда для выделения L-форм M. tuberculosis. Эффективность получения культур микобактерий зависит от строгого соблюдения ряда условий: кислая рН, оптимальная температура, высокое качество питательной среды, достаточное обеспечение О2, соответствующая посевная доза, особенно с учетом возможного наличия измененных форм возбудителя.
Антигенная структура M. tuberculosis. В антигенном отношении этот вид однороден (сероваров не выявлено), имеет большое сходство с M. bovis и M. microti, но существенно отличается от других видов. Однако микробная клетка имеет сложный и мозаичный набор антигенов, способных вызывать в организме человека и животных образование антиполисахаридных, антифосфатидных, антипротеиновых и иных антител, различающихся по своей специфичности. Живые и убитые бактерии способны индуцировать развитие гиперчувствительности замедленного типа. Этим свойством не обладают ни белки, ни одна из липидных фракций микобактерий.
Для внутривидовой дифференциации M. tuberculosis разработана система классификации, основанная на фаготипировании штаммов с помощью набора из десяти микобактериофагов: 4 основных и 6 вспомогательных.
Патогенность для лабораторных животных. Наиболее восприимчивы к M. tuberculosis морские свинки. При любом способе заражения туберкулезная палочка вызывает у них генерализованную форму туберкулеза, от которой свинка погибает через 4 – 6 нед. При подкожном заражении через 1,5 – 2 нед. на месте введения образуется инфильтрат, переходящий в язву, которая не заживает до гибели животного. Регионарные лимфатические узлы увеличиваются, становятся плотными и подвергаются казеозному распаду. В печени, селезенке, легких и других органах образуются многочисленные бугорки, в которых при бактериоскопии обнаруживаются M. tuberculosis.
Эпидемиология. Источником заражения являются больной туберкулезом человек, реже животные. От больного человека возбудитель выделяется главным образом с мокротой, а также с мочой, испражнениями и гноем. Туберкулезная палочка проникает в организм чаще всего через дыхательные пути – воздушно-капельным и, особенно часто, воздушно-пылевым путем. Однако входными воротами могут быть любые слизистые оболочки и любой поврежденный участок кожи. Заражение M. bovis от крупного рогатого скота происходит в основном алиментарным путем через инфицированные молоко и молочные продукты. Туберкулез, вызванный M. bovis, наблюдается чаще всего у детей, поскольку молоко для них служит основным продуктом питания. Однако заражение M. bovis от больных животных возможно и аэрогенным путем.
Особенности патогенеза. В зависимости от двух основных способов заражения первичный туберкулезный очаг локализуется или в легких, или в мезентеральных лимфатических узлах. Однако некоторые специалисты считают, что вначале происходит лимфогематогенное распространение возбудителя в обоих случаях заражения, а потом он избирательно поражает легкие или другие органы и ткани. При попадании через дыхательные пути (или другим способом) в альвеолы и бронхиальные железы туберкулезные палочки вызывают образование первичного аффекта в виде бронхопневмонического фокуса, из которого они по лимфатическим сосудам проникают в регионарный лимфатический узел, вызывая специфическое воспаление. Все это вместе: бронхопневмонический фокус + лимфангоит + лимфаденит – и образует первичный туберкулезный комплекс (первичный очаг туберкулеза). Туберкулезная палочка, благодаря наличию в ее клетках различных жирных кислот и других антигенов, вызывает в тканях определенную биологическую реакцию, которая приводит к формированию специфической гранулемы – бугорка. В центре его обычно располагаются гигантские клетки Пирогова – Лангганса со множеством ядер. В них обнаруживаются туберкулезные палочки. Центр бугорка окружен эпителиоидными клетками, которые составляют главную массу бугорка. По периферии его располагаются лимфоидные клетки. Судьба первичного очага может быть различной. В тех случаях, когда общая резистентность ребенка в силу ряда причин снижена, очаг может увеличиваться и подвергаться творожистому (казеозному) распаду в результате действия токсических продуктов туберкулезной палочки и отсутствия в бугорках кровеносных сосудов. Такая казеозная пневмония может стать причиной тяжелой первичной легочной чахотки, а при попадании возбудителя в кровь – генерализованного туберкулеза, приводящего ребенка к смерти. В большинстве же случаев при наличии достаточно высокой естественной резистентности организма первичный очаг через некоторое время окружается соединительнотканной капсулой, сморщивается и пропитывается солями кальция (обызвествляется), что рассматривается как завершение защитной реакции организма на внедрение туберкулезной палочки и означает формирование уже приобретенного нестерильного (инфекционного) иммунитета к туберкулезу, так как микобактерии могут сохранять жизнеспособность в первичном очаге многие годы.
В случае заражения алиментарным путем туберкулезные палочки попадают в кишечник, захватываются фагоцитами слизистой оболочки и заносятся по лимфатическим путям в регионарные кишечные лимфатические узлы, вызывая их характерные поражения. По мнению некоторых специалистов, туберкулезные палочки в этом случае через ductus thoracicus и правые отделы сердца также могут проникнуть в легкие и стать причиной туберкулеза легких.
Туберкулезная палочка может поражать практически любой орган и любую ткань с развитием соответствующей клиники заболевания.
Для клиники туберкулеза легких характерно чередование периодов выздоровления, наступающих после эффективной химиотерапии, и частых рецидивов, причиной которых являются сохранение в организме туберкулезных палочек, особенно в виде L-форм, и изменение иммунного статуса больного. L-формы микобактерий мало вирулентны, но, возвращаясь в исходную форму, они восстанавливают вирулентность и способны вновь и вновь вызывать обострения процесса.
Особенности иммунитета. Организм человека обладает высокой естественной резистентностью к возбудителю туберкулеза. Она и является причиной того, что в большинстве случаев первичное заражение приводит не к развитию заболевания, а к формированию очага, его отграничению и обызвествлению. Естественная резистентность во многом определяется социально-бытовыми условиями жизни, поэтому у детей, находящихся в тяжелых бытовых условиях, она может быть легко подорвана, и тогда первичное заражение приведет к развитию тяжелого туберкулезного процесса. Ухудшение условий жизни взрослых людей также может привести к ослаблению и естественной резистентности, и приобретенного иммунитета. С 1991 по 1996 г. показатель заболеваемости туберкулезом в России вырос с 30,6 до 42,2, а смертность возросла с 7,9 до 15,0 на 100 000 населения.
Приобретенный постинфекционный иммунитет при туберкулезе имеет ряд особенностей. Хотя у больных и переболевших обнаруживаются антитела к различным антигенам туберкулезной палочки, не они играют решающую роль в формировании приобретенного иммунитета. Для понимания его природы при туберкулезе очень важными были следующие наблюдения Р. Коха. Он показал, что если ввести здоровой морской свинке туберкулезные палочки, в месте заражения через 10 – 14 дней формируется отграниченный инфильтрат, а затем – упорно не заживающая до самой смерти свинки язва. Одновременно идет распространение возбудителя по лимфатическим путям, которое и приводит к генерализованному процессу и гибели животного. Если же ввести живые туберкулезные палочки морской свинке, зараженной за неделю до этого туберкулезом, то реакция развивается быстрее: воспаление появляется через 2 – 3 дня, приводит к некрозу, а образующаяся язва быстро заживает. При этом процесс ограничивается местом нового заражения и распространения возбудителя из него не происходит. Феномен Коха свидетельствует о том, что инфицированный туберкулезной палочкой организм отвечает на повторное заражение совершенно иначе, чем здоровый, так как у него к возбудителю сформировалась повышенная чувствительность (сенсибилизация), благодаря чему он приобрел способность быстро связывать новую дозу возбудителя и удалять ее из организма. Сенсибилизация проявляется в виде гиперчувствительности замедленного типа, она опосредуется системой Т-лимфоцитов. Т-лимфоциты с помощью своих рецепторов и при участии белков МНС класса I распознают клетки, инфицированные туберкулезными палочками, атакуют их и разрушают. Специфические антимикробные антитела, связываясь с различными микробными антигенами, образуют циркулирующие иммунные комплексы (ЦИК) и способствуют удалению антигенов из организма. Вместе с тем, взаимодействуя с микробными клетками, антитела к корд-фактору и другим факторам вирулентности могут оказывать токсическое действие на микобактерии; антитела к полисахаридным антигенам – усиливать фагоцитоз, активировать систему комплемента и т. д.
Аллергическая перестройка организма играет большую роль в патогенезе туберкулеза. Заболевание у взрослых людей, уже инфицированных туберкулезной палочкой, в большинстве случаев протекает в относительно доброкачественной форме местного процесса в легких, а не в виде генерализованного процесса, как у детей при первичном заражении. Появление реакции гиперчувствительности замедленного действия к туберкулезной палочке свидетельствует о формировании к ней приобретенного постинфекционного (и поствакцинального) иммунитета. Этот тип гиперчувствительности замедленного типа и был впервые выявлен Р. Кохом с помощью туберкулиновой пробы.
Туберкулиновая проба и ее значение. Свой препарат туберкулина Р. Кох получил следующим образом. Он стерилизовал текучим паром при 100 °C в течение 30 мин 5 – 6-недельную культуру туберкулезной палочки на глицериновом бульоне, а затем выпаривал ее при температуре 70 °C до 1/10 объема и фильтровал. Лица, инфицированные туберкулезной палочкой, на введение небольших доз туберкулина отвечают характерной реакцией: на месте внутрикожного введения не ранее чем через 6 – 8 ч появляется небольшое уплотнение, максимальное развитие реакции происходит в течение 24 – 48 ч, – образуется хорошо отграниченная папула диаметром не менее 0,5 см с геморрагическим или некротическим центром. Туберкулиновая аллергическая реакция является очень специфической. Подобную сенсибилизацию можно вызвать только цельными живыми или убитыми туберкулезными палочками, она выявляется туберкулином, но он сам по себе не вызывает такой сенсибилизации. Положительная туберкулиновая проба специфически свидетельствует об инфицировании организма туберкулезной палочкой и, следовательно, о наличии к ней приобретенного иммунитета. Туберкулиновая проба имела важное диагностическое значение для выявления первичного заражения туберкулезом детей в то время, когда не проводилась обязательная массовая вакцинация их против туберкулеза, но не взрослых, так как они в большинстве случаев инфицированы туберкулезной палочкой. Ныне туберкулиновая проба повсеместно используется для контроля эффективности противотуберкулезной вакцинации. В связи с тем, что старый коховский туберкулин содержит различные посторонние вещества и трудно стандартизуется, с 1934 г. для туберкулиновых проб используется высокоочищенный препарат туберкулина, полученный Ф. Зейбертом – PPD-S (purified protein derivative-Seibert). Международная стандартная единица туберкулина 0,000028 мг сухого порошка. Для определения туберкулиновой чувствительности используется 0,0001 мг PPDS. В нашей стране выпускают старый коховский туберкулин (АТК – альт-туберкулин Коха), содержащий 10 000 ТЕ (туберкулиновых единиц) в 1 мл (он применяется для накожной пробы и градуированной накожной пробы по Пирке), и очищенный препарат PPD, содержащий или 5 ТЕ в 0,1 мл или 100 ТЕ в 0,1 мл. Очищенный препарат PPD, содержащий 5 ТЕ/0,1 мл, используется для внутрикожной пробы Манту с целью отбора лиц, подлежащих ревакцинации. Ревакцинации подлежат лица, отрицательно реагирующие на внутрикожное введение 5 ТЕ PPD. Кроме того, имеются препараты-сенситины для выявления повышенной чувствительности к другим патогенным микобактериям.
Лабораторная диагностика. Для диагностики туберкулеза применяют все методы: бактериоскопический, бактериологический, серологический, биологический, аллергические пробы, ПЦР. При бактериоскопическом исследовании исходного материала (мокрота, моча, гной, спинномозговая жидкость, испражнения) необходимо учитывать, что содержание в нем микобактерий может быть незначительным, выделение их эпизодическим и в нем могут быть измененные варианты возбудителя, в том числе L-формы. Поэтому для повышения вероятности обнаружения микобактерий туберкулеза используют методы концентрирования их с помощью центрифугирования или флотации, а также фазово-контрастной (для обнаружения L-форм) и люминесцентной микроскопии (в качестве флуорохромов используют аурамин, аурамин-родамин, акридиновый оранжевый и др.).
Биологический метод – заражение морских свинок – является одним из наиболее чувствительных. Считается, что заражающая доза возбудителя для них составляет несколько клеток. Морские свинки могут быть использованы и для обнаружения L-форм туберкулезных бактерий, но в этом случае необходимо сделать несколько последовательных заражений, так как L-формы обладают меньшей вирулентностью и вызывают у свинок доброкачественную форму туберкулеза, которая в случае реверсии L-форм в исходное состояние может перейти в генерализованный процесс.
О значении туберкулиновой пробы сказано выше.
Из числа серологических реакций для диагностики туберкулеза предложены РСК, РПГА, реакции преципитации, методы иммуноферментного анализа (в том числе точечного), радиоиммунный метод, иммуноблотинг, реакция агрегат-гемагглютинации (для обнаружения ЦИК) и др. Использование различных антигенов позволяет обнаруживать наличие определенных антител. Для совершенствования серологических методов диагностики туберкулеза важное значение имеет получение моноклональных антител к различным антигенам микобактерий. Это позволит выявить те специфические эпитопы туберкулезных бактерий и соответственно те антитела к ним, обнаружение которых имеет наибольшее диагностическое значение, а также позволит создать коммерческие тест-системы для иммунодиагностики туберкулеза.
Среди всех методов микробиологической диагностики туберкулеза решающим все же остается бактериологический. Он необходим не только для постановки диагноза болезни, но и для контроля эффективности химиотерапии, своевременной оценки чувствительности микобактерий к антибиотикам и химиопрепаратам, диагноза рецидивов туберкулеза, степени очищения больного организма от возбудителя и выявления его измененных вариантов, особенно L-форм. Исследуемый материал перед посевом необходимо обрабатывать слабым раствором серной кислоты (6 – 12 %) для устранения сопутствующей микрофлоры. Выделение чистых культур микобактерий ведут с учетом скорости их роста, пигментообразования и синтеза ниацина. Дифференциацию между отдельными видами микобактерий осуществляют на основании их биологических свойств, как указано выше. Вопрос о вирулентности микобактерий решается с помощью биологических проб и на основании обнаружения корд-фактора. Для этой цели предложены цитохимические реакции. Они основаны на том, что вирулентные микобактерии (содержащие корд-фактор) прочно связывают красители – нейтральный красный или нильский голубой – и при добавлении щелочи сохраняют цвет краски, а раствор и невирулентные микобактерии изменяют свою окраску.
Для более быстрого выделения возбудителя туберкулеза предложен метод микрокультур. Суть его состоит в том, что на предметное стекло наносят исследуемый материал, обрабатывают его серной кислотой, отмывают, стекло помещают в цитратную лизированную кровь и инкубируют при температуре 37 °C. Уже через 3 – 4 сут. рост микобактерий на стекле проявляется в виде микроколоний, которые к 7 – 10-му дню достигают максимального развития, а микобактерии хорошо выявляются при микроскопии. При этом вирулентные микобактерии образуют змеевидные колонии, а невирулентные растут в виде аморфных скоплений.
Для обнаружения L-форм используют культуральный, биологический и иммунофлуоресцентный методы. В связи с широким распространением лекарственноустойчивых штаммов микобактерий возникла необходимость усилить контроль за этим процессом. С этой целью, а также для более точной идентификации и дифференциации микобактерий используют молекулярно-генетические методы, в частности, метод типирования штаммов, основанный на выявлении различий в структуре генома микобактерий – геномная дактилоскопия. Метод заключается в обнаружении в геноме микобактерии ряда повторяющихся нуклеотидных последовательностей и анализе полиморфизма длин фрагментов рестрикции. В качестве зонда (праймера) обычно используют IS6110 (англ. insertion sequence – вставочная последовательность). В хромосоме микобактерии, как правило, имеется несколько копий элемента IS6110, которые отличаются высокой стабильностью своего местоположения, что позволяет точно идентифицировать различные штаммы.
Биологический способ обнаружения L-форм заключается в серии последовательных пассажей на морских свинках.
Для иммунофлуоресцентного метода используют диагностические сыворотки, содержащие меченные флуорохромом антитела к антигенам L-форм.
Лечение. Консервативное лечение туберкулеза проводят с помощью антибиотиков и химиопрепаратов. Препараты I ряда (более ранние) включают производные парааминосалициловой кислоты (ПАСК), гидразида изоникотиновой кислоты (ГИНК) – изотиазид (тубазид), фтивазид и др. и препараты группы стрептомицина. Препараты II ряда – циклосерин, канамицин, флоримицин, рифампицин и другие антибиотики. У микобактерий к химиопрепаратам, в особенности I ряда, часто наблюдается устойчивость, поэтому лечение должно сопровождаться контролем степени чувствительности их к применяемым препаратам.
Профилактика. Помимо проведения широких социально-экономических мероприятий, направленных на улучшение жизни населения, раннего и своевременного выявления больных туберкулезом и оказания им эффективной лечебной помощи, большое значение имеет плановая массовая вакцинация против туберкулеза. Она осуществляется вакциной БЦЖ, полученной А. Кальметтом и Ш. Гереном из ослабленного многолетними пересевами штамма M. bovis. Вакцинации подлежат все новорожденные дети на 5 – 7-й день жизни. Вакцину, содержащую 0,05 мг сухих живых бактерий в объеме 0,1 мл, вводят внутрикожно. Ревакцинацию проводят в возрасте 7 – 12 – 17 – 22 и 27 – 30 лет только лицам, отрицательно реагирующим на внутрикожную пробу Манту (5 ТЕ/0,1 мл).
Большую роль в общей системе мер борьбы с туберкулезом в стране сыграло создание специализированной противотуберкулезной службы, включающей различные лечебные учреждения, в том числе диспансеры, санатории и т. п., а также проведение массового флюорографического обследования населения.
| <<< Назад Глава 65 Микобактериозы |
Вперед >>> Микробиология лепры |
- Иерсинии – возбудители псевдотуберкулеза (Y. pseudotuberculosis) и кишечного иерсиниоза (Y. enterocolitica)
- Микробиология бруцеллеза
- Микробиология чумы
- Микробиология: словарь терминов
- Микробиология
- Микробиология: конспект лекций
- Часть III Микробиология и другие науки
- Космическая микробиология
- Глава 27 Микробиология — основа новейших технологий
- Глава 25 Микробиология и космос
- Глава 14 Шахматы и микробиология
- Глава 20 Микробиология и генетика
