Книга: Происхождение жизни. От туманности до клетки
Обойденные и вымершие аминокислоты
| <<< Назад Древняя история белков записана в рибосоме |
Вперед >>> «Рабочий код» и происхождение генетического кода |
Обойденные и вымершие аминокислоты
В предыдущей главе мы обсуждали возможные альтернативные варианты биохимии – на других химических элементах, в других растворителях, с другими генетическими молекулами вместо ДНК и РНК. Настало время обсудить происхождение набора из 20 аминокислот, составляющего белки, и оценить возможные альтернативы.
Во многих случаях природа выбрала наиболее простые аминокислоты из возможных. Аланин, например, – это самая обыкновенная аминокислота без особых примет. Глицин – единственная возможная аминокислота без боковой группы, благодаря чему по глицину белковая цепь может свободно изгибаться и вращаться. Также в стандартном наборе используются самые простые и доступные кислые аминокислоты (аспарагиновая, глутаминовая) и их амиды (аспарагин, глутамин), аминокислоты со спиртовой группой (серин, треонин), серосодержащие (цистеин), ароматические (фенилаланин, тирозин) с важной для многих ферментов имидазольной группой (гистидин) и жесткие, не допускающие вращения цепи (пролин) (Weber and Miller, 1989). Сложнее ситуация в группах положительно заряженных и неполярных аминокислот.
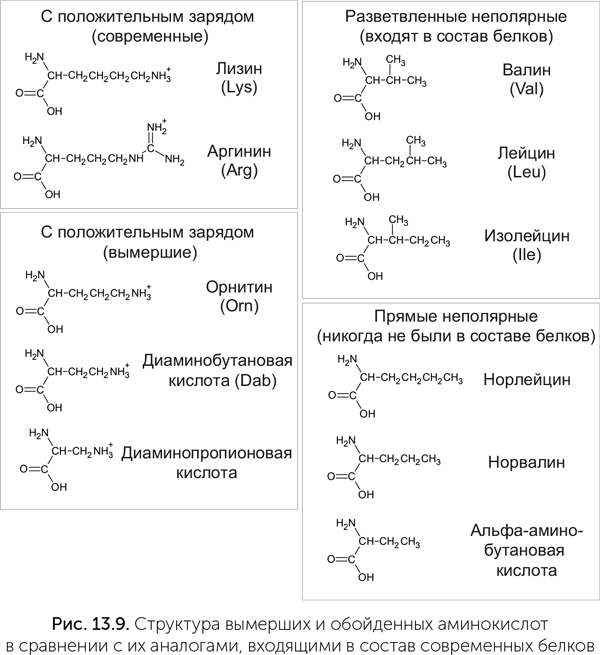
В стандартном наборе имеется две положительно заряженные аминокислоты – аргинин и лизин. Обе они имеют длинную боковую цепь и сложный путь биосинтеза. В аппарате Миллера и в метеоритах лизин и аргинин не встречаются, зато есть более простые аминокислоты со второй аминогруппой: диаминопропионовая, диаминобутановая и диаминопентановая (орнитин, рис. 13.9). Эти же три аминокислоты есть и в клетках. Диаминопропионовая и диаминобутановая кислоты встречаются у бактерий в составе пептидов специального назначения: антибиотиков и переносчиков железа. Орнитин является промежуточным продуктом в синтезе аргинина и есть у всех организмов – от бактерий до человека. Значит, возможно, что эти аминокислоты были доступны для включения в белки с самого начала, но по каким-то причинам вместо них были выбраны более сложные аргинин и лизин.
Мы можем быть уверены, что аминокислоты со второй аминогруппой входили в состав самых древних белков. Эти белки, чтобы эффективно работать в мире РНК, должны были прочно связываться с молекулами РНК, как, например, рибосомные белки. Такое связывание требует, чтобы белок нес положительный электрический заряд, т. е. имел свободные аминогруппы, которые в водной среде оказываются положительно заряжены. Рибосомные белки своим положительным зарядом компенсируют отрицательный заряд сахарофосфатного остова РНК, и только благодаря им рибосомная РНК длиной более 3000 звеньев может свернуться компактно (Hartman and Smith, 2014).
И аргинин, и лизин имеют длинные и сложные пути биосинтеза, состоящие из восьми-девяти стадий, и маловероятно, что их синтез мог проходить без участия полноценных белковых ферментов. Орнитин и диаминобутановая кислота образуются в три стадии из глутаминовой и аспарагиновой кислот, а диаминопропионовая и вовсе в один шаг из серина, т. е. они явно доступнее. Более того, для лизина у разных групп микробов существуют две разные аминоацил-тРНК-синтетазы, относящиеся к двум разным семействам. Такое разнообразие аминоацил-тРНК-синтетаз может означать, что они появились независимо, а значит, лизин вошел в генетический код уже после расхождения крупных групп микробов. Итак, у нас есть три факта:
1) положительно заряженные аминокислоты должны были быть в белках с самого начала;
2) современные аминокислоты этой группы – лизин и аргинин – имеют очень длинный и сложный биосинтез и могли возникнуть в эволюции позже других аминокислот. Для лизина это подтверждается и разнообразием аминоацил-тРНК-синтетаз;
3) существуют более простые и доступные аминокислоты с положительным зарядом, такие как орнитин, они есть в клетках, но не входят в состав белков.
Возникают подозрения, что простые положительно заряженные аминокислоты когда-то входили в состав белков, но были затем вытеснены лизином и аргинином.
Какие причины могли привести к замене простых положительно заряженных аминокислот на более сложные? В экспериментах с искусственными пептидами из аланина и разных положительно заряженных аминокислот было показано (Padmanabhan et al., 1996), что положительный заряд близко к остову пептидной цепи нарушает стабильность альфа-спирали, и лишь лизин и аргинин несут положительный заряд на безопасном расстоянии. Так что, видимо, причиной перехода на лизин и аргинин было усложнение белков и увеличение доли альфа-спиралей в них. Как видно по структуре рибосомных белков, альфа-спиральные укладки возникли в эволюции позже, чем бета-слои, которые устойчивы и с малыми положительно заряженными аминокислотами.
Где же эти аминокислоты могли быть в таблице генетического кода? В случае орнитина ответить на этот вопрос проще всего. Так как он является промежуточным продуктом на пути к аргинину, то, скорее всего, ему раньше принадлежали основные кодоны аргинина – CGN[11]. Также вымершим аминокислотам могла принадлежать группа кодонов AGN. В современном генетическом коде кодоны AGA и AGG принадлежат аргинину, а AGC и AGU – серину. Обе эти аминокислоты имеют еще по четыре кодона в других местах (CGN аргинина и UCN серина) и, похоже, захватили и поделили кодоны вымершей аминокислоты. Кодоны AGN могли принадлежать, например, диаминопропионовой кислоте. Диаминопропионовая кислота образуется из серина и соответствует ему по размеру, а по электрическому заряду соответствует аргинину, поэтому ее кодоны были поделены между серином и аргинином.
В группе неполярных аминокислот в состав белков входят аминокислоты с разветвленной боковой цепью – валин, лейцин, изолейцин, но не используются их аналоги с прямой боковой цепью, такие как альфа-аминобутановая кислота, норвалин и норлейцин. В опыте Миллера и в метеоритной органике неразветвленные аминокислоты образуются в больших количествах, чем разветвленные. Все три аминокислоты с прямой боковой цепью известны в составе природных пептидов-антибиотиков, а аминобутановая кислота образуется и у животных при распаде белков пищи.
Проблемы со стабильностью альфа-спирали вызывает валин, а прямые неполярные аминокислоты, наоборот, вписываются в нее идеально. Так что здесь мы не видим никакой причины для замены прямых аминокислот на разветвленные в ходе эволюции. Видимо, жизнь с самого начала имела возможность выбора между прямыми и разветвленными неполярными аминокислотами, и вторые были выбраны по какой-то причине, которая больше не важна. Например, такая причина есть в теории стереохимического соответствия кодонов и аминокислот: РНК на глине содержит «карманы», соответствующие по форме валину, лейцину и изолейцину, тогда как для неполярных аминокислот с прямой боковой цепью ни один из триплетов не образует подходящих «карманов». Другое объяснение возможно исходя из теории цианосульфидного протометаболизма (глава 7): в этой сети реакций разветвленные аминокислоты (валин и лейцин) образуются в реакциях ацетона с синильной кислотой, а эффективных путей получения их прямых аналогов нет.
| <<< Назад Древняя история белков записана в рибосоме |
Вперед >>> «Рабочий код» и происхождение генетического кода |
- Синтез белка в клетках
- Происхождение транспортных РНК
- История рибосомных РНК
- История генетического кода
- История аминоацил-тРНК-синтетаз
- Структуры и функции белков
- Древняя история белков записана в рибосоме
- Обойденные и вымершие аминокислоты
- «Рабочий код» и происхождение генетического кода
- Порядок развития белкового синтеза и генетическом кода
