Книга: Биологические основы старения и долголетия
Механизмы залечивания ДНК и жизнестойкость организмов
| <<< Назад Тепло и гены |
Вперед >>> Биогеронтология + экология = экогеронтология? |
Механизмы залечивания ДНК и жизнестойкость организмов
Сегодня известно: почти все спонтанные повреждения ДНК залечиваются. Большинство из индуцированных ионизированным излучением повреждений ДНК также репарируется. Однако скорости репарации спонтанных и индуцированных повреждений ДНК могут быть различными. Это станет понятным после того, как мы рассмотрим системы репарации повреждений ДНК. Но сразу же подчеркнем малую исследованность этих систем. Это связано прежде всего с двумя обстоятельствами. Первое можно охарактеризовать вкратце — исследовать процессы репарации спонтанных повреждений трудно из-за ограничений чувствительности традиционных методов исследования. Что касается второго обстоятельства, то для его понимания нужно сделать краткий экскурс в проблему стабильности (или, как теперь становится очевидным, нестабильности) ДНК.
До последнего времени среди молекулярных биологов, биохимиков и особенно генетиков преобладающим являлось мнение о стабильности ДНК. Например, знаменитым Уотсоном в его руководстве по молекулярной биологии подчеркнуто: "Количество ДНК в хромосомах постоянно… В пользу генетической роли ДНК свидетельствовала и ее метаболическая стабильность. В отличие от многих других клеточных молекул ДНК стабильна: атомы, однажды включенные в ее состав, не покидают молекулу".
Однако еще в 1970 году в монографии "Молекулярные механизмы старения" автор этой книги сформулировал концепцию, одно из основных положений которой состояло в том, что в клетках с относительно большой частотой возникают спонтанные изменения генома. Кстати, это заключение было сделано на основании не только анализа свойств ДНК и метаболизма клетки, но и сравнения механизмов старения с механизмами радиобиологических эффектов. Что касается последних, то к тому времени уже были получены факты, позволяющие полагать, что они по крайней мере частично определяются повреждениями ДНК. На основании такого анализа было заключено, что ДНК в клетке должна подвергаться весьма интенсивному повреждению, особенно окислительной деструкции химически активными внутриклеточными метаболитами.
Исходя из этой концепции, а также основываясь на закономерностях, свидетельствующих о роли повреждений ДНК в старении, в лекции, прочитанной в 1972 году в Киеве на IX Международном конгрессе геронтологов, нами было сформулировано следующее следствие: в ряду различных видов млекопитающих существует прямая корреляция между способностью клеток определенного организма к репарации ДНК и видовой продолжительностью жизни.
Несколько лет спустя (в 1974 году) американские радиобиологи Р. В. Харт и Р. Б. Сэтлоу обнаружили такую корреляцию при исследовании репаративного синтеза ДНК, индуцированного УФ излучением в клетках 10 плацентарных млекопитающих, различающихся по видовой продолжительности жизни примерно в 50 раз (от полевки, живущей менее 2 лет, до человека, видовая продолжительность жизни которого составляет около 100 лет).
Однако в этой и последующих работах, в которых также наблюдали корреляцию между продолжительностью жизни организмов и способностью их клеток к репарации ДНК, исследовали репарацию не спонтанных, а индуцированных излучениями повреждений ДНК. И пришли к выводу: часть спонтанных повреждений ДНК устраняется с помощью тех же ферментов, которые участвуют и в репарации повреждений ДНК, индуцируемых УФ или ионизирующим излучением, или химическими мутагенами.
Одна из наиболее изученных систем репарации, защищающих клетки от таких (генотоксических и мутагенных) агентов, состоит из ряда ферментов, залечивающих повреждения в ДНК путем вырезания измененных ее участков и замены их нормальными. Вспомним: хирург, прежде чем зашить концы ран, проводит их хирургическую обработку — удаляет поврежденные участки ткани, "освежает" рану. Процесс репарации начинается с выщепления измененных частей ДНК, например модифицированных оснований. Эта стадия репарации осуществляется также в несколько этапов (рис. 6).
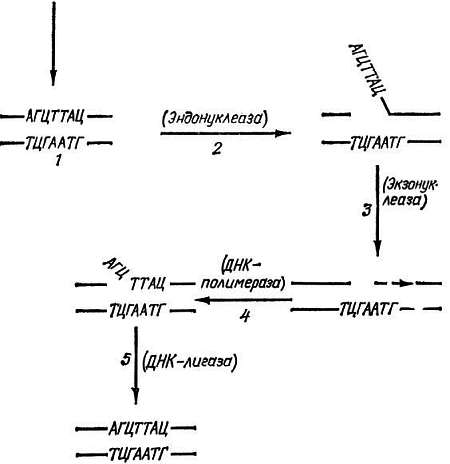
Рис. 6. Схема работы эксцизионных (вырезающих) механизмов репарации ДНК.
1. Индукция повреждения (реакция одного из оснований ДНК с ОН· или Н2О2 или другим эндогенным генотоксическим метаболитом; тепловое повреждение или попадание в ДНК квантов УФ, рентгеновского или другого вида ионизирующего излучения). 2. Узнавание повреждения и образование в ДНК разрыва. 3. Выщепление (вырезание) здорового участка ДНК, прилежащего к поврежденному. 4. Репаративный синтез ДНК. 5. Сшивание концов ДНК. В скобках указаны ферменты, катализирующие соответствующий этап репарации ДНК
Первый из них — "узнавание" повреждения в ДНК и образование вблизи него "надреза" (мы продолжаем проводить аналогию процесса репарации с работой хирурга). Такую операцию осуществляет фермент эндонуклеаза, разрушающий модифицированную нить ДНК. Затем подключается другой фермент — экзонуклеаза, который выщепляет модифицированное основание, а вместе с ним обычно и значительное количество "здоровых" оснований. В результате в ДНК образуется брешь. Поскольку же вторая нить остается целой, то, используя ее как матрицу, третий фермент — ДНК — полимераза заполняет эту брешь. Процесс репарации завершает четвертый фермент — лигаза. Этот фермент связывает вновь синтезированный участок ДНК с тем концом, который остался после процесса выщепления.
Рассмотренный пример наглядно показывает: в процессе репарации происходит синтез ДНК. Этот синтез связан не с делением клетки, а с восстановлением ДНК, поэтому его называют репаративным. Интенсивность его легко определить, добавляя в среду, где находятся клетки, меченый тимидин — вещество, которое входит в состав только ДНК. Теперь, чтобы ответить на вопрос о том, происходил ли "ремонт" ДНК, т. е. замещение отдельных ее оснований, достаточно установить, является ли ДНК клетки, не приступающей к делению, радиоактивной.
С помощью такого сравнительно простого приема нами и было получено доказательство того, что репарация ДНК происходит не только в том случае, когда клетки повреждаются физическими или химическими агентами, т. е. в необычных условиях, но и в таких условиях, которые можно считать нормальными, физиологическими. Поэтому такой процесс получил название спонтанного репаративного синтеза ДНК.
Кстати, вывод, который неизбежно следует из факта протекания спонтанного репаративного синтеза, состоит в том, что ДНК клетки в процессе нормального метаболизма повреждается. Следовательно, биологическая стабильность генома, его надежность обеспечиваются и "волшебной палочкой квантовой химии", т. е. стабильностью ее химических связей (Э. Шредингер), и системой репарации ДНК, функционирующей в клетке.
Только что рассмотренную систему репарации ДНК (по причинам, теперь, наверное, понятным читателю) называют вырезающей или эксцизионной (от англ. exision — вырезать). Одна из принципиальных особенностей репаративного синтеза ДНК, протекающего при такой репарации, состоит в том, что он осуществляется в различные фазы клеточного цикла. "Обычный" же синтез ДНК, в результате которого происходит удвоение количества ДНК и поэтому называемый редупликативным (обычно говорят "репликативный"), протекает лишь в определенную фазу жизни клетки. Таким образом, редупликативный синтез ДНК является запрограммированным, протекающим в S-фазу клеточного цикла, а репаративный — незапрограммированным, или внеплановым.
Система эксцизионной репарации ДНК и механизм ее редупликации резко отличаются по чувствительности к оксимочевине. Репаративный синтез не ингибируется под влиянием концентраций этого вещества в дозах, при которых редупликативный синтез ингибируется почти полностью. Такое различие было найдено не только в культуре клеток, но и в тканях взрослых крыс и мышей. В мозге этих животных митотическая активность глиальных клеток резко уменьшается, а нейроны взрослых животных вообще лишены способности делиться. Поэтому мы полагали, что интенсивность синтеза, связанного с делением глиальных клеток, и внепланового синтеза — величины одного порядка. Но если это так, то внеплановый синтез ДНК в мозге взрослых животных можно было определить по его резистентности к оксимочевине. Таким образом, суть проведенного нами вместе с Т. М. Третьяк эксперимента состояла в том, что животным вводили оксимочевину с таким расчетом, чтобы в течение нескольких часов примерно на 95 % ингибировать редупликативный синтез ДНК (концентрации были подобраны на основании исследования синтеза ДНК в печени подопытных крыс, а также в модельной системе на культивируемых фибробластах человека). Сравнение интенсивности редупликативного синтеза в клетках головного мозга крыс первых дней жизни и взрослых животных заставляет предположить, что наряду с репарацией спонтанных повреждений ДНК в них протекает, вероятно, и другой процесс, также не связанный с делением клеток.
Наиболее вероятное объяснение полученных нами данных состоит в том, что включение меченого тимидина в ДНК мозга взрослых крыс в значительной степени определяется репаративным (внеплановым) синтезом ДНК, который индуцируется спонтанными генетическими повреждениями. Это заключение подкрепляется результатами исследования включения 3Н-тимидина в ДНК "нейрональных" и "глиальных" фракций ядер двухлетних крыс. Было найдено, что удельная активность ДНК нейрональных ядер в расчете на 1 мкг ДНК лишь в 2 раза меньше удельной активности ДНК ядер глиальных клеток. Включение тимидина в ДНК глиальных ядер определяется в значительной степени тем, что в части глиальных ядер протекает и редупликативный синтез ДНК. Ведь известно, что деление глиальных клеток в мозге крыс и других млекопитающих происходит в течение всей жизни. Что же касается включения тимидина в нейрональные ядра, то оно, очевидно, определяется в основном репаративным синтезом ДНК.
Однако при исследовании динамики содержания меченого тимидина в ДНК головного мозга крыс были получены данные, которые невозможно объяснить лишь исходя из предположения, что внеплановый синтез ДНК связан только с репарацией спонтанных повреждений ДНК.
Эти данные показывают, что наряду с репаративным синтезом ДНК, необходимым для устранения спонтанных повреждений ДНК, в головном мозге протекают и другие формы "внепланового" синтеза ДНК. Одна из этих форм может включать обратную транскрипцию, т. е. процесс синтеза ДНК на матрице РНК, катализируемый обратной транскриптазой. Другая форма синтеза может состоять в перестройке определенных генов клеток головного мозга крыс, аналогичной перестройке иммуноглобулиновых генов В-лимфоцита при его дифференцировке. В этом процессе может участвовать часть тех ферментов, которые катализируют процесс репарации спонтанных повреждений ДНК.
Как известно, существует два типа памяти, определяемых функциями центральной нервной системы и иммунологической системы. Возможно, что это формальное сходство двух систем имеет в своей основе один и тот же молекулярный механизм — перестройку определенных генов (соединение их константных и вариабельных участков и мутацию в "горячих" точках последних) в процессе дифференцировки не только лимфоцита, но и нервной клетки. Обнаруживается также поразительное сходство в механизмах активации нервной клетки и лимфоцита и на уровне мембран.
Существует группа наследственных болезней, при которых увеличена частота хромосомных нарушений (аберраций), определяемых в клетках крови. При ряде таких болезней нарушена и способность клеток к репарации ДНК. И при многих из этих синдромов определяют нарушение функций иммунологической и центральной нервной системы. Обнаружение таких закономерностей еще в середине 70-х годов позволило автору этой книги предположить, что ферменты, катализирующие репарацию спонтанных повреждений ДНК, участвуют в дифференцировке лимфоцитов и нервных клеток.
Выше мы пришли к заключению, что одно из наиболее частых типов спонтанных повреждений ДНК — образование в ней апуриновых участков. Но известно, что один из ферментов, катализирующих процесс репарации апуриновых ДНК, — апуриновая ДНКаза, которая обнаружена в различных растительных и животных клетках. А при исследовании активности этого фермента в фибробластах больных людей, страдающих наследственным заболеванием — пигментной ксеродермой, снижение этой активности было найдено лишь у тех групп больных, у которых имелись нейрологические симптомы этого заболевания. Поскольку это заболевание наследственное, то, следовательно, генетический дефект по апуриновой ДНКазе должен быть и в нервных клетках больных с нейрологическим синдромом.
Апуриновые-апиримидиновые эндодезоксирибонуклеазы — семейство ферментов, участвующих в репарации не только спонтанно возникающих апуриновых и апиримидиновых участков, но и таких же участков, образованных в результате выщепления из ДНК модифицированных оснований под влиянием ферментов, получивших название ДНК-гликозилаз (так как эти ферменты разрывают гликозильную связь между основанием и сахарным остатком). Есть основания полагать, что в клетках головного мозга млекопитающих содержатся и гликозилазы, и апуриновые (апиримидиновые) эндонуклеазы. Активность последних мы обнаружили в клетках головного мозга крыс различного возраста.
Доказательство протекания репаративного синтеза ДНК в клетках человека мы получили при исследовании опухолевых клеток линии HeLa, а при определенных условиях и в нормальных клетках (фибробластах) человека. Как был буквально увиден репаративный синтез ДНК в культивируемых клетках, стоит рассказать.
Дело в том, что еще в 70-х годах репаративный синтез ДНК в клетках млекопитающих искали несколько групп ученых, известных своими пионерскими работами по репарации радиационных повреждений ДНК (Р. Б. Пайнтер с сотрудниками, Г. Смит и Р. Б. Ханавалат). Они не обнаружили такого синтеза, и благодаря их высокому авторитету интерес к спонтанному репаративному синтезу ДНК ослаб. Эти же отрицательные результаты в некоторых обзорных молекулярно-биологических работах цитировали и как доказательство стабильности ДНК. (Вспомним, что протекание или отсутствие репаративного синтеза — это показатель наличия или отсутствия повреждений ДНК.) Парадоксально, что упомянутые исследователи являются радиобиологами, а радиобиологи приняли гипотезу о нестабильности ДНК раньше всех, рассуждая так: раз существует репарация радиационных повреждений ДНК, то должна же она "что-то делать" и в необлученных клетках.
Но как же все-таки мы сумели "увидеть" репаративный синтез ДНК в необлученных культивируемых клетках человека? Эти клетки культивировали с меченым тимидином в течение двух часов, а затем его удаляли и радиоавтографическим методом исследовали меченые ядра клеток, находящихся на различных стадиях клеточного цикла. Нас особенно интересовали клетки в стадии телофазы.
Простой расчет показал, что если меченый тимидин в ДНК этих клеток имеется, то он мог попасть туда лишь в результате внепланового синтеза ДНК. Действительно, как хорошо известно, редупликативный синтез ДНК протекает лишь в S-фазе клеточного цикла, а между этой фазой и телофазой у диплоидных фибробластов проходит больше двух часов. Иными словами, наблюдая под микроскопом "телофазные" клетки с мечеными ядрами, мы могли заключить, что тимидин включился в ДНК этих клеток после завершения S-фазы, т. е. в результате внепланового и, очевидно, репаративного синтеза.
В последние годы другие авторы также пришли к заключению о протекании в различных клетках млекопитающих спонтанного репаративного синтеза ДНК.
Как уже отмечалось, система репарации апуриновых участков ДНК включает апуриновую эндонуклеазу, "узнающую" в ДНК апуриновый участок. Это начальное звено эксцизионной системы репарации апуриновых участков. Другие этапы репарации катализируются обычными экзонуклеазами ДНК, полимеразами и лигазами, составляющими эксцизионную систему репарации ДНК. Веским аргументом в пользу этого предположения может служить тот факт, что апуриновую эндонуклеазу нашли практически во всех биологических системах, в которых ее искали: бактериальных и растительных клетках, клетках различных тканей крыс, теленка и человека. Причем в клетках человека активность этого фермента, вероятно, особенно велика в связи с относительно большой (среди других млекопитающих) продолжительностью жизни.
До недавнего времени полагали, что единственный механизм репарации апуриновых участков — эксцизионный. Однако в 1977 году автор этой книги обосновал предположение о существовании нового механизма репарации апуриновых участков. В книге "Закономерности молекулярно-генетического действия химических канцерогенов" (Москва, Наука, 1977) исходя из таких закономерностей был предсказан фермент, катализирующий прямое включение пуриновых оснований в апуриновые участки. Сделано это было на основании анализа механизмов репарации апуриновых ДНК, образованных после повреждения ДНК химическими канцерогенами. Было заключено, что после разрыва гликозильной связи (между модифицированным канцерогеном, пуриновым основанием и сахарным остатком) может протекать одноэтапный процесс присоединения к сахарному остатку нормального основания. В 1979 году мы получили косвенное доказательство существования в диплоидных фибробластах человека и клетках линий HeLa такого фермента, названного нами репуриназой.
В 1979 году фермент, обладающий свойствами репуриназы, был обнаружен группой американских авторов и назван ими инсертазой. Он был исследован ими тоже в фибробластах человека и клетках линии HeLa.
Мы уделили большое внимание механизмам репарации спонтанных повреждений ДНК, поскольку, только имея представление об этих механизмах, можно понять кардинальное положение, вытекающее из всего вышеизложенного по проблеме нестабильности ДНК. Вместо классического представления (или догмы классической генетики и молекулярной биологии), что гены и составляющие их молекулы ДНК являются физически стабильными структурами, в которых лишь с очень редкой частотой происходят изменения — мутации (и то в основном лишь в процессе их редупликации), теперь приходится признать иное: ДНК и гены лишь динамически или биологически постоянны. Это означает, что в них с относительно большой частотой возникают повреждения ДНК и примерно с такой же (но, очевидно, не точно такой же!) частотой они залечиваются.
Уже то, что скорости этих противоположных процессов хотя и близки, но, судя по всему, не равны, подчеркивает фундаментальное значение пересмотра представлений о стабильности ДНК для понимания механизмов старения и долголетия.
Однако важно еще вот что. Большая роль изменений ДНК в старении клеток и целостного организма признается теперь большинством биогеронтологов и наиболее выдающимися клиницистами-геронтологами. Но как до сих пор представляют эту роль многие биогеронтологи, судя по их обзорно-теоретическим статьям? Исходя из, так сказать, классических представлений о роли мутаций в старении.
Чтобы убедиться в том, что такие представления нужно изменить, сравним частоту спонтанных мутаций с частотой повреждений генов, возникающих лишь вследствие тепловой нестабильности ДНК. Эта последняя согласно приведенной выше оценке равна около 3·103 в час, или почти 105 в сутки, или около 5·108 за 20 лет. Частота же спонтанных мутаций составляет, как правило, порядка 10-5 в расчете на одно клеточное деление для соматической клетки и в расчете на одно поколение для мутаций в половых клетках. Число генов в клетках человека и других млекопитающих считается равным порядка 105 (обычно генетики называют цифру 5·104). Следовательно, в процессе деления соматической клетки или в процессе репродукции организмов, возникает в среднем одна или, быть может, несколько мутаций.
Примем теперь во внимание, что между клеточными делениями соматической клетки человека проходит как минимум сутки, а период репродукции человека составляет 20 лет или даже больше. Сравним эти величины с приведенными значениями частот спонтанных повреждений ДНК, обусловленных физической нестабильностью, за сутки и за 20 лет. Получается, что частоты возникновения спонтанных повреждений ДНК превышают частоты спонтанных мутаций в соматических и половых клетках человека соответственно в 105 и 108 раз.
Эту оценку нужно считать приблизительной, так как при подсчете не учитывалось ни то, что гены, мутации которых до сих пор определяли, составляют небольшой процент от всей ДНК клетки, ни то, что повреждения генов возникают не только вследствие их тепловой нестабильности, но и действия на них химических мутагенов (образуемых даже в процессе нормального метаболизма), ферментов, разрушающих ДНК (ДНКаз), а также физических и химических факторов окружающей среды.
Таким образом, различие между рассчитанными скоростями мутаций и спонтанных повреждений столь велико, что если при расчетах и допущена ошибка в 10 или даже в 100 раз, это не меняет основного, можно сказать, методологического вывода: теперь при рассмотрении биологических основ старения и долголетия необходимо учитывать постоянно протекающие даже в нормально функционирующих клетках процессы повреждения и репарации ДНК.
Подчеркнем, что пионерами в исследовании важных вопросов проблемы биологической роли репарации ДНК были многие отечественные радиобиологи. Здесь я акцентировал внимание на результатах собственных исследований, т. к. они имеют прямое отношение к основам старения и долголетия; кроме того, излагая их, я стремился показать логику развития и частично "кухню" исследований.
Что же касается идеи нестабильности ДНК, природы и количественной оценки этой нестабильности, то наряду с нашими трудами пионерскими нужно признать работы шведов Т. Линдаля и Б. Найберга. Не придавая существенного значения собственному приоритету, все же отмечу, что и первые количественные оценки спонтанной нестабильности ДНК были сделаны нами на несколько месяцев раньше (на IX Международном конгрессе геронтологов, состоявшемся в начале июня 1972 года), чем вышла первая работа шведских ученых (в конце сентября 1972 года). Столь близкие сроки независимого рождения сходных концепций заставляют вспомнить давнишнюю поговорку о том, что идеи, когда приходит их срок, "носятся в воздухе".
А теперь пример, поясняющий, какое конкретное практическое значение имеет понимание закономерностей спонтанного (только теплового) повреждения ДНК. Но, чтобы он был до конца ясен, придется сделать снова краткий экскурс в теорию.
Надеюсь, приведенное чуть раньше сравнение частот спонтанных повреждений ДНК с частотами спонтанных мутаций или с частотами повреждений ДНК, индуцируемых фоновым ионизирующим излучением, убедило читателя: все существующие фундаментальные концепции эволюции нуждаются в учете спонтанной нестабильности ДНК. Ведь спонтанные мутации или мутации, индуцируемые фоновым излучением, рассматривают как основные причины генетической изменчивости и, следовательно, как основу эволюции.
Сегодня мы понимаем, что частота спонтанных повреждений ДНК в тысячи и даже миллионы раз больше интенсивности этих "классических" факторов изменчивости.
Как гены примитивных клеток, не имевших мощных систем репарации (обнаруживаемых теперь у всех клеток), могли выполнять свои функции и достаточно точно редуплицироваться? Какими способами еще, кроме систем репарации ДНК, природа сумела сохранять генетическую информацию, несмотря на интенсивное спонтанное повреждение ее хранительницы — ДНК?
Казалось бы, самый простой способ — понижение температуры существования животной клетки. Но ведь для нормального функционирования многих ферментов, в том числе, вероятно, и ферментов, участвующих в репарации ДНК, нужна физиологическая температура. У млекопитающих это, как правило, примерно 37 °C. Однако при такой температуре мужские половые клетки (гаметы) на последних стадиях развития (дифференцировки) начинают терять способность к репарации ДНК, а на конечной стадии дифференцировки мужская гамета (сперматозоид) лишается большинства ферментов, кроме тех, которые ей нужны для движения — поиска яйцеклетки, проникновения в нее и передачи ей своего генома.
Но мы теперь знаем: если способность к репарации ДНК резко снизить, то спонтанные повреждения ДНК будут накапливаться со скоростью, довольно сильно (см. рис. 5) зависящей от температуры. Даже небольшое (хотя бы на несколько градусов) понижение или повышение температуры должно привести к существенному (на 10 % или на несколько десятков процентов) снижению или повышению частоты возникновения спонтанных повреждений ДНК.
Эти количественные оценки позволяют понять, почему орган (мошонка), где образуются и хранятся мужские гаметы, в процессе эволюции человека оказался выведенным из брюшной полости — в связи с этим температура в тканях мошонки на два-три градуса меньше температуры внутренних органов.
Рассмотренная проблема, конечно, теоретическая, но из нее вытекает вполне практический (по крайней мере для будущих отцов) вопрос: стоит ли злоупотреблять перегревом в парильной или в финской бане, когда температура окружающей среды значительно больше 35 °C, если это может привести к возрастанию скорости спонтанных повреждений ДНК в половых клетках? И простая рекомендация, позволяющая снизить генетические риски у будущих поколений людей, состоит в том, чтобы в течение определенного срока до зачатия будущий отец избегал воздействия на мошонку температуры, значительно превышающей 35 °C. Точно определить этот срок, конечно, нельзя; но он должен превышать тот промежуток времени, в течение которого происходит физиологическое обновление мужских гамет в мошонке мужчин.
Может возникнуть вопрос: если сперматозоиды не обладают способностью к репарации ДНК, а в геноме клетки человека в течение часа индуцируется порядка 5 тыс. повреждений, то как вообще может поддерживаться род человеческий? Правда, как отмечалось, температура мошонки не 37 °C, а 35 °C, а содержание ДНК в гаплоидных сперматозоидах в 2 раза меньше, чем в соматических — диплоидных клетках, для которых сделаны вышеприведенные расчеты. Но это уменьшает частоту спонтанных повреждений примерно лишь до 2·103 в час, т. е. она остается исключительно высокой по сравнению с частотой спонтанных мутаций, которую большинство генетиков принимают равной порядка 1-10 в расчете на зиготу (т. е. клетку, образуемую при слиянии гаплоидной мужской половой клетки с яйцеклеткой, геном которой также является гаплоидным).
Ответ на поставленный вопрос можно дать, если обратиться к экспериментам на лабораторных животных — самцах, половые клетки которых подвергали облучению или действию химических повреждающих ДНК (генотоксических) или мутагенных агентов. Результаты этих исследований показывают: ДНК сперматозоида, поврежденная в результате таких воздействий, действительно репарируется, но после того как сперматозоид проникает в яйцеклетку. Если эта закономерность справедлива и в отношении тепловых повреждений ДНК, то можно сказать, что сохранению генетической информации в ряду человеческих поколений мы обязаны репарирующим системам яйцеклетки. Эта клетка поддерживает целостность не только своего генома, но и в прямом смысле спасает геном мужских половых клеток.
И все же если говорить об общих проблемах эволюции, вопрос остается; но теперь он, скорее, касается яйцеклеток, чем мужских гамет. Из термодинамического анализа и известных данных о механизмах репарации ДНК следует: репарация по крайней мере не всегда протекает со 100 %-ной точностью и полнотой. Исходя из имеющихся данных, предположим, что степень точности репарации ДНК составляет менее 99,99 %; полнота же репарации также хотя и очень высока, меньшей точности — она составляет не более 99,9 %. Однако и в этом случае числа нерепарированных повреждений ДНК и ошибок в процессе репарации будут очень большими в расчете на геном зиготы.
Например, если исходить из рассчитанной выше скорости образования спонтанных повреждений ДНК при 37 °C, то нужно предположить, что в ДНК яйцеклетки 20-летней женщины за 20 лет (известно: яйцеклетка остается в неделящемся состоянии до овуляции) только за счет тепловой нестабильности ДНК возникает примерно 4·108 повреждений. Из них при 99,9 %-ной полноте репарации остаются не репарированными 4·105. повреждений.
Это число примерно равно числу повреждений, которое будет содержаться в сперматозоиде, просуществовавшем в мошонке около суток. Следовательно, всего в зиготе сразу после ее образования будет 8·105 повреждений. Даже если только 10-3 часть этих повреждений будет реализована в мутации, это приведет к возникновению примерно 1000 мутаций. Кроме того, за 20 лет существования яйцеклетки в процессе репарации 4·108 повреждений в ее ДНК при 99,99 %-ной точности этой репарации может возникнуть и произойти 4·104 "ошибок". А по крайней мере часть из них также может приводить к мутациям в зиготе.
При всем этом нужно учесть, что современными генетическими методами выявляется, очевидно, лишь небольшая часть мутаций. Во всяком случае, исследование темпа спонтанных мутаций и разработку способов его снижения целесообразно проводить с учетом спонтанной нестабильности ДНК.
Предупреждение усиления процесса спонтанного повреждения ДНК в результате теплового воздействия необходимо учитывать не только в плане снижения частоты генетических болезней, т. е. в конечном счете как один из способов укрепления здоровья и долголетия будущих поколений. Клетки кожи, а в случае воздействия на людей "щедрого жара" и клетки эпителия верхних дыхательных путей также нередко подвергаются тепловому воздействию. Причем если температура прогревания клеток превысит 41 °C, то наряду с усилением процесса спонтанного повреждения ДНК может происходить нарушение процесса репарации этих повреждений. Таким образом, накопление генетических повреждений в результате такой гипертермии происходит сразу по двум различным механизмам, один из которых усиливает эффект другого.
Этот вопрос стоит обсудить в связи с широко распространившимся в последнее время движением "за щедрый жар". Сказанное только что не нужно рассматривать как призыв прекратить такое движение. Возможно, после принятия процедур, связанных с воздействием на организм человека горячей воды и пара, происходят и благоприятные изменения. Но наряду с этим удовольствием, которое человек получает от "щедрого жара", необходимо видеть и его оборотную сторону, коротко о которой сейчас было упомянуто. Кроме будущих отцов, стоит, очевидно, призвать к осторожности людей, страдающих некоторыми болезнями, при которых можно ожидать увеличенную уязвимость ДНК к повреждению (об этих болезнях мы поговорим позже). Забегая вперед, скажем также, что повреждение ДНК клеток кожи может быть одним из механизмов ее старения. Поэтому, чтобы кожа как можно дольше оставалась эластичной и без морщин, также можно порекомендовать не увлекаться тепловыми процедурами.
Все сказанное касалось местного действия тепла на ткани. Как известно, температура внутренних органов человека и других животных, называемых гомотермными, остается постоянной при изменении внешней температуры (конечно, если это изменение не выходит из определенных границ). Однако при некоторых заболеваниях терморегуляция организма нарушается, и его температура может повышаться. При выработке тактики лечения такого больного нужно, кроме всего, помнить и о разъясненном здесь равновесии между процессами спонтанного повреждения ДНК и репарации повреждений, равно как и о том, что гипертермия сдвигает это равновесие в сторону первого процесса. При температуре свыше 41–42 °C второй процесс может ингибироваться, поэтому спонтанные повреждения будут накапливаться, а это нарушит функции генетического аппарата клетки. Кстати, может быть, поэтому температура 42 °C-42,5 °C является критической для человека.
Однако при выработке отношения к общей гипертермии нужно учитывать также и другое явление. Ведь тепло действует на ДНК не только клеток человека, но и на генетический аппарат вирусов и патогенных бактерий, которые, как правило, и ответственны за развитие лихорадящих заболеваний. Особенно чувствительны к теплу вирусы, и больше других РНК-содержащие, к классу которых принадлежат и вирусы гриппа. Это связано с тем, что вирусные частицы не содержат репарирующих ферментов, а РНК-содержащие вирусы, вероятно, не могут быть репарированы и внутриклеточными репарирующими ферментами. Таким образом, повышение температуры тела может оказывать повреждающее действие на вирусные геномы в гораздо большей степени, чем на геном клеток тела. Очевидно, в будущем врач в каждом конкретном случае, учитывая различные свойства клеток организма и характер инфекции, вызывающей лихорадочное состояние, сумеет с помощью ЭВМ рассчитать оптимальную для больного температуру.
Не исключено также, что уже в ближайшем будущем биологи и медики найдут средства, снижающие скорость спонтанного повреждения клеток или увеличивающие их способность залечивать такие повреждения. Такие средства можно считать факторами, способными увеличивать долголетие человека.
К вопросу о роли повреждений ДНК в старении, а репарации ДНК — в долголетии и жизнестойкости организма мы вернемся еще не раз в этой книге. Но уже изложенного достаточно, чтобы понять: повреждение ДНК нужно отнести к числу существенных причин старения. И если бы удалось измерить степень этого повреждения и способность к репарации ДНК клеток в группе, например, пожилых людей одного возраста, то таким образом можно было бы определить один из важных показателей их здоровья и относительного постарения. Иными словами, были бы получены важные биологические показатели возраста каждого индивидуума и его отклонение в ту или иную сторону от календарного.
Есть основания полагать, что гены, обеспечивающие эффективное залечивание повреждений ДНК, определяют и жизнестойкость организмов, и их видовую продолжительность жизни. В частности, об этом свидетельствует корреляция среди млекопитающих между способностью клеток к репарации ДНК и величиной видовой продолжительности жизни организмов (рис. 7).
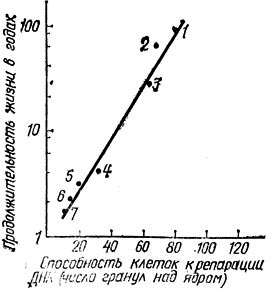
Рис. 7. Прямая корреляция между видовой продолжительностью жизни организмов различных видов млекопитающих и способностью их клеток к репарации ДНК, определенной по максимальной интенсивности репаративного синтеза ДНК, измеренного методом радиоавтографии после УФ-облучения клеток в одной и той же дозе.
По оси абсцисс — число гранул серебра над ядром, характеризующее интенсивность включения в ДНК меченого тимидина, а следовательно, интенсивность репаративного синтеза ДНК. График построен на основании данных работы Р. В. Харта и Р. Б. Сэтлоу (Труды национальной Академии наук, США, 1974)
Экологические факторы и условия жизни, уменьшающие степень повреждения ДНК или увеличивающие жизнеспособность клеток, тоже нужно отнести к факторам долголетия. Но можно ли, регулируя условия жизни, уменьшить частоту спонтанного повреждения ДНК? Оказывается, можно, если принять во внимание по крайней мере два фактора: что в механизмах этого повреждения значение имеют реакции ДНК со свободными радикалами, а также что в некоторых пищевых продуктах содержатся вещества — антиоксиданты, обладающие способностью перехватывать и нейтрализовать свободные радикалы, в том числе и обладающие генотоксическими свойствами.
| <<< Назад Тепло и гены |
Вперед >>> Биогеронтология + экология = экогеронтология? |
- 7. СТРОЕНИЕ И ОСОБЕННОСТИ ЖИЗНЕДЕЯТЕЛЬНОСТИ ЖИВЫХ ОРГАНИЗМОВ
- § 47. Раздражимость и движение организмов
- § 46. Типы обмена веществ у организмов
- 2. Систематика и номенклатура микроорганизмов
- Глава 4. ОСНОВНЫЕ СРЕДЫ ЖИЗНИ И АДАПТАЦИИ К НИМ ОРГАНИЗМОВ
- Глава 3. ВАЖНЕЙШИЕ АБИОТИЧЕСКИЕ ФАКТОРЫ И АДАПТАЦИИ К НИМ ОРГАНИЗМОВ
- ЛЕКЦИЯ № 4. Генетика микроорганизмов. Бактериофаги
- Глава 12 Распространенность микроорганизмов
- 6. Жизнь и смерть микроорганизмов
- Пределы жизни микроорганизмов
- Дружба микроорганизмов
- § 70. Взаимоотношения организмов. Биотические факторы среды
