Книга: В интернете кто-то неправ!
Язык жизни
| <<< Назад Пчелы против меда |
Вперед >>> Ловкость рук и немного мошенничества |
Язык жизни
Генетическая модификация возможна благодаря тому, что мы все произошли от общего предка. В ходе эволюции под действием отбора или просто случайно у нас менялись гены, отвечающие за внутреннюю организацию клетки, число этих клеток в организме, существование и степень сложности нервной системы, форму и количество лапок и так далее. Но самое важное осталось неизменным: все живые существа на Земле по-прежнему используют один и тот же генетический код.
Если не зарываться в детали, то основной смысл наших генов — определять аминокислотную последовательность белков, а следовательно, задавать их структуру и функции. При этом ДНК состоит всего из четырех букв-нуклеотидов (A, G, T, C); аминокислот же у нас двадцать. В связи с этим строение каждой аминокислоты закодировано не в одном нуклеотиде, а в последовательности из трех. Если в ДНК написано «ACT GTA CGC», то на этом основании будет построена последовательность из трех аминокислот: треонин — валин — аргинин. И последовательность будет именно такой независимо от того, чья клетка читает гены[34]. Принадлежит ли эта клетка мыши, человеку, бактерии E. coli, кактусу или шампиньону — она поймет эту универсальную инструкцию.
Из этого следует, что инструкции можно переносить из одного организма в другой без поправки на межвидовые барьеры[35] — и таким образом получать существ, которые вырабатывают нужные нам белки и, соответственно, обладают нужными признаками. Например, чтобы создать знаменитый золотой рис с повышенным содержанием бета-каротина, понадобилось внести в обычный рис три новых гена, кодирующих ферменты фитоенсинтазу, фитоендесатуразу и ликопинциклазу [13]. Первоначально были использованы два гена из нарциссов и один из бактерии Erwinia uredovora (она ничем не примечательна и для человека не опасна даже в целом виде), но бета-каротина вырабатывалось не очень много, и через несколько лет исследователи предложили улучшенную версию, в которой один из генов нарцисса заменили на ген кукурузы, кодирующий, как выяснилось, более эффективно работающий фермент [14].
На самом деле все эти «ген нарцисса» и «ген кукурузы» — это, скорее, популяризаторская фишка. В подавляющем большинстве случаев совершенно все равно, из кого именно брать ген, потому что гены, кодирующие важные ферменты, у самых разных организмов могут быть очень похожи. Чьи гены были в генном банке, те и используют; при желании можно вообще синтезировать сферический ген в вакууме, не принадлежащий вообще никому, просто это дорого стоит.
Так вот, семена улучшенного золотого риса содержат в среднем 25 микрограммов бета-каротина на грамм сухой массы. Бета-каротин еще должен превратиться в организме в ретинол («истинный витамин А»), и этот процесс в принципе происходит не очень эффективно, независимо от того, едите ли вы трансгенный рис или органическую морковку. Поэтому, чтобы на 100% удовлетворить суточную потребность в витамине А с помощью одного только золотого риса, необходимо каждый день варить и съедать 150 граммов этой крупы. Кажется, что это много, учитывая, как сильно рис разбухает при варке. Но, во-первых, метод в принципе ориентирован на беднейших людей, которые не покупают своим детям никаких фруктов и овощей, а кормят их одним рисом. Во-вторых, даже частичное удовлетворение потребности в витамине А позволяет предотвратить развитие слепоты, вызванной его отсутствием в пище (по оценке ВОЗ, ее жертвами становятся не менее 250 000 детей ежегодно [15]).
Золотой рис был создан еще в 2005 году, но его до сих пор не выращивают в промышленных масштабах. Отчасти это связано с жесткими испытаниями, которым подвергаются все генетически модифицированные продукты: пока химический состав золотого риса вдоль и поперек исследовали в лаборатории, пока убеждались в отсутствии аллергенов, пока кормили добровольцев, прошло несколько лет. Теперь золотой рис выращивают на экспериментальных полях в тех странах, где предполагается его использовать, чтобы выбрать самые урожайные линии. К сожалению, процесс внедрения золотого риса сталкивается с огромным сопротивлением общественности — например, в 2013 году экспериментальную делянку на Филиппинах просто вытоптали подчистую. В самом деле, слепота привычна и понятна, а вот современные биотехнологии — это таинственная и непостижимая опасность, от которой нужно во что бы то ни стало защитить наших детей.
Современные биотехнологии действительно трудно постичь — очень уж много накоплено информации. Молекулярные биологи располагают сегодня огромным количеством высокоточных методик, позволяющих определять последовательности ДНК, размножать молекулы ДНК в пробирке, разрезать их в заданных местах и соединять в новые конструкции, доставлять ДНК в клетки. Пытаться описать их все — задача прекрасная и невыполнимая (в рамках одной главы), поэтому я упомяну только о двух механизмах, которые мы позаимствовали у бактерий и поставили себе на службу.
Бактерия Agrobacterium tumefaciens[36] — природный генный инженер. Задолго до того, как люди начали строить дома, эта бактерия уже умела выращивать себе такой дом, как в фантастических фильмах, предоставляющий одновременно и убежище, и вкусную еду. Под влиянием бактерии клетки растения начинают, во-первых, бурно делиться (формируя на корнях объемные наросты, которые называются корончатыми галлами), а во-вторых, производить опины, вкусненькие химические соединения из аминокислоты и сахара, которыми бактерия питается.
Как добиться такого результата? У Agrobacterium tumefaciens есть, помимо других генов, небольшая кольцевая ДНК, Ti-плазмида. В ней есть маленький участок под названием T-ДНК, который будет встраиваться в ДНК растения и заставлять клетки бурно делиться и синтезировать для бактерии еду. А еще в Ti-плазмиде закодировано несколько белков, которые нужны для того, чтобы между клеткой растения и клеткой бактерии образовался канал, а еще для того, чтобы протащить через него T-ДНК и сделать так, чтобы она попала в ядро растительной клетки и встроилась в хозяйскую ДНК. Сама бактерия остается снаружи, Ti-плазмида остается в бактерии, а в растение попадает только небольшой фрагмент ДНК. Потом, когда растительная клетка будет делиться, она будет передавать бактериальные гены и своим потомкам.
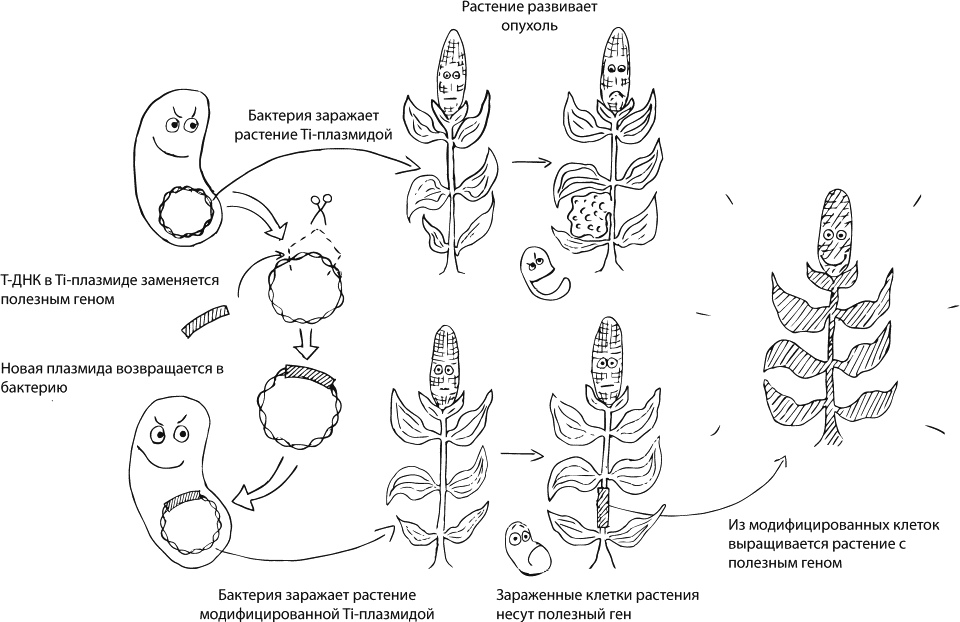
Генетики берут эту готовую конструкцию, выкидывают из нее все те гены, которые нужны бактерии, и вставляют те, которые нужны людям. Несчастная обманутая бактерия проделывает всю ту же самую работу, но модифицированная клетка растения уже не начинает бурно делиться и не производит опины — зато обладает теми свойствами, которые нужны нам. Потом из удачно модифицированной клетки, благодаря способности растений к вегетативному размножению, можно будет вырастить целый организм. Именно с помощью такого подхода получена, например, устойчивая к засухе кукуруза MON87460, которую интенсивно выращивают по обе стороны Атлантического океана. В нее был введен бактериальный ген cspB, отвечающий за производство РНК-шаперона — белка, предотвращающего неправильную укладку молекул РНК под действием стресса, в данном случае недостатка воды. Его присутствие помогает кукурузе выращивать нормальные семена, даже когда ее недостаточно поливают. По остальным экологическим и пищевым параметрам эта кукуруза не отличается от такой же, но немодифицированной [16], [17].
Главный недостаток агробактериальной трансформации (и других методик генной инженерии первого поколения) — это невозможность контролировать, в какое именно место в ДНК растения встроится новая конструкция. Вообще-то это не такая большая проблема: мы ведь получаем не единственное растение, а несколько. Если она где-то встроится так, чтобы это повлияло на остальные свойства растения, — исследователи это заметят. Если будут сомневаться — расшифруют ДНК, чтобы установить место локализации точно. Тем не менее, действительно, методы генной инженерии нового поколения направлены на то, чтобы встраивать новую ДНК не куда попало, а в заранее заданное место. Есть несколько способов делать это в пробирке, но главный писк моды сейчас — система CRISPR/Cas9, позволяющая вставлять гены в заданное место прямо в живой клетке. Эта методика может не только упростить и удешевить получение новых генетически модифицированных животных и растений, но и привести к серьезным прорывам в медицине. Я уже упоминала ее в связи с вырезанием из человеческих клеток ДНК вируса иммунодефицита человека. Другая перспективная сфера применения — генная терапия, исправление ДНК человека для излечения наследственных заболеваний. Конечно, исследования и клинические испытания в этой области проводились и до появления CRISPR/Cas9, в том числе вполне успешные, но она вполне может в обозримом будущем привести к переходу медицины на качественно новый уровень. И да, систему CRISPR/ Cas9 исследователи тоже позаимствовали у бактерий. Зачем она им? Не поверите, это их приобретенный иммунитет.
Мы все знаем со школьной скамьи, что приобретенные признаки не наследуются. Это, в общем, правильный принцип. Он остается верным и в том случае, если обретение нового признака привело к изменению генов — но не во всем организме, а в каких-то отдельных его клетках, не участвующих в размножении. Если вы переболели краснухой и у вас сформировался к ней иммунитет, то геном тех B-лимфоцитов, которые с ней боролись, изменился, пока они подстраивались под выработку оптимальных антител против данного вируса. Но у вашего ребенка все равно не будет иммунитета к краснухе, если только не пытаться клонировать его из соответствующей клетки иммунной памяти (честное слово, это плохая идея). Если почвенная агробактерия изменила клетки корня растения, чтобы они бурно размножались и вырабатывали опсины, потомки этого растения, выращенные из семян, все равно не будут этого делать: где корень, а где семена?
Но вот если генетически изменилась та самая клетка, из которой получится потомство, — это совсем другое дело. Приобретенные признаки наследуются, когда генные инженеры используют способность растений к вегетативному размножению и выращивают целый организм из модифицированной ими клетки корня. А в природе приобретенные признаки сплошь и рядом наследуются у одноклеточных существ. Все, что повлияло на геном бактерии, передается ее потомкам. Благодаря этому она может позволить себе завести самый настоящий приобретенный иммунитет, что едва ли имело бы смысл без его передачи по наследству (много ли вирусов успеет встретить бактерия за 20 минут своей жизни от деления до деления?).
Когда бактерия все-таки встречается с атакующим ее вирусом, она берет из его ДНК кусочек и встраивает в свой собственный геном — на память. Не куда попало, а между определенными генетическими последовательностями, которые называются CRISPR.
Затем этот кусочек ДНК вируса используется как фоторобот. Бактерия строит по нему РНК-зонд, который плавает по ее клетке и ищет другие такие же фрагменты вирусной ДНК. Как только находит — в дело вступает белок-ножницы Cas9, разрезающий нежелательную ДНК и таким образом блокирующий дальнейшее размножение вирусов.
Что означало открытие этой системы для генных инженеров? Счастье, радость и торжество. У них появился комплекс из РНК-зонда и белка Cas9, способный узнавать конкретные нуклеотидные последовательности, и разрезать их в определенной точке, и делать это прямо в живой клетке. Что будет, если такую систему запустить в клетку высшего организма, настроив на распознавание его генов? Сам комплекс CRISPR/Cas9 просто разрежет обе цепи ДНК, и всё. Казалось бы, ничего хорошего.
Но дальше в игру вступают наши собственные механизмы починки генов. Чтобы правильно залатать разрез, они будут сравнивать испорченную ДНК с таким же участком на второй хромосоме (мы получаем хромосомы с одними и теми же генами от папы и от мамы). Если мы разрезали плохую, мутантную версию гена, а на второй хромосоме все в порядке — получается, что клетка сама починит ген, воспользовавшись образцом. Если нам нужно что-то новое — можно подсунуть клетке дополнительный фрагмент ДНК, который она сможет принять за вторую хромосому и использовать как образец.
Это еще не предел возможного. Систему можно настроить таким образом, чтобы клетка не просто починила себе одну хромосому, но и потом использовала ее как образец для починки второй. Исследователи, описавшие этот феномен, назвали его «мутагенная цепная реакция» [18]. Правда, они скорее ломали гены, чем чинили, — в экспериментальных целях, для наглядности.
У дрозофил есть ген yellow. Он так называется потому, что при его мутациях мушка перестает вырабатывать пигмент меланин и становится желтой. Он находится на X-хромосоме, а определение пола у мух такое же, как у нас. То есть классические законы наследования предполагают, что если скрестить желтых мух с обычными, коричнево-полосатыми, то все дочери в первом поколении будут коричнево-полосатыми, потому что по крайней мере от одного из родителей они получат нормальную Х-хромосому.
Обычно так и есть. Но весной 2015 года биологи Валентино Ганц и Итан Бьер добились того, чтобы измененная хромосома («желтая») передавала свою мутацию другой хромосоме в той же клетке («коричневой»). В результате при скрещивании желтых мух с коричневыми среди родившихся девочек 243 были полностью желтыми (еще 11 обладали мозаичной окраской, и 6 все-таки были коричневыми, потому что система не сработала).
Это вопиющее нарушение законов Менделя было достигнуто с помощью системы CRISPR/Cas9. Гены, которые кодируют саму эту систему, исследователи встроили прямо внутрь гена yellow. Получилось так: когда в одной клетке оказывается хромосома с измененным yellow и хромосома с обычным yellow, то первая синтезирует систему CRISPR/Cas9, чтобы перестроить вторую по своему образу и подобию. И если, скажем, скрестить обладателя таких измененных yellow с обладателем обычных, то детишки получатся с измененными yellow. Во всех хромосомах.
Этот метод — мутагенная цепная реакция — обладает огромным потенциалом. Он позволяет быстро и эффективно — несопоставимо эффективнее, чем при селекции, — избавляться от нежелательных генов. Например, от генов, вызывающих какие-нибудь тяжелые болезни. Например, у человека.
Но об экспериментах на человеческих клетках и эмбрионах я писать пока не буду, просто потому, что к моменту выхода книжки неизбежно все изменится. Причем все может измениться и в сторону абсолютного запрета, и в сторону первых впечатляющих успехов, а может произойти и то и другое одновременно. Пока что с эмбрионами (искусственно полученными триплоидными, заведомо неспособными вырасти в людей) успел поэкспериментировать один коллектив китайских ученых — их пробовали избавить от бета-талассемии, наследственного заболевания крови [19]. Получилось так себе: из 86 эмбрионов, которым была введена генетическая конструкция, только 71 продолжил развиваться, и только у 4 из них ген был отредактирован правильно. Так что ярые противники генетического улучшения человеческих эмбрионов пока что могут выдохнуть: до этого еще очень далеко.
| <<< Назад Пчелы против меда |
Вперед >>> Ловкость рук и немного мошенничества |
- Межклеточное вещество
- 04. На что влияет нагрев планет звездами, звезд Ядрами Галактик, Ядер Галактик Ядрами Сверхгалактик
- Список литературы
- Разные человечества
- Красные тучи, закрывающие солнце
- Московская белая
- Муравей, семья, колония
- Примерные рационы для котят от месяца до пяти и старше
- Голосеменные растения завоевывают мир
- Пароль скрещенных антенн
- Позор страны
- Что такое водопад?
